- 2021-05-07 发布 |
- 37.5 KB |
- 17页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
通辽市2020年中考化学试题及答案
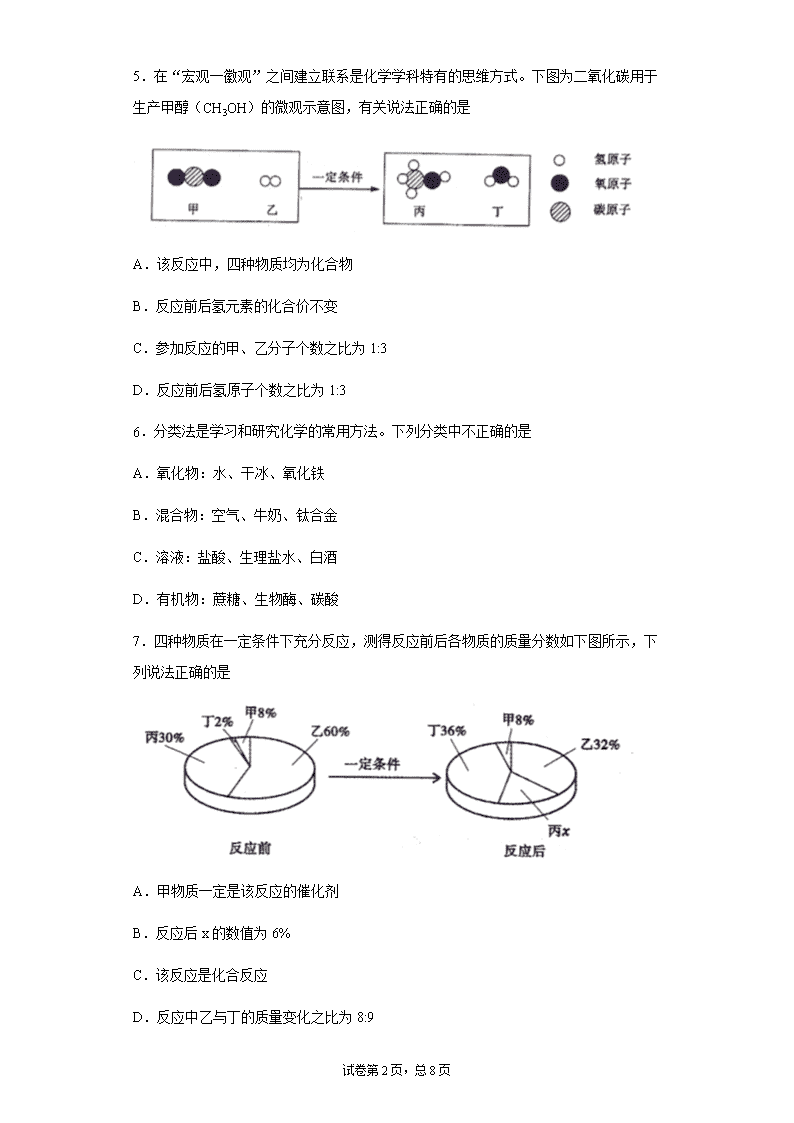
试卷第 1页,总 7页 通辽市 2020 年中考化学试题及答案 1.酒精在抗击新冠肺炎疫情中发挥了重要作用。下列过程涉及化学变化的是 A.酒精挥发 B.稀释酒精 C.碘溶于酒精 D.酒精消毒 2.小明午餐吃了米饭、红烧鱼,从营养均衡角度考虑还应补充下列哪种食物 A.炒芹菜 B.牛肉干 C.麻婆豆腐 D.荞面饼 3.规范操作是安全进行化学实验的保障。下列实验操作中正确的是 A.加入块状固体 B.点燃酒精灯 C.闻药品气味 D.制取氧气 4.下列化学方程式及对应的基本反应类型都正确的是 A. 3 3 2 2CaHCO CaCO CO H O 分解反应 B. 3 3 2Al(OH) 3HCl AlCl 3H O 复分解反应 C. 2 2 5P O P O 化合反应 D. 2 3 2Fe O 3CO CO 2Fe 高温 置换反应 5.在“宏观一徽观”之间建立联系是化学学科特有的思维方式。下图为二氧化碳用于 生产甲醇(CH3OH)的微观示意图,有关说法正确的是 试卷第 2页,总 7页 A.该反应中,四种物质均为化合物 B.反应前后氢元素的化合价不变 C.参加反应的甲、乙分子个数之比为 1:3 D.反应前后氢原子个数之比为 1:3 6.分类法是学习和研究化学的常用方法。下列分类中不正确的是 A.氧化物:水、干冰、氧化铁 B.混合物:空气、牛奶、钛合金 C.溶液:盐酸、生理盐水、白酒 D.有机物:蔗糖、生物酶、碳酸 7.四种物质在一定条件下充分反应,测得反应前后各物质的质量分数如下图所示,下 列说法正确的是 A.甲物质一定是该反应的催化剂 B.反应后 x 的数值为 6% C.该反应是化合反应 D.反应中乙与丁的质量变化之比为 8:9 8.推理是学习化学的一种重要方法。下列推理合理的是 A.同种元素的微粒质子数相同,则质子数相同的微粒一定属于同种元素 B.单质是由同种元素组成的,则只含有一种元素的纯净物一定是单质 C.Na+、Cl-的最外层电子数均为 8,则最外层电子数为 8 的粒子都是离子 D.酸雨中含有酸,所以引起酸雨的二氧化硫和二氧化氮都是酸 9.下列实验方案设计正确的是 选项 实验目的 有关实验方案 试卷第 3页,总 7页 A 鉴别氮气和二氧化碳 将燃着的木条伸入集气瓶中,使木条熄灭的是二氧化碳 B 检验铵态氮肥 加入碱液,稍热,用湿润的蓝色石蕊试纸检验 C 除去氯化钠固体中少量的氢氧化钠 溶解,加入过量的稀盐酸,蒸发 D 分离硝酸钾和氯化钠的混合物 溶解,冷却结晶,过滤,蒸发 A.A B.B C.C D.D 10.在溶质为 Cu(NO3)2、AgNO3 和 Al(NO3)3 的溶液中加入一定量的锌粉,充分反 应后过滤,得到滤渣和蓝色滤液。下列判断正确的是 A.向滤渣中加入稀盐酸可能有气泡产生 B.滤渣中一定有 Ag,可能有 Cu 和 Zn C.滤液中一定无 AgNO3 D.滤液中可能有四种金属离子 11.用所学知识,按要求完成下列各题。请用合适的化学用语填空: ①“西气东输”的“气”是指_____________________。 ②2 个氢原子_____________________。 ③人体必需的元素中,摄人量不足会引起贫血的是_____________________。 12.氟的原子结构示意图为 ,氟离子的符号为______________,则单氟磷酸钠 ( Na2PO3F)中磷元素的化合价为________________________。 13.化学在缓解人类面临的一系列问题,如能源危机、环境污染、资源匮乏和粮食供应 不足等方面,做出了积极的贡献。下列说法正确的是____________(填字母序号)。 A 煤和石油都是不可再生能源,人类应该合理开发利用 B 玻璃、不锈钢、尼龙都属于有机合成材料 C 磷酸钾属于复合肥 D 禁止塑料薄膜袋的生产和使用,减少“白色污染” 14.某地中考化学实验操作考试试题之一为测定肥皂水的 pH,某考生用干燥的滴管吸 取待测液____________,测得肥皂水的 pH_____________(填“<”“>”或“=”)7。 15.A、B、C 三种固体物质(均不含结晶水)的溶解度曲线如图所示,请回答: 试卷第 4页,总 7页 ①t1℃时,A、B、C 三种物质的溶解度由大到小的顺序是____________________。 ②当温度在 t2~t3℃之间时,A 物质与 B 物质______________(填“能”或“不能”)配 制溶质质量分数相同的饱和溶液。 ③将 A、B、C 三种物质的饱和溶液分别由 t2℃升温到 t3℃,所得溶液中溶质的质量分 数最大的物质是___________________。 ④t3℃时将 75gA 的饱和溶液稀释成 20%的溶液需加__________________g 水。 16.图中 A~D 为初中化学常见化合物。它们均由核电荷数小于或等于 20 的元素组成。 只有 A 和 B 物质类别相同。D 俗称纯碱,与足量 C 反应产生无色、无味气体。图中“一” 表示两物质发生化学反应,“→”表示物质转化方向,部分反应物、生成物及反应条件 已略去。 (1)写出化学式:B_____________,D___________。 (2)C 与 Ba(NO3)2 反应生成不溶于稀硝酸的沉淀,该反应的化学方程式: _______________。 (3)乙氨酸(NH2CH2COOH)某些性质与醋酸类似。已知: 3 3 2CH COOH KOH CH COOK H O 。请写出乙氨酸与 A 反应的化学方程式: _______________。 17.请根据下图回答相关问题: 试卷第 5页,总 7页 (1)实验 A 滤液仍然浑浊,可能的原因是________________(答一点即可)。 (2)实验 B 观察到烧杯②中溶液变红,说明分子具有的性质是_______。 (3)实验 C 中,将大小相同的白磷分别放入冷水和热水中,通入空气,观察现象。此 实验说明燃烧的条件之一是____________________。 (4)配制溶液时,按图 D 所示量取溶剂,其他操作均正确,最终导致配制的溶液溶质 质量分数_____________(填“偏大”或“偏小”)。 18.下图是实验室制取气体的常用装置,请回答下列问题: (1)写出仪器 M 的名称:_________________。 (2)实验室常用石灰石和稀盐酸制取二氧化碳,其反应的化学方程式为 ___________________。应选用的发生装置和收集装置的组合为_____________(从 A~E 中选择)。 (3)若用装置 A、F 制取氧气,按气体流向,导管口连接顺序为_______________。F 装置还可用于干燥氧气,则需盛装的干燥剂为_______________(填名称)。 (4)某气体只能用 E 装置收集,则该气体可能具有的性质为___________(填序号)。 ①能与空气中的某物质反应 ②密度与空气的密度接近 ③能与水反应 19.新型洗涤剂过氧碳酸钠(Na2CO4)固体,能瞬间清除衣服上的汗渍、果汁渍等顽 固污渍。它与水反应生成碳酸钠和其他化合物,某学习小组对产生的其他化合物进行探 究。 实验 1:溶解样品。取适量洗涤剂样品于烧杯中,加入适量蒸馏水,使之完全溶解,有 气泡产生并形成无色溶液 a。产生的气体能使带火星的木条复燃。 (提出问题)过氧碳酸钠与水反应生成的其他化合物是什么? 试卷第 6页,总 7页 (猜想与假设) 猜想一:H2O2 猜想二:NaOH 猜想三:H2O2、NaOH 猜想一、二、三除了遵循质量守恒定律外,猜想 H2O2 的其他理由是_________________。 实验 2:验证 实验步骤 实验现象 分析与结论 ①取适量溶液 a 于小烧杯中,加入稍过量的氯化钙溶 液,过滤,得到清液 b 产生白色沉淀 加入稍过量氯化钙的目的是 _______________ ②取适量清液 b 于试管中,加入过量二氧化锰,振荡 _____________ 证明过氧碳酸钠与水反应有 H2O2 生成 ③将步骤②所得混合物静置,取少量清液于试管中, 滴加氯化铁溶液 无明显现象 ___________________ (实验结论)猜想__________正确。写出过氧碳酸钠与水反应的化学方程式: ___________________。 (反思与评价)该洗涤剂保存时应密封、防潮。 20.屠呦呦因创制新型抗疟药——青蒿素和双氢青蒿素而获得诺贝尔奖。青蒿素的相对 分子质量为 282,每个分子由 15 个碳原子、5 个氧原子和 n 个氢原子构成。请计算: (1)n 为________________。 (2)28.2g 青蒿素中氧元素的质量为_________________g。 21.取氯化钡和盐酸的混合溶液 100g 于烧杯中,向其中滴加碳酸钠溶液,产生气体或 沉淀的质量与加入的碳酸钠溶液质量的关系如图所示,请回答: 试卷第 7页,总 7页 (1)产生沉淀的质量为_______________g。 (2)x 的值为_______________。 (3)求所用碳酸钠溶液中溶质的质量分数(请写出计算过程)。 答案第 1页,总 10页 参考答案 1.D 【解析】 【分析】 有新物质生成的变化叫化学变化,没有新物质生成的变化叫物理变化。 【详解】 A、酒精挥发是物质状态的变化,没有生成新物质,属于物理变化,故 A 不正确; B、稀释酒精过程中没有生成新物质,属于物理变化,故 B 不正确; C、碘溶于酒精过程中没有生成新物质,属于物理变化,故 C 不正确; D、酒精消毒过程中生成新物质,属于化学变化,故 D 正确。故选 D。 【点睛】 化学变化的特征是:有新物质生成.判断物理变化和化学变化的依据是:是否有新物质生成。 2.A 【解析】 【分析】 【详解】 人体需要的六大营养物质:蛋白质、糖类、油脂、维生素、无机盐和水;结合题意,米饭中 富含淀粉,淀粉属于糖类;红烧鱼中含有油脂、蛋白质和无机盐,可知食物中维生素含量较 少;故为使营养搭配更加合理,需要补充富含维生素的食物。 A、炒芹菜富含维生素,故正确; B、牛肉干富含蛋白质,故错误; C、麻婆豆腐富含蛋白质,故错误; D、荞面饼富含糖类,故错误。 故选:A。 3.C 【解析】 【详解】 A、取用颗粒状或块状固体试管要平放,将药品放在试管口然后将试管慢慢竖起来,操作错 误,故错误; B、点燃酒精灯时,用火柴点燃,如果用燃着的酒精灯去点燃另一个酒精灯,会引起酒精失 答案第 2页,总 10页 火,造成危险,故错误; C、闻药品的气味要在瓶口用手轻轻煽动去闻药品气味,不能把鼻孔凑到容器口去闻气味, 故正确; D、加热固体制取氧气时,试管口向下倾斜,故错误; 故选:C。 4.B 【解析】 【分析】 【详解】 A、碳酸氢钙的化学式书写错误,正确的化学方程式为 Ca(HCO3)2═CaCO3↓+CO2↑+H2O, 故错误; B、氢氧化铝和盐酸反应生成氯化铝和水,该反应是由两种化合物相互交换成分生成了两种 新物质的化合物,属于复分解反应,化学方程式以及基本反应类型均正确,故正确; C、该反应的条件是点燃、且化学方程式没有配平,正确的化学方程式为 4P+5O2 点燃 2P2O5, 故错误; D、置换反应是由一种单质与一种化合物反应生成另一种单质与另一种化合物,而该反应的 反应物是两种化合物,不属于置换反应,故错误。 故选 B。 5.C 【解析】 【分析】 由反应的微观示意图可知,反应的化学方程式为 2 2 3 2CO +3H CH OH+H O 一定条件 。 【详解】 A、乙为氢气,属于单质,该反应中,甲、丙、丁三种物质均为化合物,故 A 不正确; B、反应前氢气中氢元素的化合价为 0,反应后水中氢元素的化合价为+1 价,则反应前后氢 元素的化合价发生变化,故 B 不正确; 答案第 3页,总 10页 C、反应的化学方程式为 2 2 3 2CO +3H CH OH+H O 一定条件 ,则参加反应的甲、乙分子个 数之比为 1:3,故 C 正确; D、由质量守恒定律可知,反应前后原子数目不变,则反应前后氢原子个数之比为 1:1,故 D 不正确。故选 C。 6.D 【解析】 【分析】 【详解】 A、氧化物是由两种元素组成,其中一种元素为氧元素的化合物,水、干冰、氧化铁均属于 氧化物,故 A 正确; B、混合物是由两种或两种以上物质组成,空气、牛奶、钛合金均属于混合物,故 B 正确; C、溶液是溶质溶解在溶剂中形成的均一的、稳定的混合物,盐酸、生理盐水、白酒均属于 溶液,故 C 正确; D、有机物是含碳元素的化合物,蔗糖、生物酶均属于有机物,碳酸属于无机物,故 D 不正 确。故选 D。 7.C 【解析】 【分析】 由质量守恒定律可知,8%+32%+x+36%=100%,x=24%;由四种物质反应前后各物质的质量 分数可知,反应前后乙的质量分数减少了 60%-32%=28%,故乙是反应物;同理可以确定丙 的质量分数减少了 30%-24%=6%,故丙是反应物;丁的质量分数增加了 36%-2%=34%,丁 是生成物;甲的质量分数不变,可能作该反应的催化剂,也可能没有参加反应。 【详解】 A、甲的质量分数不变,可能没有参加反应,也可能作该反应的催化剂,故选项说法错误; B、由以上分析可知,反应后 x 的数值为 24%,故选项说法错误; C、由以上分析可知,该反应可表示为:乙+丙→丁,该反应是由两种物质反应生成另一种 物质,属于化合反应,故选项说法正确; D、反应中乙与丁的质量变化之比为(60%-32%):(36%-2%)=14:17,故选项说法错误。 故选 C。 答案第 4页,总 10页 8.B 【解析】 【详解】 A、质子数相同的微粒不一定属于同种元素,如 Ne 和 H2O,A 错误; B、单质是由同种元素组成的,则只含有一种元素的纯净物一定是单质,B 正确; C、最外层电子数为 8 的粒子不一定都是离子,如 Ne 原子最外层电子数为 8,C 错误; D、二氧化硫和二氧化氮是氧化物,不是酸,D 错误; 故选:B。 9.C 【解析】 【详解】 A、将燃着的木条伸入集气瓶中,木条都熄灭,不能区分两种气体,该选项设计不正确; B、加入碱液,稍热,铵态氮肥和碱反应生成氨气等物质,氨气和水反应生成氨水,氨水能 使石蕊试液变蓝色,因此不能用湿润的蓝色石蕊试纸检验,该选项设计不正确; C、加入过量的稀盐酸,稀盐酸和氢氧化钠反应生成氯化钠和水,蒸发时过量的氯化氢逸出, 最终得到氯化钠,该选项设计正确; D、硝酸钾容易的受温度变化影响较大,氯化钠溶解度受温度变化影响较小,硝酸钾和氯化 钠都易溶于水,溶解,冷却结晶,过滤,蒸发得到硝酸钾和硝酸钾与氯化钠的混合物,该选 项设计不正确。 故选:C。 10.D 【解析】 【分析】 锌的金属活动性比银、铜强,比铝弱,在溶质为 Cu(NO3)2、AgNO3 和 Al(NO3)3 的溶 液中加入一定量的锌粉,不能与硝酸铝溶液反应,锌先与硝酸银反应生成硝酸锌和银,硝酸 银反应完,若还有锌粉,锌才能与硝酸铜反应生成硝酸锌和铜。充分反应后过滤,得到滤渣 和蓝色滤液,说明滤液中含有硝酸铜。 【详解】 A、滤液中含有硝酸铜,则锌不可能有剩余,则向滤渣中加入稀盐酸,不可能有气泡产生, 故选项说法错误; 答案第 5页,总 10页 B、滤渣中一定有 Ag,无法确定硝酸铜是否参加了反应,可能是部分参加了反应,可能有 Cu,但不可能含有锌,故选项说法错误; C、滤液中含有硝酸铜,无法确定硝酸银是否完全参加了反应,滤液中可能含有 AgNO3,故 选项说法错误; D、滤液中含有硝酸铜,无法确定硝酸银是否完全参加了反应,滤液中可能含有 AgNO3,则 滤液中可能有银离子、铜离子、锌离子、铝离子四种金属离子,故选项说法正确。 故选 D。 11.CH4 2H Fe 【解析】 【分析】 【详解】 ①“西气东输”的“气”是指天然气,主要成分是甲烷,甲烷的化学式为 CH4; ②原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加 上相应的数字,所以 2 个氢原子表示为:2H; ③人体必需的元素中,铁元素摄入量不足会引起贫血,铁的元素符号为 Fe。 12.F- +5 【解析】 【分析】 【详解】 由氟原子结构示意图可知,氟原子的最外层有 7 个电子,在化学反应中易得到 1 个电子而形 成带有 1 个单位负电荷的氟离子:F-;在化合物中,钠元素的化合价为+1,氧元素的化合价 为-2,氟元素的化合价为-1,设单氟磷酸钠中磷元素的化合价为 x,根据在化合物中正负化 合价代数和为零得:(+1)×2+x+(-2)×3+(-1)=0,x=+5。 13.AC 【解析】 【分析】 【详解】 A、煤和石油都是不可再生能源,人类应该合理开发利用,符合题意; B、玻璃属于无机非金属材料、不锈钢属于金属材料、尼龙属于有机合成材料,不符合题意; C、磷酸钾的化学式是:K3PO4,其中含以后农作物需求量较大的磷元素与钾元素,属于复 答案第 6页,总 10页 合肥,符合题意; D、减少塑料薄膜袋的生产和使用,可以减少“白色污染”,但不能禁止生产和使用,不符 合题意。故选 AC。 14.滴在 pH 试纸上然后与标准比色卡对比颜色 > 【解析】 【详解】 某地中考化学实验操作考试试题之一为测定肥皂水的 pH,某考生用干燥的滴管吸取待测液, 滴在 pH 试纸上,将显示的颜色与标准比色卡对比,读出 pH,测得肥皂水的 pH>7。 15.C>B>A 能 B 50 【解析】 【分析】 【详解】 ①根据溶解度曲线可知,t1℃时,A、B、C 三种物质的溶解度由大到小的顺序是 C>B>A; ②当温度在 t1~t3℃之间时,A 物质与 B 物质的溶解度可能相等,因此能配制溶质质量分数 相同的饱和溶液; ③将 A、B、C 三种物质的饱和溶液分别由 t2℃升温到 t3℃,AB 变成不饱和溶液,质量分数 都不变,C 仍然是饱和溶液,质量分数减小,由于 t2℃时 B 的溶解度大于 A,所得溶液中溶 质的质量分数最大的物质是 B; ④t3℃时 A 溶解度是 50g,将 75g A 的饱和溶液稀释成 20%的溶液需加水的质量: 75g× 50g 50g+100g ÷20%-75g=50g。 16.NaOH Na2CO3 2 4 3 4 32H SO Ba NO BaSO 2HNO 2 2 2 2 2 2 2=2NH CH COOH Ca(OH) NH CH COO) C( a 2H O 【解析】 【分析】 D 俗称纯碱,所以 D 是碳酸钠;碳酸钠与足量 C 反应产生无色、无味气体,所以 C 是酸, 可以是盐酸或硫酸;B 和碳酸钠可以相互转化,会与盐酸或硫酸反应,所以 B 是氢氧化钠; A 和 B 物质类别相同,A 会转化成氢氧化钠,会与碳酸钠反应,所以 A 是氢氧化钙,之后 将推出的物质代入进行验证,分析正确。 答案第 7页,总 10页 【详解】 (1)由分析知道 B 是 NaOH;D 是 Na2CO3; (2)C 与 Ba(NO3) 2 反应生成不溶于稀硝酸的沉淀,则 C 是硫酸,该反应是硝酸钡和硫 酸反应生成硫酸钡沉淀和硝酸,化学方程式为: 2 4 3 4 32H SO Ba NO BaSO 2HNO ; (3)由给出的例子分析知:醋酸和氢氧化钾发生中和反应,生成盐和水;A 是氢氧化钙, 乙氨酸与氢氧化钙的反应生成乙氨酸钙和水,化学方程式为: 2 2 2 2 2 2 2=2NH CH COOH Ca(OH) NH CH COO) C( a 2H O 。 17.滤纸破损(或液体液面高于滤纸边缘或仪器本身不干净) 分子是不断运动的 温 度达到可燃物的着火点(或温度达到着火点) 偏小 【解析】 【分析】 【详解】 (1)过滤后滤液仍浑浊,可能原因是:滤纸破损,会使得液体中的不溶物进入下面的烧杯, 从而使得滤液浑浊;液面高于滤纸边缘,会使部分液体未经过滤纸的过滤直接流下,该操作 会使滤液仍然浑浊;盛放滤液的烧杯不干净等。故实验 A 滤液仍然浑浊,可能的原因是: 滤纸破损(或液体液面高于滤纸边缘或仪器本身不干净)。 (2)①浓氨水具有挥发性,挥发出的氨气分子扩散到②中,形成氨水,显碱性,使酚酞溶 液变红色,故实验 B 观察到烧杯②中溶液变红,说明分子具有的性质是:分子是不断运动 的。 (3)燃烧的条件是:有可燃物、温度达到可燃物着火点、有氧气参与。实验 C 中,白磷是 可燃物,将大小相同的白磷分别放入冷水和热水中,通入空气,两处的白磷都与氧气接触, 观察到热水中白磷燃烧,冷水中的白磷不能燃烧,故此实验说明燃烧的条件之一是:温度达 到可燃物的着火点(或温度达到着火点)。 (4)配制溶液时,按图 D 所示量取溶剂,仰视读数,读数偏小,实际量取的液体的体积偏 大,溶剂质量偏大,溶质质量不变,其他操作均正确,根据 = 100%+ 溶质质量溶质质量分数 溶质质量 溶剂质量 ,可以判断最终导致配制的溶液溶质质量 分数偏小。 【点睛】 答案第 8页,总 10页 = 100%+ 溶质质量溶质质量分数 溶质质量 溶剂质量 18.锥形瓶 3 2 2 2CaCO 2HCl CaCl H O CO BD ab(或 abc) 浓 硫酸 ①② 【解析】 【分析】 【详解】 (1)根据图示,M 的名称是:锥形瓶。 (2)实验室一般在常温下用大理石或石灰石和稀盐酸制取二氧化碳,碳酸钙和盐酸反应生 成氯化钙、水和二氧化碳,化学方程式是: 3 2 2 2CaCO 2HCl CaCl H O CO ;因 为大理石是块状固体,稀盐酸是液体,反应在常温下进行,所以发生装置选择 B,又因为二 氧化碳能溶于水,密度比空气的密度大,所以只能用向上排空气法收集,收集装置选择 D。 故应选用的发生装置和收集装置的组合为:BD。 (3)若用装置 A、F 制取氧气,因为氧气的密度比空气大,所以氧气必须从长管进入,按 气体流向,导管口连接顺序为 ab 或 abc;F 装置用于干燥氧气,瓶内必须盛放液态干燥剂, 因为浓硫酸有吸水性,且氧气不和浓硫酸反应,所以盛装的干燥剂为:浓硫酸。 (4)某气体能用 E 装置收集,说明该气体不能与水反应;该气体只能用 E 装置收集,说明 该气体不能用排空气法收集,则该气体可能具有的性质为:①能与空气中的某物质反应,② 密度与空气的密度接近。故选①②。 19.过氧化氢是液体且能生成氧气 将溶液中的碳酸钠除尽(或完全除去碳酸钠) 产 生气泡(或有气泡生成) 证明过氧碳酸钠与水反应没有 NaOH 生成 一 2 4 2 2 3 2 2Na CO H O=Na CO H O 【解析】 【分析】 根据化学反应前后元素种类不变;过氧化氢是液体且分解能够产生能使带火星的木条复燃的 氧气;碳酸钠和氯化钙反应生成白色沉淀碳酸钙和氯化钠;氢氧化钠和氯化铁反应生成红褐 色沉淀和氯化钠;分析总结得出过碳酸钠和水反应生成碳酸钠和过氧化氢;进行分析作答。 【详解】 猜想与假设:猜想一、二、三除了遵循质量守恒定律外,猜想 H2O2 的其他理由是过氧化氢 答案第 9页,总 10页 是液体,且分解能够产生能使带火星的木条复燃的氧气; 实验 2:①取适量溶液 a 于小烧杯中,加入稍过量的氯化钙溶液,过滤,得到清液 b,产生 白色沉淀,是因为碳酸钠和氯化钙反应生成白色沉淀碳酸钙和氯化钠,加入稍过量氯化钙的 目的是将溶液中的碳酸钠除尽(或完全除去碳酸钠); ②取适量清液 b 于试管中,加入过量二氧化锰,振荡,产生大量气泡,是因为过氧化氢在二 氧化锰催化作用下分解生成水和氧气,证明过氧碳酸钠与水反应有 H2O2 生成; ③将步骤②所得混合物静置,取少量清液于试管中,滴加氯化铁溶液,无明显现象,说明溶 液中不含有氢氧化钠,证明过氧碳酸钠与水反应没有生成氢氧化钠; 实验结论:过碳酸钠和水反应生成碳酸钠和过氧化氢,猜想一正确;过氧碳酸钠与水反应生 成碳酸钠和过氧化氢,化学方程式:Na2CO4+H2O=H2O2+Na2CO3。 20.(1)22(2)8 【解析】 【分析】 相对分子质量是指化学式中各个原子的相对原子质量的总和。 【详解】 (1)青蒿素的相对分子质量为 282,每个分子由 15 个碳原子、5 个氧原子和 n 个氢原子构 成,则12 15+16 5+1 n=282 , n=22 (2)28.2g 青蒿素中氧元素的质量为: 5 1628.2g 100%=8g282 。 21.(1)9.85(2)2.2(3)10% 【解析】 【分析】 氯化钡和盐酸的混合溶液中滴加碳酸钠溶液,碳酸钠和盐酸先反应生成氯化钠、水和二氧化 碳,盐酸反应完全之后氯化钡和碳酸钠反应生成碳酸钡和氯化钠。 【详解】 (1)由图像可知,氯化钡和碳酸钠反应生成碳酸钡沉淀的质量为 9.85g,故产生沉淀的质量 为 9.85g。 (2)由(3)可知碳酸钠溶液的质量分数为 10% 设生成的气体的质量为 y 答案第 10页,总 10页 2 3 2 22HCl+ Na CO = 2NaCl+H O+CO 106 44 53g 10% y 106 53g 10%=44 y =2.2gy 故 x 的值为 2.2. (3)设与氯化钡反应的碳酸钠质量为 x 2 3 2 3Na CO +BaCl = BaCO +2NaCl 106 197 9.85gx 106 =197 9.85g x =5.3gx 则碳酸钠溶液中溶质的质量分数为 5.3g 100% 10%106g 53g 答:碳酸钠溶液中溶质的质量分数是 10%。查看更多