- 2021-04-20 发布 |
- 37.5 KB |
- 8页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版高三化学 第八章氮族知识总结(五)
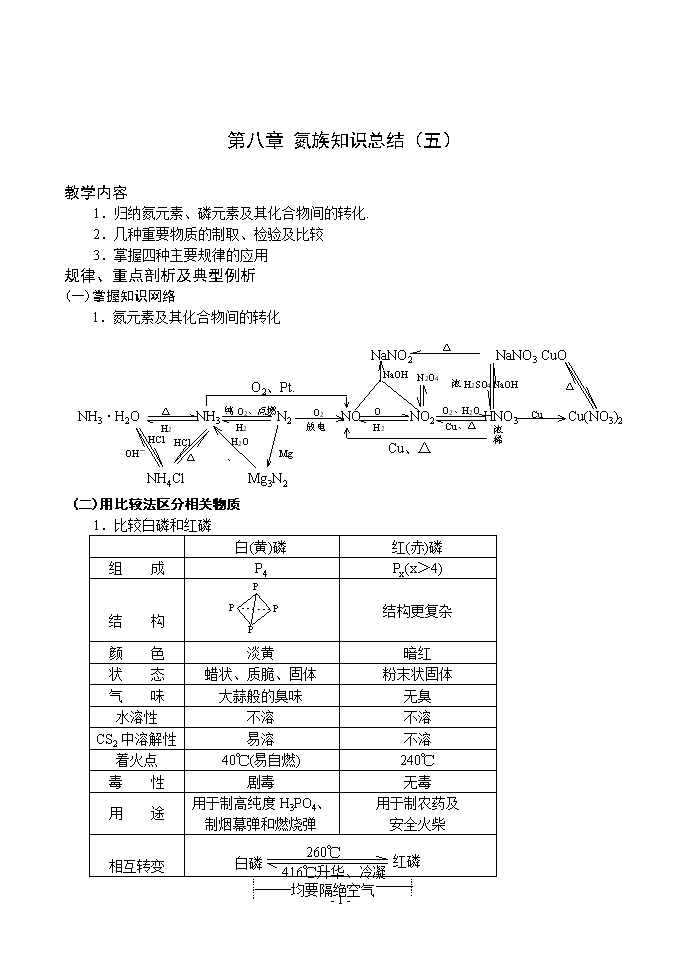
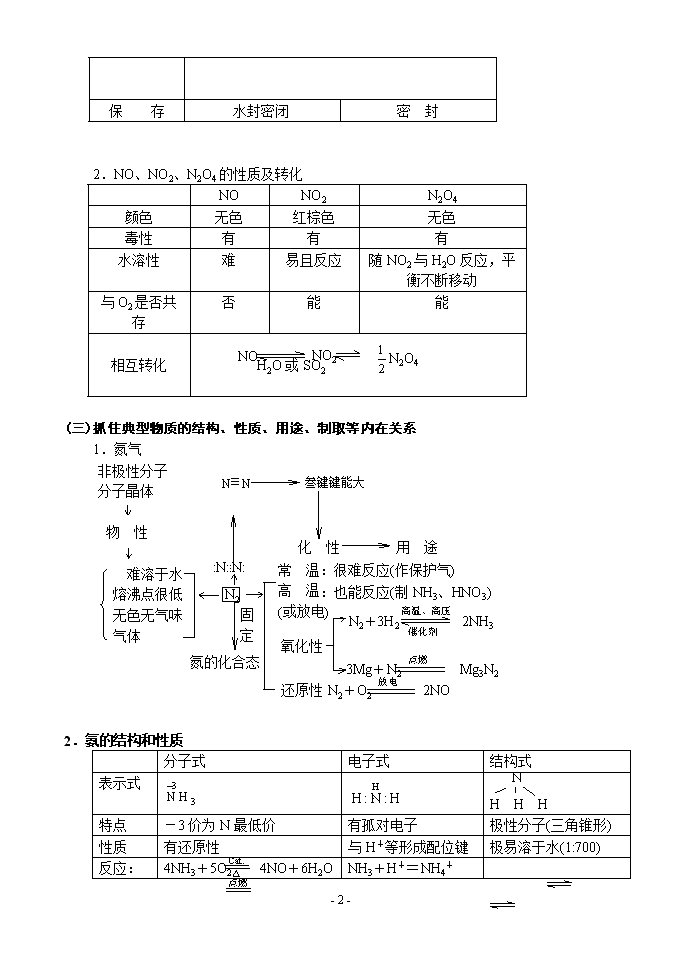
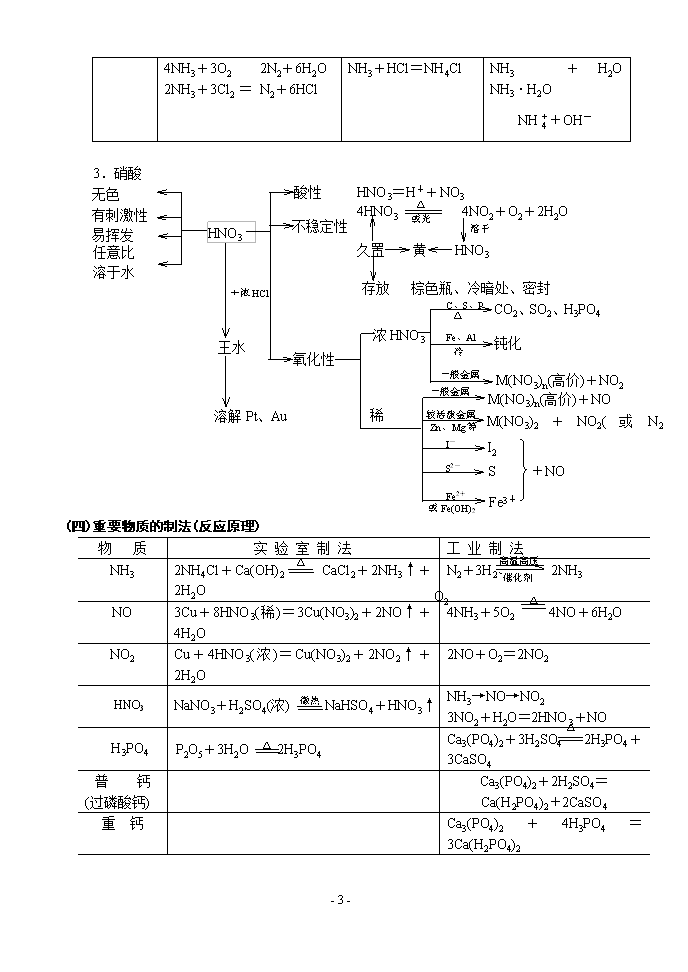
第八章 氮族知识总结(五) 教学内容 1.归纳氮元素、磷元素及其化合物间的转化. 2.几种重要物质的制取、检验及比较 3.掌握四种主要规律的应用 规律、重点剖析及典型例析 (一)掌握知识网络 1.氮元素及其化合物间的转化 △ △ H2O 纯O2、点燃 H2 O2 放电 O2 H2O O2、H2O Cu、△ Cu O2、Pt. 浓 稀 Cu、△ NaNO2 NaNO3 CuO NaOH N2O4 浓H2SO4 NaOH Mg HCl HCl OH- △、Ca(OH)2 H2O △ NH4Cl Mg3N2 NH3·H2O NH3 N2 NO NO2 HNO3 Cu(NO3)2 (二)用比较法区分相关物质 1.比较白磷和红磷 白(黄)磷 红(赤)磷 组 成 P4 Px(x>4) 结 构 结构更复杂 颜 色 淡黄 暗红 状 态 蜡状、质脆、固体 粉末状固体 气 味 大蒜般的臭味 无臭 水溶性 不溶 不溶 CS2中溶解性 易溶 不溶 着火点 40℃(易自燃) 240℃ 毒 性 剧毒 无毒 用 途 用于制高纯度H3PO4、 制烟幕弹和燃烧弹 用于制农药及 安全火柴 白磷 红磷 260℃ 416℃升华、冷凝 均要隔绝空气 相互转变 - 8 - 保 存 水封密闭 密 封 2.NO、NO2、N2O4的性质及转化 NO NO2 N2O4 颜色 无色 红棕色 无色 毒性 有 有 有 水溶性 难 易且反应 随NO2与H2O反应,平衡不断移动 与O2是否共存 否 能 能 H2O或SO2 NO NO2 相互转化 N2O4 (三)抓住典型物质的结构、性质、用途、制取等内在关系 非极性分子 分子晶体 N≡N 叁键键能大 :N::N: . . 固定 常 温:很难反应(作保护气) 高 温 (或放电) :也能反应(制NH3、HNO3) 氮的化合态 氧化性 N2+3H2 2NH3 高温、高压 催化剂 3Mg+N2 Mg3N2 点燃 化 性 用 途 还原性 N2+O2 2NO 放电 1.氮气 物 性 难溶于水 熔沸点很低 N2 无色无气味 气体 2.氨的结构和性质 N 分子式 电子式 结构式 . . 表示式 H H H 特点 -3价为N最低价 有孤对电子 极性分子(三角锥形) Cat. 性质 有还原性 与H+等形成配位键 极易溶于水(1:700) 点燃 △ 反应: 4NH3+5O2 4NO+6H2O NH3+H+=NH4+ - 8 - 4NH3+3O2 2N2+6H2O 2NH3+3Cl2 = N2+6HCl NH3+HCl=NH4Cl NH3+H2O NH3·H2O NH+OH- HNO3=H++NO3- △ 冷 Fe3+ S +NO I2 M(NO3)n(高价)+NO 溶解Pt、Au 王水 溶于 Fe2+ S2- I- Zn、Mg等 较活泼金属 一般金属 稀HNO3 钝化 CO2、SO2、H3PO4 一般金属 Fe、Al C、S、P 存放 棕色瓶、冷暗处、密封 △ 或光 久置 黄 HNO3 氧化性 不稳定性 酸性 M(NO3)n(高价)+NO2 任意比 溶于水 或Fe(OH)2 3.硝酸 4HNO3 4NO2+O2+2H2O 无色 HNO3 有刺激性 易挥发 +浓HCl 浓HNO3 M(NO3)2+NO2(或N2 NH4NO3) O2 (四)重要物质的制法(反应原理) △ 高温高压 物 质 实 验 室 制 法 工 业 制 法 △ 催化剂 NH3 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O N2+3H2 2NH3 NO 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 4NH3+5O2 4NO+6H2O NO2 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 2NO+O2=2NO2 HNO3 微热 热热泪盈眶热热泪盈眶 NaNO3+H2SO4(浓) NaHSO4+HNO3↑ △ NH3→NO→NO2 3NO2+H2O=2HNO3+NO △ H3PO4 P2O5+3H2O 2H3PO4 Ca3(PO4)2+3H2SO4 2H3PO4+3CaSO4 普 钙 (过磷酸钙) Ca3(PO4)2+2H2SO4=Ca(H2PO4)2+2CaSO4 重 钙 Ca3(PO4)2+4H3PO4=3Ca(H2PO4)2 - 8 - 注意 1.NH3的干燥剂选用 ① 氨是碱性气体(有水),故不能用酸性干燥剂.如浓H2SO4、P2O5等 ② 氨与CaCl2反应生成CaCl2·8NH3.故也不能用无水CaCl2 ③ 氨只能用碱性干燥剂如碱石灰 2.氨催化氧化法制HNO3有关事项 (1)为提高原料转化率,应补充空气,多次氧化和吸收 (2)尾气吸收——用碱液 NO+NO2+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO3+NaNO2+H2O 当n:n≥1.均可被吸收完全 (3)硝酸浓度的提高 ①吸水剂 ②蒸发 浓H2SO4或Mg(NO3)2 稀硝酸 浓缩 (五)六种物质的检验 物 质 试剂及主要现象 反应原理 △ NH3 湿红石蕊 试 纸 变 蓝 NH3+H2O NH3·H2O NH4++OH- 浓盐酸 白 烟 NH3+HCl=NH4Cl NH NaOH(△) 有气体放出 NH+OH- NH3↑+H2O NO 氧 气 2NO+O2=2NO2 无色变 红棕色 △ NO2 AgNO3溶液 无 沉 淀 3NO2+H2O=2HNO3+NO 有红棕 色气体 NO 铜片、 浓H2SO4 (共热) 2NO+2H2SO4(浓)+Cu Cu2++2NO2↑+2SO+2H2O (六)重要规律 1.铵盐分解规律 I2(s) 冷 升华 △ NH4Cl(s) △ 分解 △ 铵盐热稳定性差,受热均能分解.但请注意:未必有NH3产生. - 8 - 这由盐中对应酸的稳定性、挥发性、氧化性等因素来决定. ① 稳定易挥发酸成的铵盐 NH3↑+酸的挥发性物质 如 NH4Cl(s) NH3↑+HCl↑ 类似的有 NH4F 化合 冷 NH4Br “假升华” 能否类推 NH4I? 区别 I2(s) I2(g) △ △ ② 稳定难挥发酸成的铵盐 NH3↑+酸 △ 如 (NH4)2SO4 2NH3↑+H2SO4 △ ③ 不稳定且无强氧化性酸成的铵盐 NH3↑+酸的分解产物 △ 如 (NH4)2CO3 2NH 3↑+H2O+CO2↑ NH4HCO3 NH3↑+H2O+CO2↑ △ NH4I NH3↑+I2↑+H2↑ (有色) ④ 由不稳定且有强氧化性酸(HNO3)成的盐 NH4NO3 △ 一般发生氧化还原反应 温度不同,产物不同 190℃ 低温,可得NH3+HNO3 500℃ 或撞击 如 5NH4NO3 2HNO3+4N2↑+9H2O 2NH4NO3 2N2↑+O2↑+4H2O+Cl (爆炸性分解反应) 易爆物 注意妥善保存,勿研磨、勿撞击. 2.磷酸盐的溶解性规律 ① 磷酸二氢盐一般都易溶于水 ② 磷酸一氢盐和磷酸正盐大多难溶于水(除K+、Na+、NH4+等) ③ 同种阳离子所形成的三种盐的溶解性大小(同温):磷酸二氢盐>磷酸一氢盐>磷 酸正盐 如 NaH2PO4>Na2HPO4>Na3PO4 Ca(H2PO4)2>CaHPO4>Ca3(PO4)2 有利于 转 化 联系:制磷肥的主要目的: 难溶于水 易溶于水 植物吸收 磷矿石 +(H2SO4) 磷酸二氢钙 [Ca3(PO4)2] 或H3PO4 Ca(H2PO4)2 - 8 - 巩 固 练 习 (一)选择 1.一定条件下在过量氧气中充分氧化1摩(指一步氧化)下列气体时,失去电子的物质的量最大的是 ( ) A.NH3 B.NO C.H2S D.CO 2.下列不具备剧毒作用的物质是 ( ) A.HF B.P4 C.H3PO4 D.HPO3 3.对下列各组物质性质的递变叙述正确的是 ( ) A.稳定性: NH3>PH 3>A SH3 B.氧化性: 浓H3PO4>浓H2SO4>浓HNO3 C.酸性(相同浓度): HClO4>HNO3>H2SO3 D.熔点由低到高的顺序为: NH3、H2O、HF 4.下列所得物质不属于混和物的是 ( ) A.镁条在空气中完全燃烧后的生成物. B.用浓NHO3与Cu片反应,收集得到的二氧化氮气体. C.1摩H3PO4与1.2摩Ca(OH)2反应生成的盐。 D.2摩H3PO4与1摩Ca(OH)2反应生成的盐。 5.将体积相同的试管,分别装满等体积混合的下列各组气体,倒立于水中则进入试管的水最多的是 ( ) A.CO2、O2 B.NO2、O2 C.NO、NO2 D.NH3、O2 6.有关铵盐性质叙述中,错误的是 ( ) A.铵盐可与碱反应,加热放出氨气 B.铵盐加热时,均可收集到氨气 C.铵盐的水溶液均显碱性 D.铵盐均可溶于水. +NaOH 7.下列根据实验现象所作的结论正确的是 ( ) A.无色盐的试液 放出能使湿润的红色石蕊试纸变兰的气体. 滴入紫色石蕊试液 结论:无色试液为铵盐溶液 B.无色试液 试液变红. 加入适量稀HNO3 结论:试液的酸溶液 C.在产生黄色沉淀的试管中 沉淀溶解. 加入过量强碱Ba(OH)2 结论:说明沉淀不是AgI D.无色试液 反应中产生的沉淀不能被酸溶解. 结论:说明无色试液不可能是铝盐溶液 8.用以下三种途径来制取相等质量的硝酸铜: (1)铜跟浓硝酸反应 (2)铜跟稀硝酸反应 (3)铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应 以下叙述正确的是 ( ) - 8 - A.三种途径所消耗的铜的物质的量相等 B.三种途径所消耗的消酸的物质的量相等 C.所消耗的铜的物质的量是: 途径(3)>途径(1)>途径(2) D.所消耗的硝酸的物质的量是: 途径(1)>途径(2)>途径(3) 9.a、b、c、d、e五种无色气体中,进行如下实验: 实验步聚 实验现象 ① a、b相混合 气体变成棕色 ② c、d相混合 产生白烟 ③ a、e分别通入少量溴水中 溴水均成无色透明溶液 ④ b、e分别通入氢硫酸中 都产生淡黄色的沉淀 则a、b、c、d、e可能依次是 ( ) A.O2、NO、HCl、NH3、CO2 B.O2、NO、NH3、HCl、SO2 C.NO、O2、NH3、HCl、SO2 D.HBr、Cl2、NH3、H2S、C2H4 10.室温时,两个容积相等的集气瓶分别盛有M和N两种气体(同温同压),然后将两 瓶口相对,抽去玻片,充分混合,容器内的压强由大到小的顺序是 ( ) 编 号 ① ② ③ ④ 气体M H2S H2 NH3 NO 气体N SO2 Cl2 HCl O2 A.①②③④ B. ②④①③ C.④①②③ D.①④③② (二)填空 11.有A、B、C、D、E、F六瓶无色溶液,它们分别是NaCl、K3PO4、NH4NO3、Ca(NO3)2、 MgCl2和BaCl2.现取样进行如下实验: (1)分别滴入硝酸银溶液,在A、B、D、E溶液中出现沉淀; (2)分别滴入碳酸钠溶液,在C、D、E溶液中出现沉淀; (3)将C溶液滴入其它五种溶液中,只有A溶液中出现沉淀; (4)将NaOH溶液分别滴入D、E溶液,只有E溶液出现沉淀。 根据以下实验现象可判断A是(写分子式,下同)______、B为_______、C为_____ D为________、E为_______、F为__________. 12.在10mL 0.1mol/L的H3PO4溶液中,逐滴入0.05mol/L的Ba(OH) 2溶液,当加至____mL 时,再滴入Ba(OH)2溶液即开始出现沉淀. 13.现有一定量含NO2和NO的硝酸工业尾气(不含其它气体),用过量NaOH溶液吸收, 其主要原理可表示如下: 2NO2+2NaOH=NaNO2+NaNO3+H2O NO2+NO+2NaOH=2NaNO2+H2 O 若吸收后溶液中NaNO3和NaNO2的物质的量之比恰好与原尾气中NO和NO2的物 质的量之比相等,若用NOx表示该尾气中氮的氧化物的平均组成,则x值为______. 14.将盛有24mL NO、NO2混合气体的试管倒置于水中,待液面上升至位置不再改变时, 试管内总体体积缩小一半. - 8 - (1)原混合气中,NO和NO2体积比为________. (2)若在剩余气体中通入3mL O2,则又有____ mL 溶液进入试管. (3)若在原24mL混合气体中通入_____ mL O2,并倒置于水中,溶液将充满整个试管. 答 案 (一)1.A 2.C 3.AC 4.D 5.B 6.BC 7.AC 8.AD 9.C 10.B (二)11.A-K3PO4 B-NaCl C-Ca(NO3)2 D-BaCl2 E-MgCl2 F-NH4NO3 12.10 13. 14.(1)1:3 (2)4 (3)9 - 8 -查看更多