2020版高中化学 第2章第2节 化学反应的快慢和限度 第2课时 化学反应的限度学案 鲁科版必修2
第2课时 化学反应的限度
一、化学平衡的建立及其特征
1.可逆反应
(1)概念:在相同条件下,同时向正、反两个方向进行的化学反应称为可逆反应。
(2)表示:可逆反应的化学方程式中,用“”号代替“===”号。
(3)特征
①双向性:反应物生成物。
②双同性:正、逆反应是在同一条件下同时进行的。
③共存性:反应物和生成物同时存在。
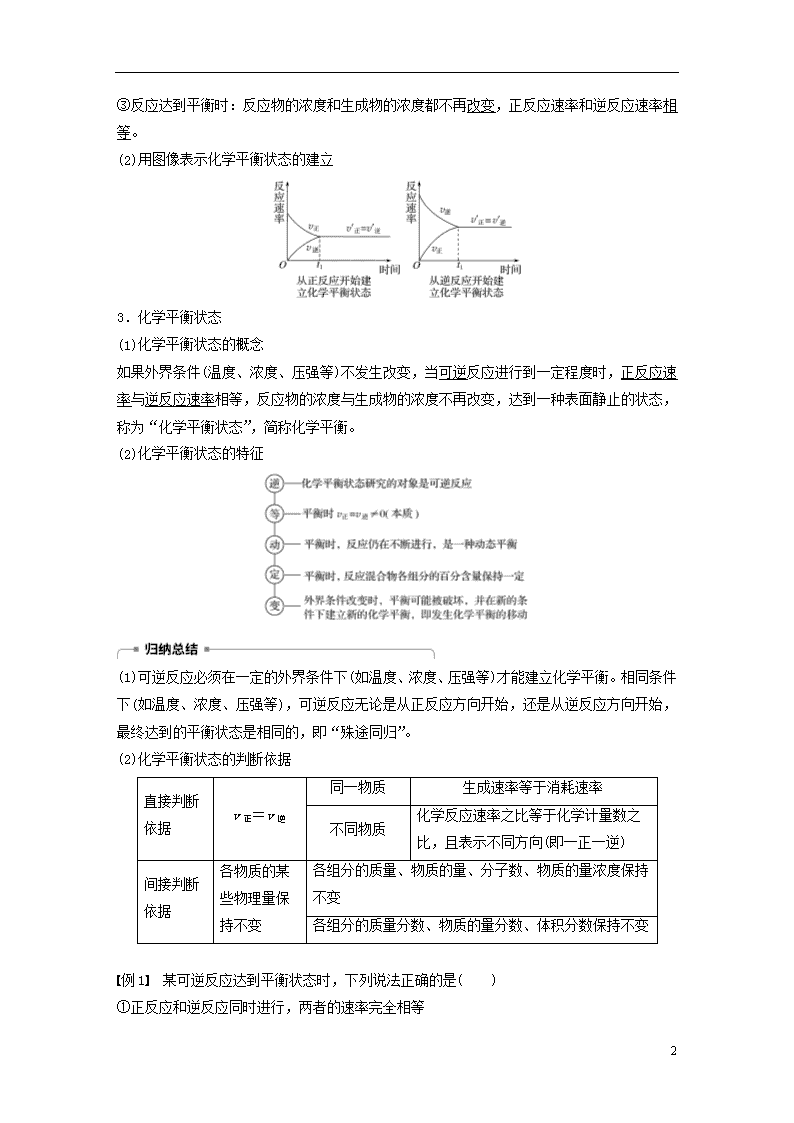
2.化学平衡状态的建立
(1)可逆反应过程中正、逆反应速率的变化
①反应开始时:反应物浓度最大,正反应速率最大;生成物浓度为0,逆反应速率为0。
②反应过程中:反应物浓度逐渐减小,正反应速率逐渐减小;生成物浓度逐渐增大,逆反应速率逐渐增大。
17
③反应达到平衡时:反应物的浓度和生成物的浓度都不再改变,正反应速率和逆反应速率相等。
(2)用图像表示化学平衡状态的建立
3.化学平衡状态
(1)化学平衡状态的概念
如果外界条件(温度、浓度、压强等)不发生改变,当可逆反应进行到一定程度时,正反应速率与逆反应速率相等,反应物的浓度与生成物的浓度不再改变,达到一种表面静止的状态,称为“化学平衡状态”,简称化学平衡。
(2)化学平衡状态的特征
(1)可逆反应必须在一定的外界条件下(如温度、浓度、压强等)才能建立化学平衡。相同条件下(如温度、浓度、压强等),可逆反应无论是从正反应方向开始,还是从逆反应方向开始,最终达到的平衡状态是相同的,即“殊途同归”。
(2)化学平衡状态的判断依据
直接判断依据
v正=v逆
同一物质
生成速率等于消耗速率
不同物质
化学反应速率之比等于化学计量数之比,且表示不同方向(即一正一逆)
间接判断依据
各物质的某些物理量保持不变
各组分的质量、物质的量、分子数、物质的量浓度保持不变
各组分的质量分数、物质的量分数、体积分数保持不变
例1 某可逆反应达到平衡状态时,下列说法正确的是( )
①正反应和逆反应同时进行,两者的速率完全相等
17
②反应物和生成物同时存在,两者的浓度相同
③混合物的组成比例不会随时间而改变
A.① B.①③ C.② D.①②③
考点 可逆反应与化学平衡状态
题点 化学平衡状态的特征
答案 B
解析 可逆反应达到平衡状态时,v正=v逆≠0,且各组分的含量保持不变,故①③正确;而反应物和生成物浓度相同,只是反应达到的某一特殊状态,并不一定达到平衡。
思维启迪
化学反应达到平衡时,各组分的浓度保持不变,不要理解为浓度相等,也不要理解为浓度之比等于化学计量数之比。
例2 在体积固定的绝热容器中,对于反应A(g)+B(g)3C(g)(正反应为放热反应),下列叙述为平衡状态标志的是( )
①单位时间内A、B生成C的分子数与分解C的分子数相等
②外界条件不变时,A、B、C浓度不随时间变化
③体系温度不再变化
④体系的压强不再变化
⑤体系的分子总数不再变化
A.①② B.①②③ C.①②③④ D.①②③④⑤
考点 化学平衡状态的判断
题点 恒容条件下非等体积反应平衡状态的判断
答案 D
解析 ①同一物质的正、逆反应速率相等,说明已达平衡;②浓度不变,说明已达平衡;③如果该反应没有达到平衡,必然导致体系温度改变。体系温度不变,说明已达平衡;④⑤由于该反应是一个体积改变的反应,达到平衡之前,压强是改变的,分子总数也是改变的,达到平衡时,二者不再改变,故①②③④⑤均正确。
易错警示
(1)化学平衡的实质是同种物质的正、逆反应速率相等。用不同物质的正、逆反应速率判断是否达到化学平衡状态时,要根据化学反应速率之比等于化学计量数之比,转化为同种物质的速率进行比较。
(2)利用v正=v逆>0判断平衡状态时注意:反应速率必须是一正一逆,不能都是v正或都是v逆。
例3 在一定温度下的恒容密闭容器中,当下列物理量不再变化时,能说明反应A(s)+2B(g)C(g)+D(g)已达到平衡状态的是( )
17
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量
A.①② B.②③
C.③④ D.①④
答案 B
解析 反应中A为固态,反应前后气体的总物质的量不变,故混合气体的压强不变不能说明反应达到平衡,①错误;ρ=,m总变化,V总不变,故混合气体的密度不变可以说明反应达到平衡,②正确;B的物质的量浓度不变可以说明反应达到平衡,③正确;反应前后气体总物质的量不变,气体总物质的量不变不能说明反应达到平衡,④错误。
思维启迪
(1)分析气体体积、压强、密度等物理量不再变化是否能说明化学反应已达到平衡状态时,首先要分清化学平衡建立的条件及反应中各物质的状态。化学平衡建立的条件主要有同温同压、同温同体积、恒容绝热。
(2)某一物理量在从开始到平衡的过程中是“变化”的,而达到平衡后则“不变”,则此物理量是判断平衡状态的标志。
二、化学平衡的移动
1.实验探究温度改变对化学平衡的影响
实验原理
2NO2(g)N2O4(g) 反应放热
(红棕色) (无色)
实验内容
将装有二氧化氮和四氧化二氮混合气体的圆底烧瓶分别浸入冷水和热水中
实验现象
浸到冷水中时混合物颜色变浅,浸到热水中时混合物颜色变深
解释与结论
①受热颜色变深,说明NO2浓度增大,即升高温度原平衡被破坏,平衡向逆反应方向移动重新建立新平衡
②冷却颜色变浅,说明NO2浓度减小,即降低温度原平衡被破坏,平衡向正反应方向移动重新建立新平衡
2.升高温度,平衡向吸热反应方向移动;降低温度,平衡向放热反应方向移动。
(1)化学平衡移动的概念:已达到化学平衡的可逆反应中,当条件改变时,原来的化学平衡被破坏,并在新的条件下建立起新的化学平衡的过程。
(2)化学平衡移动过程可表示为
17
(3)影响化学平衡移动的因素有:温度、浓度、压强等。
(4)平衡移动的结果判断
若条件改变引起:
①v正>v逆⇒平衡正向移动;
②v正
v逆;A点处反应物的浓度大于B点,所以A点正反应速率大于B点。
(2)图中纵坐标为浓度,平衡时消耗n(NO)=0.020 mol-0.007 mol=0.013 mol,生成n(NO2)=0.013 mol。平衡时c(NO2)=0.006 5 mol·L-1,所以NO2的变化曲线为b。0~2 s内,v(O2)=v(NO)=×=1.5×10-3 mol·L-1·s-1。
(3)v(NO2)=2v(O2)未指明v正、v逆,不能表明是平衡状态,该反应遵循质量守恒定律,且容器的体积未变化,所以容器内的密度在平衡与不平衡时都不变化。
(4)分离出NO2气体后,浓度减小,反应速率减慢,而升高温度、加入催化剂及增大反应物浓度都会使反应速率增大。
[对点训练]
题组一 可逆反应的特点
1.下列不属于可逆反应的是( )
A.氯气与水反应生成盐酸与次氯酸
17
B.N2与H2在一定条件下可以生成NH3,同时NH3又可分解为N2和H2
C.电解水生成H2和O2,氢气和氧气转化为H2O
D.SO2溶于水和H2SO3分解
考点 可逆反应与化学平衡状态
题点 可逆反应的判断
答案 C
解析 可逆反应指在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,电解水生成氢气和氧气,氢气和氧气点燃生成水,反应条件不同,不是可逆反应。
2.可逆反应2SO2+O22SO3,若用2 mol SO2和1 mol 18O2在一定条件下,经足够长的时间反应。下列情况可能出现的是( )
A.18O原子完全存在于SO3中
B.18O原子存在于O2、SO2、SO3中
C.生成2 mol SO3
D.SO2、SO3均为1.5 mol
答案 B
解析 可逆反应在相同条件下,可以向正、逆两个反应方向进行,反应体系中各物质同时存在,由于三种物质均含有氧元素,故18O原子可能存在于三种物质中,故A项错误,B项正确;该反应是可逆反应,反应物不可能完全转化为生成物,故C项错误;根据硫元素质量守恒:n(SO2)+n(SO3)=2 mol,故D项错误。
3.在密闭容器中发生反应X(g)+3Y(g)2Z(g),若X、Y、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.2 mol·L-1,在一定条件下,当反应达到一定限度时,各物质的浓度可能是( )
A.X为0.2 mol·L-1
B.Y为0.1 mol·L-1
C.Z为0.4 mol·L-1
D.Z为0.1 mol·L-1时,Y为0.4 mol·L-1
考点 可逆反应与化学平衡状态
题点 可逆反应的特点
答案 B
解析 化学反应的限度决定了可逆反应中的各成分是不能完全转化的,反应可能正向进行,也可能逆向进行,所以当反应达到一定限度时各物质的浓度范围为0<c(X)<0.2 mol·L-1,0<c(Y)<0.6 mol·L-1,0<c(Z)<0.4 mol·L-1。而当c(Z)=0.1 mol·L-1时,c(Y)=0.45 mol·L-1。
17
题组二 化学平衡的建立与特征
4.向一密闭容器中放入1 mol X,进行可逆反应2X(g)3Y(g),反应过程中的反应速率(v)与时间(t)的关系曲线如图所示,下列叙述正确的是( )
A.t1时,只有正反应
B.t2~t3时,反应不再发生
C.t2时,容器内有1.5 mol Y
D.t2~t3时,X、Y的物质的量均没有发生变化
考点 可逆反应与化学平衡状态
题点 化学平衡状态的建立
答案 D
解析 t1时,v正>v逆>0,正、逆反应都在发生,A项错误;t2~t3时,v正=v逆>0,反应并未停止,B项错误;该反应为可逆反应,1 mol X不能完全反应,所以当反应达到平衡时,容器内Y的物质的量小于1.5 mol,C项错误;t2~t3时为化学平衡状态,X、Y的物质的量均不发生变化,D项正确。
5.下列关于化学平衡的说法,不正确的是( )
A.当一个可逆反应达到化学平衡时,正、逆反应速率都为零
B.当可逆反应达到化学平衡时,正、逆反应速率一定相等
C.当可逆反应达到化学平衡后,改变某些条件可以使平衡发生移动
D.当可逆反应达到化学平衡后,尽管正、逆反应都在进行,但各物质的浓度保持不变
答案 A
解析 当可逆反应达到化学平衡时,正、逆反应速率相等,但不为零;当可逆反应达到化学平衡后,尽管正、逆反应都在进行,但各物质的浓度保持不变;化学平衡是有条件的,可逆反应达到化学平衡后,改变某些条件可以使平衡发生移动。
6.在373 K时,密闭容器中充入一定量的NO2和SO2,发生如下反应:NO2+SO2催化剂,NO+SO3。平衡时,下列叙述正确的是( )
①NO和SO3的物质的量一定相等 ②NO2和SO2的物质的量一定相等 ③反应混合物的总物质的量一定等于反应开始时总物质的量 ④SO2、NO2、NO、SO3的物质的量一定相等
A.①和② B.②和③
C.①和③ D.③和④
17
答案 C
解析 ①充入的是NO2和SO2,又NO和SO3的化学计量数之比为1∶1,其物质的量一定相等;②充入NO2、SO2的量不一定相等,而反应消耗量相等,故平衡时不一定相等;③反应前后物质的化学计量数之和不变,则总物质的量保持不变;④充入SO2、NO2的量不确定,则平衡时各反应物和生成物的量不一定相等,故选C。
7.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )
A.化学方程式:2NM
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,M的浓度是N浓度的2倍
考点 化学平衡计算与图像
题点 化学平衡的图像
答案 A
解析 在t2时,N的物质的量为4 mol,变化4 mol,M的物质的量为4 mol,变化2 mol,反应的化学方程式为2NM,A项正确;t2时,M、N物质的量还在变化,所以没有达到平衡状态,B项错误;t3时,达到平衡状态,则正、逆反应速率相等,C项错误;t1时,N的物质的量为6 mol,M的物质的量为3 mol,则N的浓度是M浓度的2倍,D项错误。
题组三 化学平衡状态的判断
8.一定温度下,可逆反应A(g)+3B(g)2C(g)未达到平衡的是( )
A.C的生成速率与C的分解速率相等
B.单位时间内生成n mol A的同时消耗4n mol B
C.A、B、C的浓度不再变化
D.C的百分含量达到最大值
答案 B
解析 化学平衡的标志是正反应速率与逆反应速率相等。C的生成速率是正反应速率,C的分解速率是逆反应速率,A项达到平衡;A、B、C各物质的浓度不变化,是平衡状态的宏观表现,C项达到平衡;逆反应生成n mol A,同时生成3n mol B,对于正反应消耗了4n mol B,说明v
17
正>v逆,反应向正反应方向进行,B项未达到平衡;C的百分含量达到最大值,说明反应达到限度,即D项达到平衡。
9.在下列说法中,可以说明恒温恒容密闭容器中的反应:P(g)+Q(g)R(g)+S(g)已达到平衡状态的是( )
A.反应容器内压强不随时间变化
B.P和S的生成速率相等
C.容器内P、Q、R、S的物质的量浓度之比为1∶1∶1∶1
D.反应容器内气体的总物质的量不随时间变化
考点 化学平衡状态的判断
题点 等体积反应平衡状态的判断
答案 B
解析 反应前后气体分子总数不变,容器的压强始终不变,A项错误;由物质的反应速率之比等于相应的化学计量数之比得v逆(P)=v逆(S),根据题意知,v逆(P)=v正(S),则有v逆(S)=v正(S),说明反应达到平衡状态,B项正确;反应容器内P、Q、R、S的物质的量浓度之比为1∶1∶1∶1,但不一定不再改变,所以反应不一定达到平衡状态,C项错误;反应前后气体分子总数不变,气体的总物质的量不随时间变化,D项错误。
17
10.在体积不变的密闭容器中发生反应N2(g)+3H2(g)2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
A.N2、H2、NH3的浓度之比为1∶3∶2
B.混合气体的密度不随时间变化
C.当有1 mol N≡N键断裂时,有6 mol N—H键断裂
D.单位时间内生成2a mol NH3,同时消耗a mol N2
考点 化学平衡状态的判断
题点 恒容下非等体积反应平衡状态的判断
答案 C
解析 A中,N2、H2、NH3的浓度之比等于化学计量数之比时,不能确定反应是否处于平衡状态;B中,因容器的体积不变,而混合气体的总质量不改变,则无论反应平衡与否,混合气体的密度均不变;C中,当有1 mol N≡N键断裂时,相当于生成2 mol NH3(1 mol NH3中含有3 mol N—H键),即形成6 mol N—H键,同时有6 mol N—H键断裂,符合v正(NH3)=v逆(NH3),故反应处于化学平衡状态;D中,两反应速率均表示正反应速率,反应进行的任何阶段均成比例。
11.一定温度下,在某恒容的密闭容器中,建立化学平衡:C(s)+H2O(g)CO(g)+H2(g)。下列叙述中不能说明该反应已达到化学平衡状态的是( )
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键
考点 化学平衡状态的判断
题点 有固体参与的气体反应平衡状态的判断
答案 C
解析 A项,由于该反应前后气体体积改变,当体系的压强不再发生变化时,说明反应已达到化学平衡状态;B项,CO的正反应速率等于其逆反应速率,说明反应已达到化学平衡状态;C项,生成CO、H2均表示反应向正反应方向进行,没有表示出正、逆反应速率的关系,不能说明反应已达化学平衡状态;D项,H—H键断裂和H—O键断裂是两个相反的反应方向,1 mol H—H键断裂的同时断裂2 mol H—O键,即消耗1 mol H2的同时消耗了1 mol H2O,可知H2的消耗量等于其生成量,说明反应已达到化学平衡状态。
12.可逆反应2NO2(g)2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
17
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦
C.①③④⑤ D.全部
考点 化学平衡状态的判断
题点 恒容下非等体积反应平衡状态的判断
答案 A
解析 ①中单位时间内生成n mol O2的同时生成2n mol NO2,知v正=v逆,所以①能说明达到平衡状态;②所描述的都是指正反应方向的速率,无法判断;③无论达到平衡与否,物质的反应速率之比都等于化学方程式中物质的化学计量数之比;④有色气体的颜色不变能够说明达到了化学平衡;因容器体积固定,密度是一个常数,所以⑤不能说明反应达到平衡;该反应是一个反应前后气体体积不等的反应,容器的体积又固定,所以⑥⑦均能说明达到平衡。
[综合强化]
13.一定温度下,在容积为V L的密闭容器中进行反应:aN(g)bM(g),M、N的物质的量随时间的变化曲线如下图所示:
(1)此反应的化学方程式中=________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为________。
(3)下列叙述能说明上述反应达到平衡状态的是_______________________________(填字母)。
A.反应中M与N的物质的量之比为1∶1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
17
考点 化学平衡状态的判断
题点 化学平衡状态的相关综合
答案 (1)2 (2) mol·L-1·min-1
(3)CE
解析 (1)化学计量数之比等于物质的物质的量的变化量之比,所以a∶b=(8 mol-2 mol)∶(5 mol-2 mol)=2∶1,该反应的化学方程式为2N(g)M(g)。
(2)v(M)== mol·L-1·min-1。
(3)达到平衡状态时,各组分的浓度不再发生变化,M与N的物质的量之比为1∶1时,不能说明反应达到平衡状态,A选项错误;该反应的反应物和生成物都是气体,根据质量守恒定律,反应前后混合气体的质量始终不变,B选项错误;该反应为气体体积减小的反应,若反应没有达到平衡状态,反应过程中气体的总物质的量和压强始终在减小,当该量不再发生变化时,则说明反应达到了平衡状态,C和E选项正确;消耗a mol N和生成b mol M都表示的是正反应速率,没有体现逆反应速率的大小,不能说明反应达到了平衡状态,D选项错误。
14.在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图。回答下列问题:
(1)该反应的化学方程式为________________________________________________________。
(2)0~t1 s内A的反应速率为________。
(3)反应后与反应前的压强之比为________。
(4)(t1+10)s时,A气体的体积分数为________,此时v正(A)________(填“>”“<”或“=”)v逆(B)。
(5)关于该反应的说法正确的是________(填字母)。
a.到达t1 s时反应已停止
b.在t1 s之前B气体的消耗速率大于它的生成速率
c.在t1 s时C气体的正反应速率等于逆反应速率
考点 化学平衡计算与图像
题点 化学平衡计算的综合
答案 (1)3A(g)+B(g)2C(g)
17
(2) mol·L-1·s-1
(3)9∶13
(4)22.2% >
(5)bc
解析 (1)从0到t1 s时,Δc(A)=0.8 mol·L-1-0.2 mol·L-1=0.6 mol·L-1,Δc(B)=0.5 mol·L-1-0.3 mol·L-1=0.2 mol·L-1,Δc(C)=0.4 mol·L-1,三者之比为Δc(A)∶Δc(B)∶Δc(C)=0.6 mol·L-1∶0.2 mol·L-1∶0.4 mol·L-1=3∶1∶2,所以化学方程式为3A(g)+B(g)2C(g)。
(2)0~t1 s内A的反应速率为= mol·L-1·s-1。
(3)压强之比等于物质的量之比,为9∶13。
(4)A气体的体积分数为=≈22.2%;在t1~(t1+10)s反应处于平衡状态,v正(A)=3v逆(B),故v正(A)>v逆(B)。
(5)a项,可逆反应不可能停止,错误;b项,在t1 s之前,反应未达平衡,仍然向正反应方向进行,故B气体的消耗速率大于它的生成速率,正确;c项,在t1 s时,反应达到平衡,故C气体的正反应速率等于逆反应速率,正确。
15.在100 ℃时,将0.100 mol的N2O4气体充入1 L抽空的密闭容器中,隔一段时间对容器内的物质进行分析,得到如下数据:
时间/s
0
20
40
60
80
100
c(N2O4)/mol·L-1
0.100
c1
0.050
c3
a
b
c(NO2)/mol·L-1
0.000
0.060
c2
0.120
0.120
0.120
请根据表中数据回答下列问题:
(1)表中c2____(填“>”“<”或“=”,下同)c3,a____b。
(2)20 s时N2O4的浓度c1=________,在0~20 s内N2O4的平均反应速率为________ mol·L-1·s-1。
(3)如下图所示将实验装置连接好,然后向左边烧杯的水中投入一定量的CaO固体,则此烧杯中气体的红棕色变______(填“深”或“浅”,下同),向右边烧杯的水中投入一定量的硝酸铵固体,则此烧杯中气体的红棕色变______。
答案 (1)> = (2)0.070 mol·L-1 0.001 5
17
(3)深 浅
解析 (1)(2)由反应N2O42NO2可知,20 s时Δc(NO2)=0.060 mol·L-1,则Δc(N2O4)=0.030 mol·L-1,c1=(0.100-0.030) mol·L-1=0.070 mol·L-1,v(N2O4)===0.001 5 mol·L-1·s-1。当Δc(N2O4)=0.100 mol·L-1-0.050 mol·L-1=0.050 mol·L-1时,则c2=Δc(NO2)=2×0.050 mol·L-1=0.100 mol·L-1,当t=60 s时,已达平衡,c3=a=b=0.100-Δc(NO2)=0.100 mol·L-1-×0.120 mol·L-1=0.040 mol·L-1。
(3)反应CaO+H2O===Ca(OH)2放出大量的热,使水的温度升高,NH4NO3溶解时吸热,使水的温度降低。NO2为红棕色气体,N2O4为无色气体,升温时平衡向吸热(生成NO2)方向移动,即气体颜色加深;降温时,平衡向放热(生成N2O4)方向移动,即气体颜色变浅。
17