- 2021-04-16 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江西省吉安、抚州、赣州市2020届高三一模试题 化学 Word版含答案
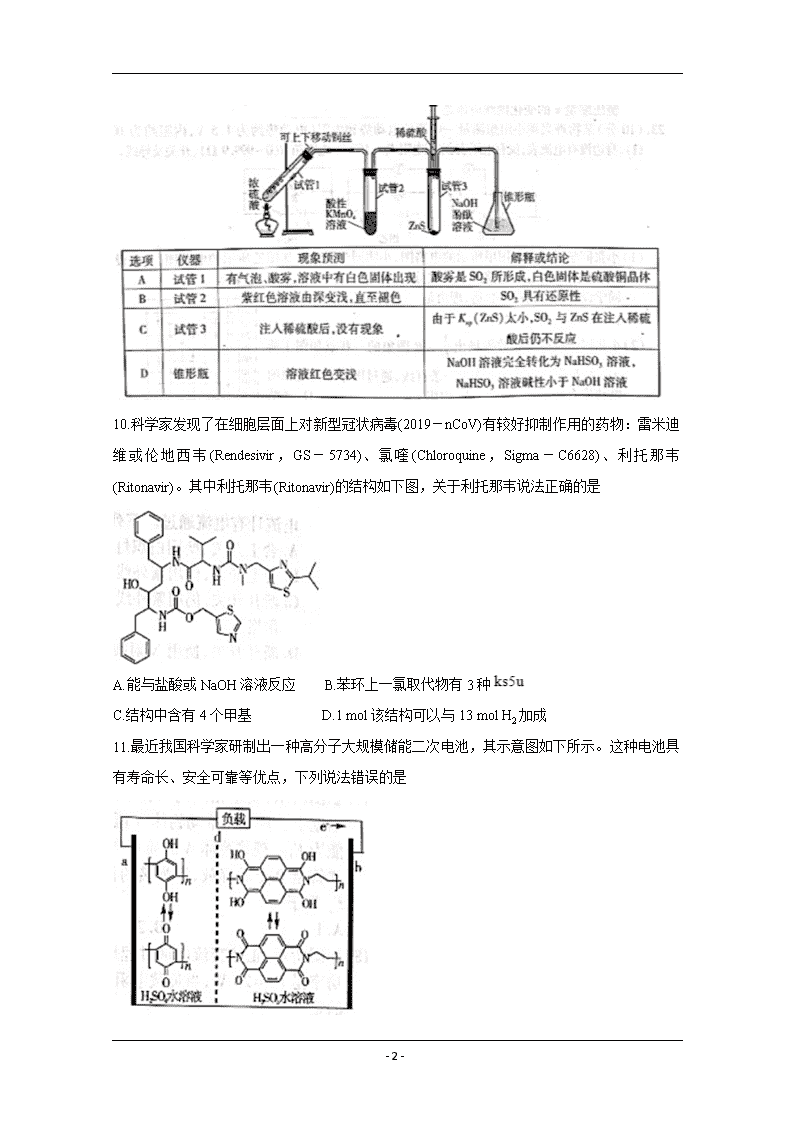
- 1 - 抚州市 2020 年高中毕业班教学质量监测卷 理科综合 化学部分 说明: 1.全卷满分 300 分,考试时间 150 分钟。 2.全卷分为试题卷和答题卡,答案要求写在答题卡上,不得在试题卷上作答,否则不给分。 第 I 卷(选择题 共 126 分) 可能用到的相对原子质量:H1 C12 O16 Mg24 P31 S32 Cl35.5 Ag108 一、选择题:本大题包括 13 小题,每小题 6 分。在每小题给出的四个选项中,只有一项符合 题目要求。 7.“17 世纪中国工艺百科全书”《天工开物》为明代宋应星所著。下列说法错误的是 A.“凡铁分生熟,出炉未炒则生,既炒则熟”中的“炒”为氧化除碳过程 B.“凡铜出炉只有赤铜,以倭铅(锌的古称)参和,转色为黄铜”中的“黄铜”为锌铜合金 C.“凡石灰经火焚,火力到后,烧酥石性,置于风中久自吹化成粉”中的“粉”为 CaO D.“凡松烟造墨,入水久浸,以浮沉分清悫”,是指炭因颗粒大小及表面积的不同而浮沉 8.已知 NA 是阿伏加德罗常数的值,下列说法正确的是 A.32 g S8 与 S6( )的混合物中所含共价键数目为 NA B.1 L 0.1 mol·L-1 H2C2O4 溶液中含 C2O42-离子数为 0.1NA C.2 mol NO 与 2 mol O2 在密闭容器中充分反应,转移的电子数为 8NA D.标准状况下 22.4 L 氯气与甲烷的混合气体,光照时充分反应生成 HCl 分子数为 NA 9.某学习小组用下列装置完成了探究浓硫酸和 SO2 性质的实验(部分夹持装置已省略),下列“现 象预测”与“解释或结论”均正确的是 - 2 - 10.科学家发现了在细胞层面上对新型冠状病毒(2019-nCoV)有较好抑制作用的药物:雷米迪 维 或 伦 地 西 韦 (Rendesivir , GS - 5734) 、 氯 喹 (Chloroquine , Sigma - C6628) 、 利 托 那 韦 (Ritonavir)。其中利托那韦(Ritonavir)的结构如下图,关于利托那韦说法正确的是 A.能与盐酸或 NaOH 溶液反应 B.苯环上一氯取代物有 3 种 C.结构中含有 4 个甲基 D.1 mol 该结构可以与 13 mol H2 加成 11.最近我国科学家研制出一种高分子大规模储能二次电池,其示意图如下所示。这种电池具 有寿命长、安全可靠等优点,下列说法错误的是 - 3 - A.硫酸水溶液主要作用是增强导电性 B.充电时,电极 b 接正极 C.d 膜是质子交换膜 D.充放电时,a 极有 12.科学家合成出了一种用于分离镧系金属的化合物 A(如下图所示),短周期元素 X、Y、Z 原 子序数依次增大,其中 Z 位于第三周期。Z 与 Y2 可以形成分子 ZY6,该分子常用作高压电气 设备的绝缘介质。下列关于 X、Y、Z 的叙述,正确的是 A.离子半径:Y>Z B.氢化物的稳定性:X>Y C.最高价氧化物对应水化物的酸性:X>Z D.化合物 A 中,X、Y、Z 最外层都达到 8 电子稳定结构 13.常温下,向 20 mL 0.1 mol·L-1 HB 溶液中逐滴滴入 0.1 mol·L-1 NaOH 溶液,所得 pH 变化 曲线如右图所示。下列说法错误的是 A.OA 各点溶液均存在:c(B-)>c(Na+) B.C 至 D 各点溶液导电能力依次增强 C.点 O 时,pH>1 D.点 C 时,x 约为 10.4 第 II 卷(非选择题 共 174 分) 三、非选择题:包括必考题和选考题两部分。第 22 题~第 32 题为必考题,每个试题考生都 必须作笞,第 33 题~第 38 题为选考题,考生根据要求作答。 (一)必考题:11 题,共 129 分。 26.(14 分)过氧乙酸(CH3COOOH)不仅在卫生医疗、食品消毒及漂白剂领域有广泛应用,也应 用于环境工程、精细化工等领域。实验室利用醋酸(CH3COOH)与双氧水(H2O2)共热,在固体 酸的催化下制备过氧乙酸(CH3COOOH),其装置如下图所示。请回答下列问题: - 4 - 实验步骤: I.先在反应瓶中加入冰醋酸、乙酸丁酯和固体酸催化剂,开通仪器 1 和 8,温度维持为 55℃; II.待真空度达到反应要求时,打开仪器 3 的活塞,逐滴滴入浓度为 35%的双氧水,再通入冷 却水; III.从仪器 5 定期放出乙酸丁酯和水的混合物,待反应结束后分离反应器 2 中的混合物,得到 粗产品。 (1)仪器 6 的名称是 ,反应器 2 中制备过氧乙酸(CH 3COOOH)的化学反应方程式 为 。 (2)反应中维持冰醋酸过量,目的是提高 ;分离反应器 2 中的混 合物得到粗产品,分离的方法是 。 (3)实验中加入乙酸丁酯的主要作用是 (选填字母序号)。 A.作为反应济剂,提高反应速率 B.与固体酸一同作为催化剂使用,提高反应速率 C.与水形成沸点更低的混合物,利于水的蒸发,提高产率 D.增大油水分离器 5 的液体量,便于实验观察 (4)从仪器 5 定期放出乙酸丁酯和水的混合物,待观察到 (填现象)时,反应 结束。 (5)粗产品中过氧乙酸(CH3COOOH)含量的测定:取一定体积的样品 V mL,分成 6 等份,用过 量 KI 溶液与过氧化物作用,以 0.1 mol·L -1 的硫代硫酸钠溶液滴定碘(I2+2S2O32-=2I-+ S4O62-);重复 3 次,平均消耗量为 V1 mL。再以 0.02 mol·L-1 的酸性高锰酸钾溶液滴定样品, 重复 3 次,平均消耗量为 V2 mL。则样品中的过氧乙酸的浓度为 mol·L-1。 27.(15 分)银精矿主要含有 Ag2S(杂质是铜、锌、锡和铅的硫化物),工业上利用银精矿制取贵 - 5 - 金属银,流程图如下图所示。已知“氯化焙烧”能把硫化物转化为氯化物,请回答下列问题: (1)“氯化焙烧”的温度控制在 650~670℃,如果温度过高则对焙烧不利,产率会降低,原因 是 。 (2)水洗后的滤液中溶质有盐酸盐和大量钠盐,取少量滤液加入盐酸酸化,再滴入氯化钡溶液 有白色沉淀生成,此钠盐为 (填化学式)。 (3)氨浸时发生的化学反应方程式为 。 (4)“沉银”是用 N2H4 还原银的化合物。 ①N2H4 的电子式是 。 ②理论上,1 mol N2H4 完全反应所得到的固体质量是 g。 ③向所得母液中加入烧碱,得到的两种物质可分别返回 、 工序中循环使用。 (5)助熔剂 Na2CO3 和 Na2B4O7 有两个作用:一是降低了银的熔点,减少能耗;二是 。 利用 的方法可以进一步直接精炼银锭。 28.(14 分)(1)①已知反应 A(g)+B(g) 2D(g),若在起始时 c(A)=a mol·L-1,c(B)=2a mol·L- 1,则该反应中各物质浓度随时间变化的曲线是 (选填字母序号)。 ②在 298K 时,反应 A(g) 2B(g)的 Kp=0.1132 kPa,当分压为 p(A)=p(B)=1 kPa 时,反应 速率 v 正 v 逆(填“<”“=”或“>”)。 ③温度为 T 时,某理想气体反应 A(g)+B(g) C(g)+M(g),其平衡常数 K 为 0.25,若以 A: B=1:1 发生反应,则 A 的理论转化率为 (结果保留 3 位有效数字)。 (2)富勒烯 C60 和 C180 可近似看作“完美的”球体,富勒烯的生成时间很快,典型的是毫秒级, 在所有的合成技术中得到的 C60 的量比 C180 的量大得多。已知两个转化反应: 反应物 3C60 反应物 C180 - 6 - 则势能(活化能)与反应进程的关系正确的是 (选填字母序号)。 (3)甲醇脱氢和甲醇氧化都可以制取甲醛,但是 O2 氧化法不可避免地会深度氧化成 CO。脱氢 法和氧化法涉及的三个化学反应的 lgK 随温度 T 的变化曲线如右图所示。写出图中曲线①的 化学反应方程式 ;曲线③的化学反应方程式为 ; 曲线②对应的化学反应是 (填“放热”或“吸热”)反应。 (二)选考题:共 45 分。请考生从给出的 2 道物理题、2 道化学题、2 道生物题中每科任选一题 作答,并用 2B 铅笔在答题卡上把所选题目的题号涂黑。注意所做题目的题号必须与所涂题目 的题号一致,在答题卡选答区域指定位置答题。如果多做,则每学科按所做的第一小题计分。 35.[化学——选修 3:物质结构与性质](15 分) 黑磷是磷的一种稳定的同素异形体,黑磷具有正交晶系的晶体结构(图 A),晶胞参数 a=3.310 ,b=4.380 ,c=10.500 。黑磷烯是二维的单层黑磷(图 B),黑磷烯与石墨烯结构相似, P 的配位数为 3。与石墨烯相比,黑磷烯具有半导体性质,更适合于制作电子器件。已知黑磷 结构中只有一种等效的三配位 P,所有 P 原子的成键环境一样,图 A 中编号为①的 P 原子的 晶胞内坐标为(0.500,0.090,0.598)。请回答下列问题: o A o A o A - 7 - (1)写出 P 原子的基态电子排布: (2)P 和 F 的电负性大小顺序是 x(P) x(F)。(填“<”“=”或“>”) P 和 F 形成的分子 PF3 和 PF5,它们的几何构型分别为 、 。 (3)①黑磷中 P 原子杂化类型是 。黑磷中不存在 (选填字母序号)。 A.共价键 B.σ 键 C.π 键 D.范德华力 ②红磷、白磷与黑磷熔点从高到低的顺序为 ,原因是 。 (4)图 A 中编号为②的 P 原子的晶胞内坐标为 ,黑磷的晶胞中含有 个 P 原子。 36.[化学——选修 5:有机化学基础](15 分) 苯二氮卓类药物氟马西尼(F)的合成路线如下图所示。请回答下列问题: (1)A 中官能团有氟原子、 和 。(均填名称) (2)C3H5O2Cl 的结构式为 。 (3)反应①和②的反应类型相同,其反应类型是 。 (4)化合物 D 的分子式为 。 (5)反应⑤生成“物质 F”和 HCl,则 E→F 的化学反应方程式为 。 - 8 - (6) 是 F 的同分异构体,其中 X 部分含-COOH 且没有支链,满足该条件的同分异 构体有 种(不考虑立体异构)。 (7)已知氨基酸之间脱水能够形成含肽键的化合物,请设计由甘氨酸(HOOCCH2NH2)和 CNCH2COOC2H5 制备 的合成路线 (无机试 剂任选)。 - 9 - 化学参考答案 (江西省 2020 年高中毕业班新课程教学质量监测卷) 7.【答案】C 【解析】生铁是含碳量大于 2%的铁碳合金,生铁性能坚硬、耐磨、铸造性好,但生铁脆, 不能锻压。而熟铁含碳量在 0.02%以下,又叫锻铁、纯铁,熟铁质地很软,塑性好,延展 性好,可以拉成丝,强度和硬度均较低,容易锻造和焊接。“炒则熟”,碳含量由于“炒” 而变成碳氧化合物,使得碳含量降低。A 正确。 赤铜指纯铜,也称红铜、紫铜。由于表面含有一层 Cu2O 而呈现红色。“倭铅”是锌的古称, 黄铜是由铜和锌所组成的合金,由铜、锌组成的黄铜就叫作普通黄铜,如果是由两种以 上的元素组成的多种合金就称为特殊黄铜。黄铜有较强的耐磨性能,黄铜常被用于制造 阀门、水管、空调内外机连接管和散热器等。B 正确。 凡石灰经火焚,火力到后,烧酥石性,生成 CaO;而“久置成粉”主要生成 Ca(OH)2,进 一步与 CO2 反应则会生成 CaCO3。C 错误。 古代制墨,多用松木烧出烟灰作原料,故名松烟墨。烟是动植物未燃烧尽而生成的气化 物,烟遇冷而凝固生成烟炱,烟炱有松烟炱和油烟炱之分。松烟墨深重而不姿媚,油烟 墨姿媚而不深重。松烟墨的特点是浓黑无光,入水易化。“凡松烟造墨,入水久浸,以浮 沉分清悫”,颗粒小的为胶粒,大的形成悬浊液。D 正确。 8.【答案】A 【解析】由于 32 g S8 与 S6( )的混合物中含硫为 1mol,则该混合物中含 1mol S-S 键,故 A 正确。 1 L 0.1 mol·L−1 H2C2O4 溶液含 C2O42- 离子数小于 0.1NA,因为草酸是弱电解质,部分电 离出 C2O42-,故 B 错误。 密闭容器中 2 mol NO 与 2mol O2 充分反应,这是一个平衡反应,转移的电子数小于 4NA, 由于 NO 不足,更小于 8NA,故 C 错误。 在标准状况下,22.4 L 氯气与甲烷混合气体,光照时充分反应,由于无法知道氯气、甲 烷各为多少量,所以生成 HCl 分子数无法计算。故 D 错误。 9.【答案】B 【解释】A 选项中如果出现白色固体也应该是硫酸铜固体而不是其晶体,因为硫酸铜晶体 是蓝色的。A 错误。 B 选项,现象与结论均正确。B 正确。 C 选项,ZnS 与稀硫酸反应生成 H2S,H2S+SO2→S+H2O,出现硫单质固体;所以现象与解释 均不正确,C 错误。 D 选项,NaHSO3 溶液显酸性,酚酞溶液就会褪色,现象与解释是矛盾的。D 错误。 - 10 - 10.【答案】A 【解析】利托那韦(Ritonavir)结构中含有肽键、酯基, 或 在酸碱条件 下都能水解,A 正确。 由于两个苯环没有对称,一氯取代物有 6 种,B 错误。 结构中 有 5 个甲基,C 错误。 由于肽键、酯基的碳氧双键一般不参与氢气加成,所以 1 mol 该结构可以与 10 mol H2 加 成,D 错误。 11.【答案】C 【解析】从图中电子移动方向可以判断 a 极是原电池的负极,b 极是原电池的正极,为了 形成闭合电路,以硫酸水溶液作为电解质溶液,A 正确。 b 为正极,充电时就接正极,B 正确。 d 膜左右池都有硫酸水溶液,不需要质子交换膜,只是防止高分子穿越,所以为半透膜, C 错误。 a 极是负极,酚失去电子变成醌,依据电荷守恒以 H+的个数判断电子数目,D 正确。 12.【答案】D 【解析】观察正离子结构 ,Z 失去一个电子后,可以成 3 个共价键,说明 Z 原子最外面为 6 个电子,由于 Z 位于第三周期,所以 Z 为 S。 负离子结构为 ,Y 成一个共价键,为-1 价,不是第三周期元素,且原子序数大 于 X,应为 F(当然不是 H,因为正离子已经有 H);X 得到一个电子成 4 个共价键,说明 其最外层为 3 个电子,为 B。 A.离子半径 F-查看更多