- 2021-04-16 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学第3章晶体结构与性质第1节晶体的常识练习含解析 人教版选修
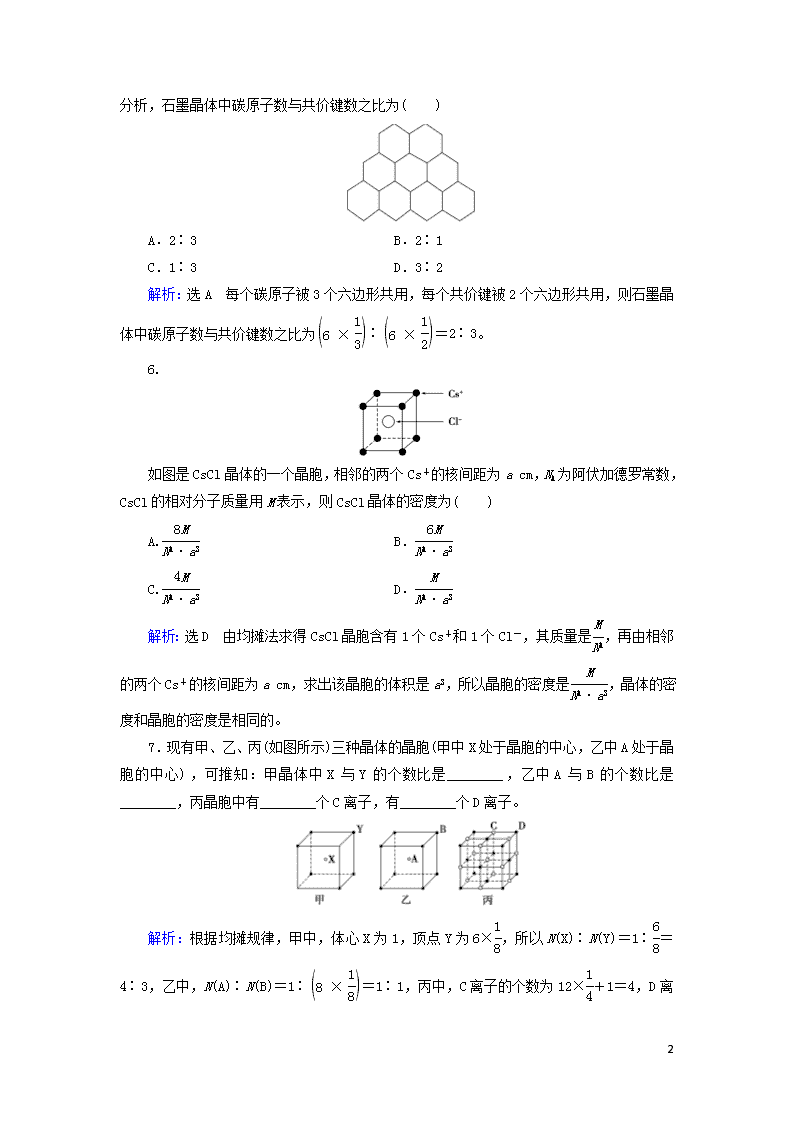
第一节 晶体的常识 层级一 学业达标练 1.下列关于晶体的叙述不正确的是( ) A.晶体有自范性 B.晶体内部粒子的排列高度有序 C.晶体的某些物理性质常会表现出各向异性 D.粉末状固体一定不是晶体 解析:选D 晶体的特点有:内部粒子排列得高度有序性、有自范性和各向异性。当晶体的晶粒较小时,即为粉末状,故D项不正确。 2.下列物质中属于晶体的是( ) A.橡胶 B.玻璃块 C.水晶 D.淀粉 解析:选C 橡胶没有一定规则的外形,没有固定的熔、沸点,不是晶体,故A不选;玻璃没有一定规则的外形、没有固定的熔、沸点,不是晶体,故B不选;水晶是二氧化硅,具有整齐规则的几何外形、有固定的熔点,属于晶体,故C选;淀粉没有一定规则的外形、没有固定的熔、沸点,不是晶体,故D不选。 3.下列哪些性质不能区别晶体与玻璃体( ) A.各向异性 B.X射线衍射 C.导电性 D.有无固定的熔点 解析:选C 根据晶体的特点和性质可知:晶体具有规则的几何外形;具有各向异性;X射线衍射时能看到明显的谱线。而晶体中除金属晶体外,一般不易导电。 4.钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体结构示意图如图所示,它的化学式是( ) A.BaTi8O12 B.BaTi4O5 C.BaTi2O4 D.BaTiO3 解析:选D 观察钛酸钡晶体结构示意图可知,Ba在立方体的中心,完全属于该晶胞;Ti处于立方体的8个顶点,每个Ti有属于该晶胞;O处于立方体的12条棱的中点,每个O有属于该晶胞。即晶体中N(Ba)∶N(Ti)∶N(O)=1∶∶=1∶1∶3。 8 5.石墨晶体是层状结构,在每一层内,每个碳原子都跟其他3个碳原子相结合。据图分析,石墨晶体中碳原子数与共价键数之比为( ) A.2∶3 B.2∶1 C.1∶3 D.3∶2 解析:选A 每个碳原子被3个六边形共用,每个共价键被2个六边形共用,则石墨晶体中碳原子数与共价键数之比为∶=2∶3。 6. 如图是CsCl晶体的一个晶胞,相邻的两个Cs+的核间距为a cm,NA为阿伏加德罗常数,CsCl的相对分子质量用M表示,则CsCl晶体的密度为( ) A. B. C. D. 解析:选D 由均摊法求得CsCl晶胞含有1个Cs+和1个Cl-,其质量是,再由相邻的两个Cs+的核间距为a cm,求出该晶胞的体积是a3,所以晶胞的密度是,晶体的密度和晶胞的密度是相同的。 7.现有甲、乙、丙(如图所示)三种晶体的晶胞(甲中X处于晶胞的中心,乙中A处于晶胞的中心),可推知:甲晶体中X与Y的个数比是________,乙中A与B的个数比是________,丙晶胞中有________个C离子,有________个D离子。 解析:根据均摊规律,甲中,体心X为1,顶点Y为6×,所以N(X)∶N(Y)=1∶=4∶3,乙中,N(A)∶N(B)=1∶=1∶1,丙中,C离子的个数为12×+1=4,D离子的个数为8×+6×=4。 8 答案:4∶3 1∶1 4 4 8.某离子晶体的晶胞结构如图中a所示。表示X位于立方体顶点,表示Y位于立方体中心。试分析: (1)晶体中每一个Y同时吸引着________个X,每个X同时吸引着________个Y,该晶体的化学式是____________________。 (2)晶体中在每个X周围与它最接近且距离相等的X共有________个。 (3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX为________。 解析:(1)同时吸引的原子个数即指在某原子周围与之距离最近的其他种类的原子个数,观察图a可知,Y位于立方体的体心,X位于立方体的顶点,每个Y同时吸引着4个X,而每个X同时被8个立方体共用,每个立方体的体心都有1个Y,所以每个X同时吸引着8个Y,X、Y的个数之比为4∶8,所以化学式为XY2或Y2X。(2)晶体中每个X周围与它最接近的X之间的距离应为图b所示的立方体面对角线位置。处在这样位置的X共有12个。(3)若将4个X连接,构成1个正四面体,Y位于正四面体的中心(如图中b所示),联系CH4的键角,可知∠XYX=109°28′。 答案:(1)4 8 XY2或Y2X (2)12 (3)109°28′ 9.下列有关晶体和非晶体的说法中正确的是( ) A.具有规则几何外形的固体均为晶体 B.晶体具有自范性,非晶体没有自范性 C.晶体研碎后即变为非晶体 D.将玻璃加工成规则的固体即变成晶体 解析:选B 晶体的规则几何外形是自发形成的,有些固体尽管有规则的几何外形,但由于不是自发形成的,所以不属于晶体,因此,A、D项错误;晶体是由晶胞通过无隙并置形成的,组成晶体的粒子在三维空间呈现周期性的有序排列,因此,晶体研碎成小的颗粒仍然是晶体,所以C项错误;自范性是晶体和非晶体的本质区别,B项正确。 10.下列有关获得晶体的途径,错误的是( ) A.从熔融态结晶出来的硫 B.熔融态物质急速冷却 C.凝华得到的碘 D.从硫酸铜饱和溶液中析出的硫酸铜 解析: 8 选B 获得晶体的方法有三种:熔融态物质凝固;气态物质冷却凝华;溶质从溶液中析出。 11. 国家实验室一个研究小组发现首例带结晶水的晶体在5 K下呈现超导性。据报道,该晶体中含有最简式为CoO2的层状结构,结构如右图(小球表示Co原子,大球表示O原子)。下列用粗线画出的CoO2层状结构的晶胞(晶胞是在晶体中具有代表性的最小重复单元)示意图不符合化学式的是( ) 解析:选D A项CoO2层状结构的晶胞中含有Co原子数为1,含有O原子数为4×=2,所以Co原子与O原子数之比为1∶2,故A正确;B项CoO2层状结构的晶胞中含有Co原子数为1+4×=2,含有O原子数为4,所以Co原子与O原子数之比为1∶2,故B正确;C项CoO2层状结构的晶胞中含有Co原子数为4×=1,含有O原子数为4×=2,所以Co原子与O原子数之比为1∶2,故C正确;D项CoO2层状结构的晶胞中含有Co原子数为1,含有O原子数为4×=1,所以Co原子与O原子数之比为1∶1,故D错误。 12.某晶体的晶体结构中最小重复单元如图所示:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为( ) A.B2A B.BA2 C.B7A4 D.B4A7 解析:选B 根据题图知,A的粒子数为8,B的粒子数为8×+6×=4,故化学式为BA2。 13.如图所示是硼和镁形成的化合物的晶体结构单元,镁原子间形成正六棱柱,且棱柱的上下底面各有一个镁原子,6个硼原子位于棱柱内。则该化合物的化学式可表示为( ) 8 A.MgB B.MgB2 C.Mg2B D.Mg3B2 解析:选B 棱柱顶点上的每个镁原子均被六个相邻的棱柱所共有,棱柱底面上的每个镁原子均被两个相邻的棱柱所共有,故每个晶体结构单元平均拥有Mg原子数为6×2×+2×=3,而B原子位于棱柱内,故平均每个晶体结构单元拥有B原子数为6。则该化合物的化学式为MgB2。 14.食盐晶体是由钠离子(图中的“”)和氯离子(图中的“”)组成的,且均为等距离的交错排列。已知食盐的密度是2.2 g·cm-3,阿伏加德罗常数为6.02×1023 mol-1。在食盐晶体中两个距离最近的钠离子中心间的距离最接近于( ) A.3.0×10-8 cm B.3.5×10-8 cm C.4.0×10-8 cm D.5.0×10-8 cm 解析:选C 从NaCl晶体结构模型中分割出一个小立方体,如图所示,a表示其边长,d表示两个Na+中心间的距离。每个小立方体含Na+:×4=,含Cl-:×4=,即每个小立方体含Na+—Cl-离子对个。则有:a3·2.2 g·cm-3=,解得a=2.81×10-8 cm,又因为d=a,故食盐晶体中两个距离最近的Na+中心间的距离为d=×2.81×10-8 cm≈4.0×10-8 cm。 15.元素X的某价态离子Xn+中所有电子正好充满K、L、M三个能层,它与N3-形成的晶体结构如图所示。 8 (1)该晶体的阳离子与阴离子个数比为________。 (2)该晶体中离子Xn+的n=________。 (3)X元素的原子序数是________。 (4)晶体中每个N3-被________个等距离的Xn+包围。 解析:(1)Xn+位于晶胞的棱上,其数目为12×=3;N3-位于晶胞的顶角,其数目为8×=1,故二者个数比为3∶1。 (2)由晶体的化学式X3N知X所带电荷数为1。 (3)因为K、L、M三个能层充满,故Xn+有2、8、18结构,所以X的原子序数是29。 (4)N3-位于晶胞顶角,故其被6个Xn+从上、下、左、右、前、后包围。 答案:(1)3∶1 (2)1 (3)29 (4)6 16.如图是超导化合物——钙钛矿晶体中最小重复单元(晶胞)的结构。请回答: (1)该化合物的化学式为________________。 (2)在该化合物晶体中,与某个钛原子距离最近且相等的其他钛原子共有________个。 (3)设该化合物的相对分子质量为M,密度为a g/cm3,阿伏加德罗常数为NA,则晶体中钙原子与钛原子之间的最短距离为________。 解析:(1)这个晶胞对位于顶点上的每个钛原子占有的份额为,所以,它单独占有的钛原子个数为8×=1;它对位于棱上的每个氧原子占有的份额为,所以,它单独占有的氧原子个数为12×=3;它全部拥有体内的一个钙原子。所以,这个晶胞单独占有的钛原子、氧原子和钙原子的个数分别为1、3、1,该化合物的化学式为CaTiO3。 (2)钛位于正方体的顶点上,则与一个钛原子距离最近的钛原子与它共棱。从立方晶胞进行堆积的图形可以看出,在横向、纵向、竖向上,与它共棱的原子都是2个,共6个。 (3)设这种立方晶胞的边长是b,那么,钙原子与钛原子之间的距离是体对角线的一半,即b。因为每个立方体的体积为b3,而NA个这样的立方体堆积到一起就是1 mol晶体,其质量为M g,其体积为= cm3。所以,NA·b3= cm3,b= cm,则题中所求距离为 8 eq f(r(3),2)· cm。 答案:(1)CaTiO3 (2)6 (3)· cm 8 8查看更多