- 2021-04-14 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学第三章晶体结构与性质第四节离子晶体同步练习新人教版选修32
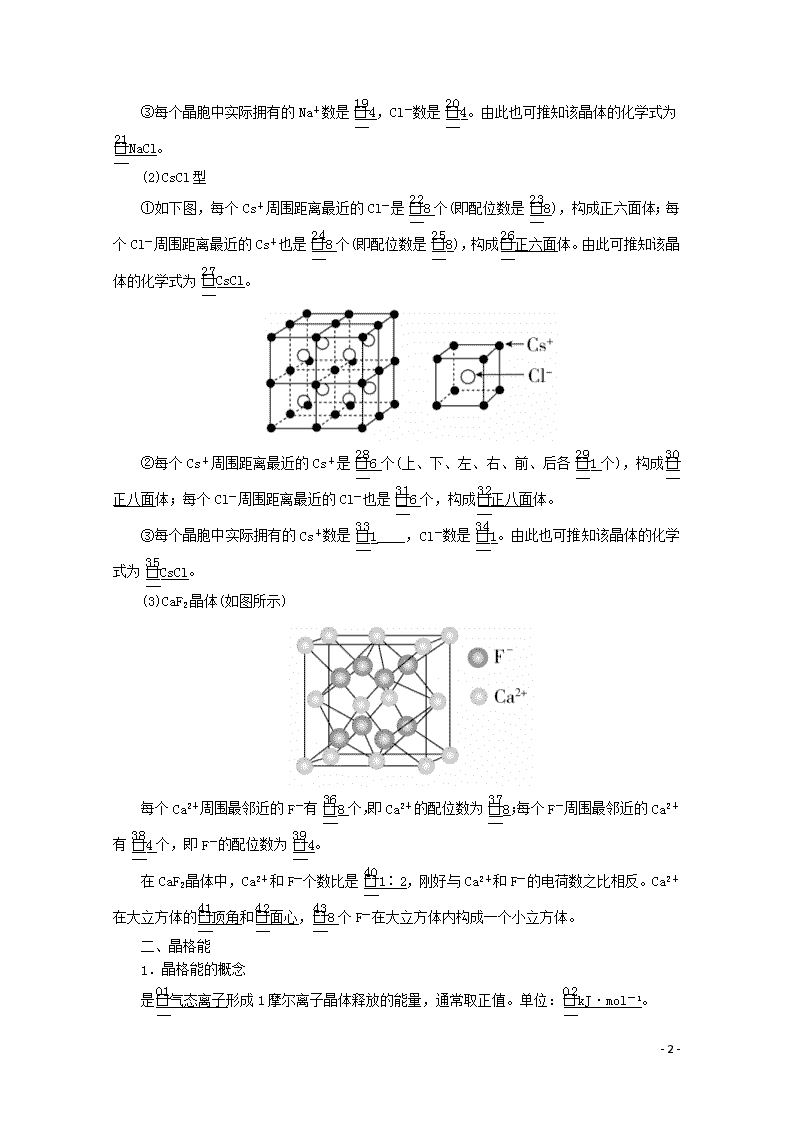
第四节 离子晶体 [明确学习目标] 1.能说明离子键的形成,能根据离子化合物的结构特征解释其物理性质。2.了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱。 学生自主学习 一、离子晶体 1.定义:由阳离子和阴离子通过离子键结合而成的晶体。 2.晶体结构的决定因素 3.离子晶体的性质 4.三种常见离子晶体的结构 (1)NaCl型 ①如右图所示,每个Na+周围距离最近的Cl-是6个(上、下、左、右、前、后各1个,即配位数是6),构成正八面体;每个Cl-周围距离最近的Na+也是6个(即配位数是6),构成正八面体。由此可推知该晶体的化学式为NaCl。 ②每个Na+周围距离最近的Na+是12个(上层4个,同层4个,下层4个),每个Cl-周围距离最近的Cl-也是12个。 - 9 - ③每个晶胞中实际拥有的Na+数是4,Cl-数是4。由此也可推知该晶体的化学式为NaCl。 (2)CsCl型 ①如下图,每个Cs+周围距离最近的Cl-是8个(即配位数是8),构成正六面体;每个Cl-周围距离最近的Cs+也是8个(即配位数是8),构成正六面体。由此可推知该晶体的化学式为CsCl。 ②每个Cs+周围距离最近的Cs+是6个(上、下、左、右、前、后各1个),构成正八面体;每个Cl-周围距离最近的Cl-也是6个,构成正八面体。 ③每个晶胞中实际拥有的Cs+数是1____,Cl-数是1。由此也可推知该晶体的化学式为CsCl。 (3)CaF2晶体(如图所示) 每个Ca2+周围最邻近的F-有8个,即Ca2+的配位数为8;每个F-周围最邻近的Ca2+有4个,即F-的配位数为4。 在CaF2晶体中,Ca2+和F-个数比是1∶2,刚好与Ca2+和F-的电荷数之比相反。Ca2+在大立方体的顶角和面心,8个F-在大立方体内构成一个小立方体。 二、晶格能 1.晶格能的概念 是气态离子形成1摩尔离子晶体释放的能量,通常取正值。单位:kJ·mol-1。 - 9 - 2.晶格能的意义 (1)晶格能是最能反映离子晶体稳定性的数据,晶格能越大,离子键越牢固,晶体越稳定,而且熔点越高,硬度越大。 BaO SrO CaO 核间距/10-12 m 277 257 240 晶格能/kJ·mol-1 3054 3223 3401 熔点/K 1918 2430 2614 摩氏硬度 3.3 3.5 4.5 (2)晶格能与岩浆晶出规则:岩浆晶出的次序与晶格能的大小有关。一般地,晶格能大的矿物先晶出,晶格能小的矿物后晶出,即晶格能越大,岩浆中的矿物越易结晶析出。 1.表示离子晶体的化学式就是组成离子晶体的分子式吗? 提示:不是。离子晶体中不存在小分子,化学式仅表示晶体中阴、阳离子个数比的最简式。如在NaCl、CsCl和ZnS晶体中,都不存在单个的NaCl、CsCl和ZnS分子。在这种晶体中,阴、阳离子的个数比都是1∶1,NaCl和CsCl只是表示离子晶体中阴、阳离子个数比的化学式,而不是表示分子组成的分子式。 2.晶格能与晶体的熔点、硬度有怎样的关系? 提示:晶格能的数据可以用来说明许多典型离子晶体的性质变化规律,晶格能越大,形成的离子晶体越稳定,晶体的熔点越高,硬度越大。 课堂互动探究 一、离子晶体 1.离子晶体的结构特点 (1)构成粒子:阳离子和阴离子。 (2)作用力:离子键。 (3)配位数:一个离子周围最邻近的异电性离子的数目。 2.常见的离子晶体 - 9 - [即时练] 1.如下图所示是从NaCl或CsCl的晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( ) A.图(1)和(3) B.图(2)和(3) C.图(1)和(4) D.只有图(4) 答案 C 解析 NaCl晶体中,每个Na+周围最邻近的Cl-有6个,构成正八面体,同理,每个Cl-周围最邻近的6个Na+也构成正八面体,由此可知图(1)和(4)是从NaCl晶体中分割出来的结构图。 2.同类晶体物质熔点的变化是有规律的,试分析下列两组物质熔点规律性变化的原因: A组物质 NaCl KCl CsCl 熔点/K 1074 1049 918 B组物质 Na Mg Al 熔点/K 370 922 933 晶体熔点的高低,取决于组成晶体微粒间的作用力的大小。A组物质是________晶体,晶体中微粒之间通过________相连。B组物质是________晶体,价电子数由少到多的顺序是________,粒子半径由大到小的顺序是________________。 - 9 - 答案 离子 离子键 金属 Na<Mg<Al Na>Mg>Al 解析 A组物质为离子晶体,离子之间通过离子键相结合,由于NaCl、KCl、CsCl中的阴、阳离子所带电荷数相等,而r(Na+)查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档