- 2021-04-14 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学人教版选修3学案:第三章 晶体结构与性质 本章知识整合 Word版含解析
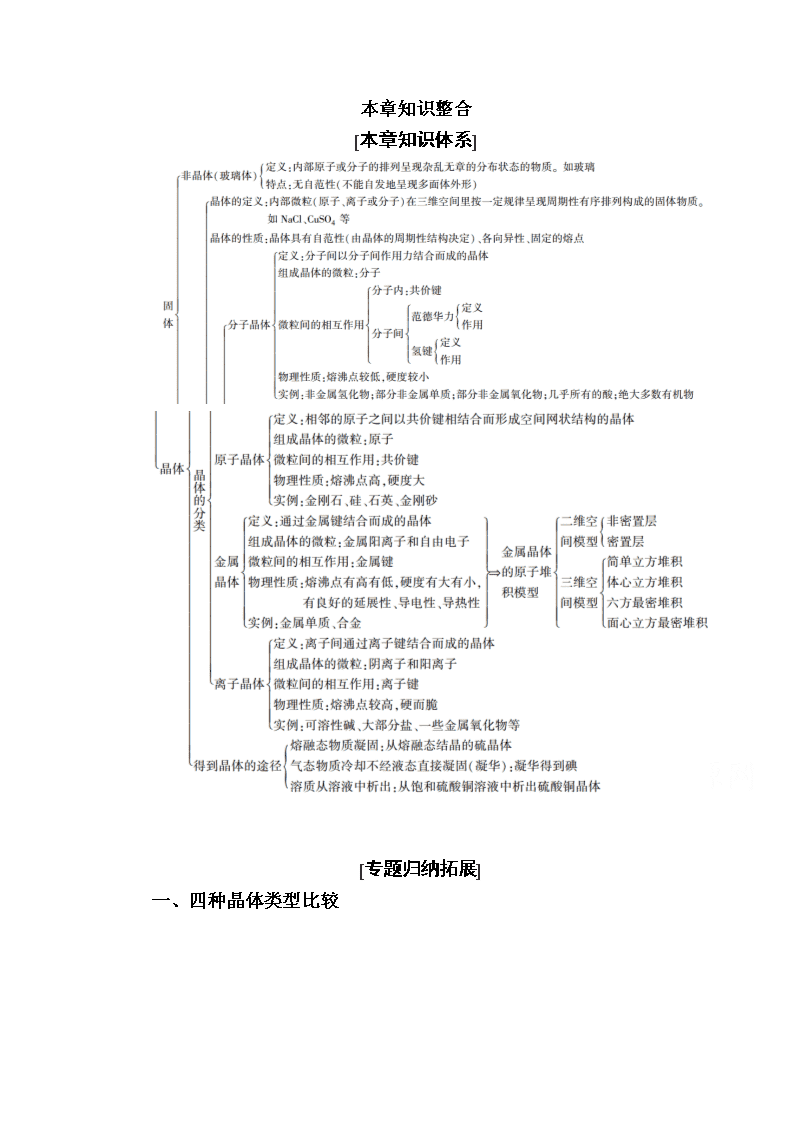
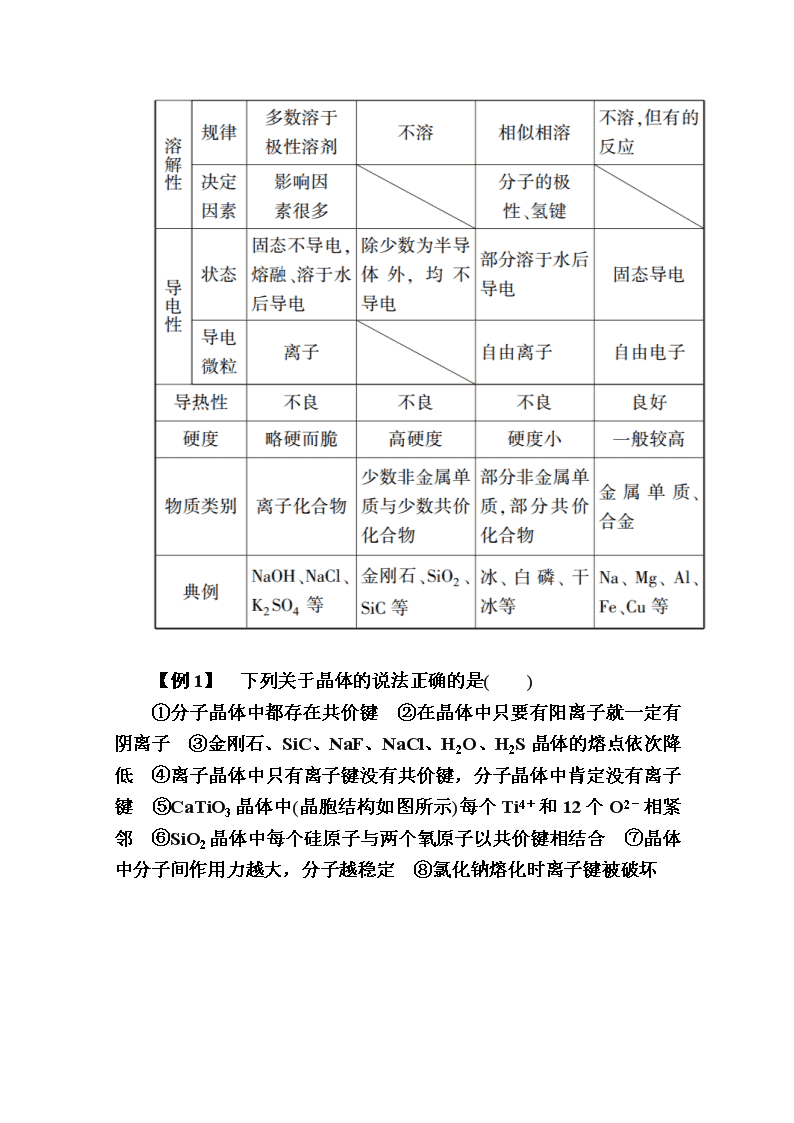
www.ks5u.com 本章知识整合 [本章知识体系] [专题归纳拓展] 一、四种晶体类型比较 【例1】 下列关于晶体的说法正确的是( ) ①分子晶体中都存在共价键 ②在晶体中只要有阳离子就一定有阴离子 ③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低 ④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键 ⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻 ⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合 ⑦晶体中分子间作用力越大,分子越稳定 ⑧氯化钠熔化时离子键被破坏 A.①②③⑥ B.①②④ C.③⑤⑦ D.③⑤⑧ 【解析】 稀有气体的晶体内不含化学键;金属晶体中含阳离子和自由电子,无阴离子;离子晶体内可能有共价键;SiO2晶体中每个硅原子与四个氧原子以共价键相结合;分子的稳定性由共价键的键能决定,与分子间作用力无关。 【答案】 D 二、判断晶体类型的方法 如何根据题目信息快速判断晶体的类型呢?掌握常见判断晶体类型的方法是制胜的法宝。现将常用的判断晶体类型的方法归纳如下: 1.根据组成晶体的微粒和微粒间的作用力判断 原子晶体的构成微粒是原子,微粒间作用力是共价键;分子晶体的构成微粒是分子,微粒间作用力是分子间作用力(范德华力和氢键);金属晶体的构成微粒是金属离子和自由电子,微粒间作用力是金属键;离子晶体的构成微粒是阴、阳离子,微粒间作用力是离子键。 2.根据物质的分类进行判断 大多数非金属单质(除金刚石、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除二氧化硅外)、酸、绝大多数有机物(除有机盐类外)是分子晶体;常见的原子晶体有:(1)单质,如金刚石、晶体硅、晶体硼等,(2)化合物,如SiO2、SiC、BN、Si3N4、C3N4等;离子化合物均为离子晶体;金属单质和合金均为金属晶体。 3.根据晶体的熔、沸点判断 原子晶体的熔点很高,常在1 000 ℃ 以上,而分子晶体的熔点很低,常在300 ℃以下,金属晶体的熔点有高有低,离子晶体的熔点一般也比较高。如果常温下为气态或液态的物质,表明其熔、沸点较低,其晶体应属于分子晶体(Hg除外)。 4.根据导电性判断 分子晶体不能导电,但部分分子晶体溶于水后能导电;原子晶体大多不导电,但晶体锗、晶体硅为半导体;离子晶体在熔融状态或水溶液中能导电;金属晶体是电的良导体。 5.根据硬度和机械性能判断 原子晶体硬度大,分子晶体硬度小,离子晶体硬度较大,金属晶体延展性好,但有的金属晶体硬度也很大。 6.判断晶体类型,既可以从结构入手,也可以从物理性质入手 (1)由非金属元素组成的二元化合物不是离子晶体(二元以上未必正确,如NH4Cl、NH4NO3)。 (2)熔点在1 000 ℃以下的不是原子晶体。 (3)固态不导电,熔融态导电的是离子晶体。 (4)熔点低、能溶于有机溶剂的晶体是分子晶体。 (5)金属元素与非金属元素组成的化合物未必都是离子晶体,一般用电负性差值来判断。电负性差值大于1.7的一般是离子晶体,但不完全符合,还与化合价有关。 7.晶体中的特殊情况 晶体中有一些特殊情况,与一般的规律不同,现总结特殊情况如下: (1)化学键类型相同,晶体类型不一定相同。如CO2和SiO2中所含化学键相同,但CO2晶体是分子晶体,而SiO2晶体是原子晶体。 (2)分子晶体的熔点不一定比金属晶体的熔点低。如很多分子晶体的熔点都高于金属汞的熔点。 (3)由共价化合物所形成的晶体不一定是分子晶体。如SiO2、SiC等都是原子晶体。 (4)由金属元素和非金属元素所形成的化合物不一定是离子化合物,其晶体也不一定是离子晶体。如AlCl3是共价化合物,AlCl3晶体是分子晶体。 (5)含有阴离子的晶体中一定含有阳离子,含有阳离子的晶体中不一定含有阴离子。如金属晶体中含有金属阳离子,但不含阴离子。 (6)离子晶体中不一定含有金属阳离子。如NH4Cl中含有的阳离子是NH。 (7)离子晶体中除含离子键外,可能含有其他化学键。如Na2O2中除含离子键外,还含有非极性键。 (8)分子晶体中不一定存在共价键。如He、Ne、Ar等稀有气体晶体中就不存在共价键。 (9)原子晶体的熔点不一定比离子晶体的熔点高。如SiO2的熔点(1 710 ℃)低于MgO的熔点(2 852 ℃)。 【例2】 (1)分析下列物质的物理性质,判断其晶体类型: A.碳化铝,黄色晶体,熔点2 200 ℃,熔融态不导电________; B.溴化铝,无色晶体,熔点98 ℃,熔融态不导电________; C.五氟化钒,无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮中________; D.溴化钾,无色晶体,熔融时或溶于水中都能导电________。 (2)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为________。 (3)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为________。 【解析】 (1)晶体的熔点高低、熔融态能否导电及溶解性等性质相结合,是判断晶体类型的重要依据。原子晶体和离子晶体的熔点都很高或较高,两者最大的差异是熔融态的导电性不同。原子晶体熔融态不导电,离子晶体熔融时或其水溶液都能导电。原子晶体和分子晶体的区别则主要在于熔、沸点有很大差异。一般原子晶体和分子晶体熔融态时都不能导电。另外易溶于一些有机溶剂的物质往往也是分子晶体的特征之一。(2)根据题目中的信息知,FeCl3的熔、沸点低,易溶于水等,它符合分子晶体的特征。(3)此处考查晶胞的数法,面心立方中铁原子个数为8×+6×=4个,体心立方中铁原子个数为8×+1=2个,即两晶胞中实际含有的铁原子个数之比为21。 【答案】 (1)原子晶体 分子晶体 分子晶体 离子晶体 (2)分子晶体 (3)21 三、晶体熔、沸点高低的比较规律 物质熔、沸点的高低与构成该物质的晶体类型及晶体内部粒子间的作用力有关,其规律如下: 1.不同状态物质熔、沸点的比较规律 在相同条件下,不同状态物质的熔、沸点的高低是不同的,一般有固体>液体>气体。如NaBr(固)>Br2(液)>HBr(气)。 2.不同类型晶体熔、沸点的比较规律 一般来说,不同类型晶体的熔、沸点的高低顺序为原子晶体>离子晶体>分子晶体,而金属晶体的熔、沸点有高有低。这是由于不同类型晶体的微粒间作用力不同,其熔、沸点也不相同。原子晶体间通过共价键结合,一般熔、沸点最高;离子晶体阴、阳离子间通过离子键结合,一般熔、沸点较高;分子晶体分子间通过范德华力结合,一般熔、沸点较低;金属晶体中金属键的键能有大有小,因而金属晶体熔、沸点有高(如W)有低(如Hg)。 3.同种类型晶体熔、沸点的比较规律 (1)原子晶体:熔、沸点的高低取决于共价键的键长和键能,键长越短,键能越大,共价键越稳定,物质的熔、沸点越高,反之越低。如晶体硅、金刚石和碳化硅三种晶体中,因键长C—C键查看更多