- 2021-04-15 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020_2021学年新教材高中化学第四章物质结构元素周期律1_2元素周期表课时作业含解析新人教版必修第一册
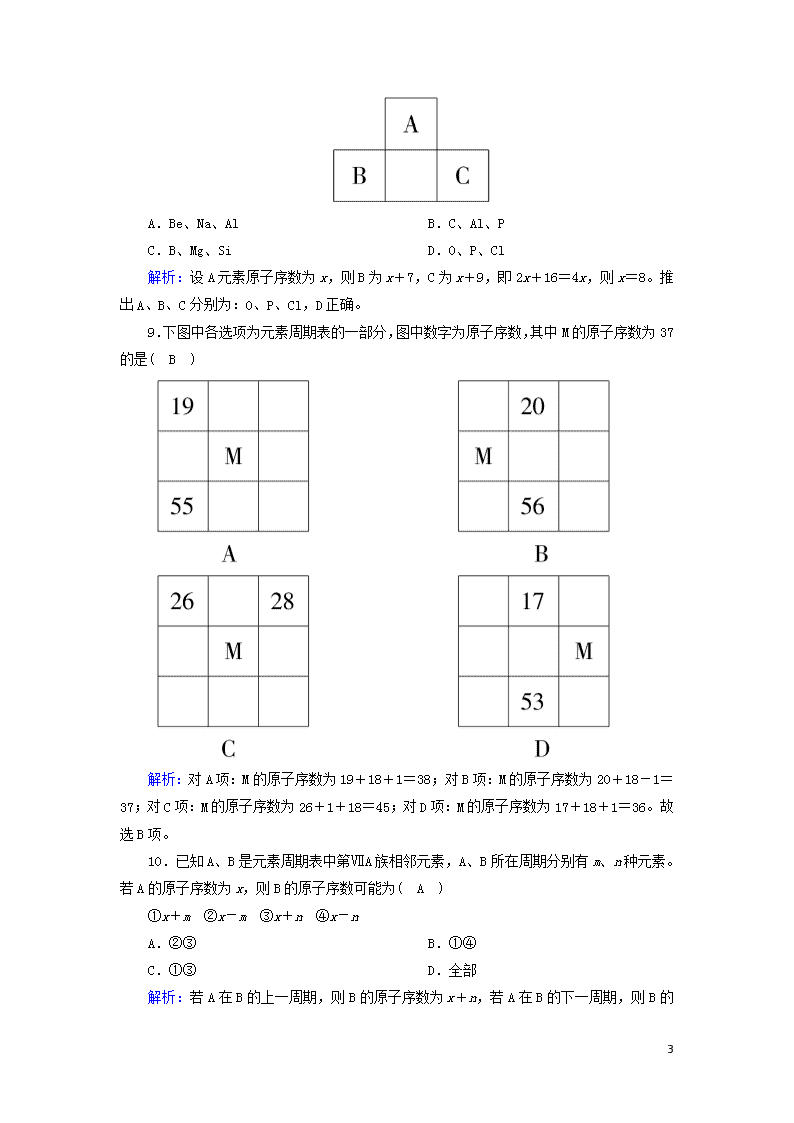
元素周期表 时间:45分钟 1.下列说法中,错误的是( A ) A.原子及其离子的核外电子层数等于该元素所在的周期序数 B.元素周期表中从第ⅢB族到第ⅡB族10个纵行的元素都是金属元素 C.除He外的稀有气体元素原子的最外层电子数都是8 D.第ⅡA族与第ⅢA族之间隔着10个纵行 解析:本题考查的是元素周期表的结构,应特别注意族的排列顺序。简单的阴离子如F-、Cl-及相应原子F、Cl的核外电子层数等于元素所在的周期序数,但像Na+、Mg2+、Al3+等阳离子的核外电子层数等于元素所在周期的上一周期的周期序数,A项错误;从第ⅢB族到第ⅡB族共10个纵行的元素全部都是金属元素,B项正确;除He的最外层有2个电子外,其他稀有气体元素原子的最外层电子数都是8,C项正确;第ⅡA族与第ⅢA族之间隔着7个副族和一个第Ⅷ族(3个纵行)共10个纵行,D项正确。 2.据报道,已发现了114号元素,下列有关其推测不正确的是( A ) A.它有+2,+3,+4价 B.其晶体有良好的导电性 C.其原子最外层上有4个电子 D.该元素位于第七周期ⅣA族 解析:第七周期稀有气体原子序数为118,则118-114=4,所以该元素位于第七周期118号元素前4纵行即ⅣA族。然后依元素周期律知该元素无+3价。 3.若把周期表原先的主、副族号取消,由左到右按原顺序编为18列。如碱金属为第1列,稀有气体为第18列,按这个规定,下列说法不正确的是( D ) A.计算机芯片的组成元素位于第14列 B.第10列元素全部是金属元素 C.第18列元素单质全部是气体 D.只有第2列元素的原子最外层有2个电子 解析:本题实际上考查了对元素周期表结构的掌握状况。芯片的组成元素为硅,位于ⅣA族,为第14列,A项正确;第10列为过渡金属,所以B项也正确;第18列元素为稀有气体元素,单质全部为气体,所以C项正确;D项中除第2列元素的原子最外层有2个电子外,其他如He、部分过渡金属元素最外层也是2个电子。 4.在元素周期表中有很多的规律与特点,下列说法不正确的是( C ) A.两种不同的元素不可能既在同一周期,又在同一主族 B.元素周期表中的元素不全是从自然界中发现的 6 C.周期表中1~20号元素,含有非金属11种 D.若周期表中第8周期完全填满,此周期应含有50种元素 解析:在同一周期,又在同一主族只有同一元素,A正确;周期表中有些元素是人工得到的,如一些放射性元素,B正确;周期表中1~20号元素,含有非金属13种,C错误;若周期表中第8周期完全填满,此周期应含有50种元素,D正确。 5.下列说法中正确的是( D ) A.元素周期表是按相对原子质量逐渐增大的顺序从左到右排列的 B.最外层电子数相同的元素一定属于同一族 C.非金属元素的最外层电子数都大于等于4 D.同周期元素的电子层数相同 解析:元素周期表是按原子的核电荷数排列的;氦原子最外层电子数为2,排在0族而不是第ⅡA族;非金属元素H、He的最外层电子数都小于4。 6.下列说法中不正确的是( C ) A.已知原子的核电荷数,可以推知该原子的周期序数 B.原子的电子层数等于该原子的周期序数,前20号元素中,阳离子的电子层数等于对应原子的周期序数减去1,阴离子的电子层数等于对应原子的周期序数 C.知道原子的周期序数,就能确定该元素在周期表中的位置 D.知道原子的周期序数,还不能确定该元素在周期表中的位置 解析:已知原子的核电荷数,根据核外电子排布的一般规律,可以画出该原子的结构示意图,就会知道该原子的电子层数,而周期序数=电子层数,选项A正确。原子失去电子后成为阳离子,电子层数比原子少1层;原子得到电子后成为阴离子,电子层数与原子的相同,选项B正确。知道原子的周期序数,只知道该元素的原子处于周期表中的第几个横行,即第几周期,但不知道处于第几个纵行,所以还不能确定该元素在周期表中的位置,选项C错误,选项D正确。 7.下列各项表述中正确的一组是( D ) 选项 A B C D 原子序数 7 9 12 16 元素符号 N F Al S 周期 二 三 三 三 族 ⅣA ⅦA ⅡA ⅥA 解析:7号元素为N,位于第二周期第ⅤA族,A项错误。9号元素为F,位于第二周期第ⅦA族,B项错误。12号元素为Mg,位于第三周期第ⅡA族,C项错误。D项正确。 8.短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素原子序数的4倍,则A、B、C依次是( D ) 6 A.Be、Na、Al B.C、Al、P C.B、Mg、Si D.O、P、Cl 解析:设A元素原子序数为x,则B为x+7,C为x+9,即2x+16=4x,则x=8。推出A、B、C分别为:O、P、Cl,D正确。 9.下图中各选项为元素周期表的一部分,图中数字为原子序数,其中M的原子序数为37的是( B ) 解析:对A项:M的原子序数为19+18+1=38;对B项:M的原子序数为20+18-1=37;对C项:M的原子序数为26+1+18=45;对D项:M的原子序数为17+18+1=36。故选B项。 10.已知A、B是元素周期表中第ⅦA族相邻元素,A、B所在周期分别有m、n种元素。若A的原子序数为x,则B的原子序数可能为( A ) ①x+m ②x-m ③x+n ④x-n A.②③ B.①④ C.①③ D.全部 解析:若A在B的上一周期,则B的原子序数为x+n 6 ,若A在B的下一周期,则B的原子序数为x-m。 11.如果n为第ⅡA族中某元素的原子序数,则原子序数为(n+1)的元素位于( C ) ①ⅢA ②ⅣA ③ⅢB ④ⅠA A.① B.①④ C.①③ D.③ 解析:第ⅡA族后面的族既可能是第ⅢB族,也可能是第ⅢA族。 12.下列说法正确的是( B ) A.原子序数之差为2的两种元素不可能位于同一主族 B.D-核外有36个电子,则元素D位于第4周期第ⅦA族 C.位于同一主族的甲、乙两种元素,甲的原子序数为x,则乙的原子序数可能为x+4 D.位于同一周期的甲乙两种元素,甲位于第ⅠA族,原子序数为x,乙位于第ⅢA族,则乙原子序数可能为x+19 解析:1~7周期分别含有2、8、8、18、18、32、32(排满时)种元素,同一主族两种元素的原子序数的差值是上列数值或连续几个数值之和,故A、C错误;简单阴离子的核外电子与同周期的稀有气体相同,D-核外有36个电子,即与第4周期的0族元素Kr处于同一周期,且D比Kr少一个电子,即在第ⅦA族,B正确;同一周期的ⅠA和ⅢA族的元素的原子序数之差分为三种情况:①第2、3周期为2,②第4、5周期为2+10,③第6、7周期为2+24,D错误。 13.元素周期表是学习和研究化学的重要工具。下列是元素周期表的部分信息: (1)地壳中含量最多的金属元素的原子序数是13。 (2)分析上表规律,可推知,表中X为16S。 (3)表示的是(写粒子符号)K+。 6 (4)写出一个由1、7、17号三种元素组成的化合物的化学式:NH4Cl。 解析:(1)地壳中含量最多的金属元素是Al,其原子序数为13; (2)由元素周期表的规律可推知X应为16S; (3)19号元素为K,核外电子数比核电荷数少1,为K+; (4)1号元素为H,7号元素为N,17号元素为Cl,组成的常见化合物为NH4Cl。 14.A、B、C为短周期元素,在周期表中所处的位置如图所示,已知A、C两元素的原子核外电子数之和等于B原子的质子数。 (1)写出A、B、C三种元素的名称:A氮;B硫;C氟。 (2)B元素位于周期表第三周期ⅥA族。 (3)C原子的结构示意图为。 解析:由A、B、C均为短周期元素及A、B、C的相对位置,可知A、C位于第二周期,B位于第三周期,设B元素的质子数为b,则A、C原子的核外电子数分别为b-9,b-7。依题意,有:b-9+b-7=b,解得b=16。因此,元素B是硫,则A是氮,C是氟。 15.根据下表回答问题。 (1)属于主族元素的纵行是A、B、M、N、O、P、Q(填字母)。 (2)K、L分别属于第ⅠB族、第ⅡB族。 (3)第Ⅷ族元素为H、I、J(填字母)纵行。 (4)S所在的格内包括15种元素,称为镧系元素。 (5)请在表中将过渡元素区用粗线框出。 6 答案: 解析:(1)第ⅠA族~ⅦA族所处的纵行分别为A、B、M、N、O、P、Q。(2)K、L分别位于元素周期表中的第ⅠB族和第ⅡB族。(3)元素周期表中第8、9、10(即H、I、J)三个 纵行统称为第Ⅷ族。(4)S所在的格内包括15种元素,称为镧系元素。(5)第3~12纵行为过渡元素。 16.有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1 mol E单质与足量酸作用,在标准状况下能产生33.6 L H2;E的阳离子与A的阴离子核外电子层结构完全相同。请回答下列问题: (1)写出五种元素的名称:A氧,B磷,C硫,D氯,E铝。 (2)B单质在D单质中燃烧,反应现象是产生白烟,生成物的化学式为PCl3、PCl5。 (3)A与E形成的化合物的化学式是Al2O3,它的性质决定了它在物质的分类中应属于两性氧化物。 (4)向D与E形成的化合物的水溶液中滴入烧碱溶液直至再无明显现象发生时,观察到的现象是先有白色胶状沉淀产生并逐渐增多,随着烧碱溶液的继续加入又逐渐溶解,最终变为澄清,有关反应的离子方程式为Al3++3OH-===Al(OH)3↓,Al(OH)3+OH-===AlO+2H2O。 解析:已知A、B、C、D四种元素原子核外共有56个电子,根据在周期表中的位置可设C的原子序数为x,则A的原子序数为x-8、B的原子序数为x-1、D的原子序数为x+1,可得x+(x+1)+(x-1)+(x-8)=56,x=16,即C是硫元素,进而可推出A是氧元素、B是磷元素,D是氯元素。由题意知E是铝元素。 6查看更多