- 2021-04-14 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学大一轮复习专题12实验化学加试要求第3单元化学实验原理的探究及反应条件的控制教师用书
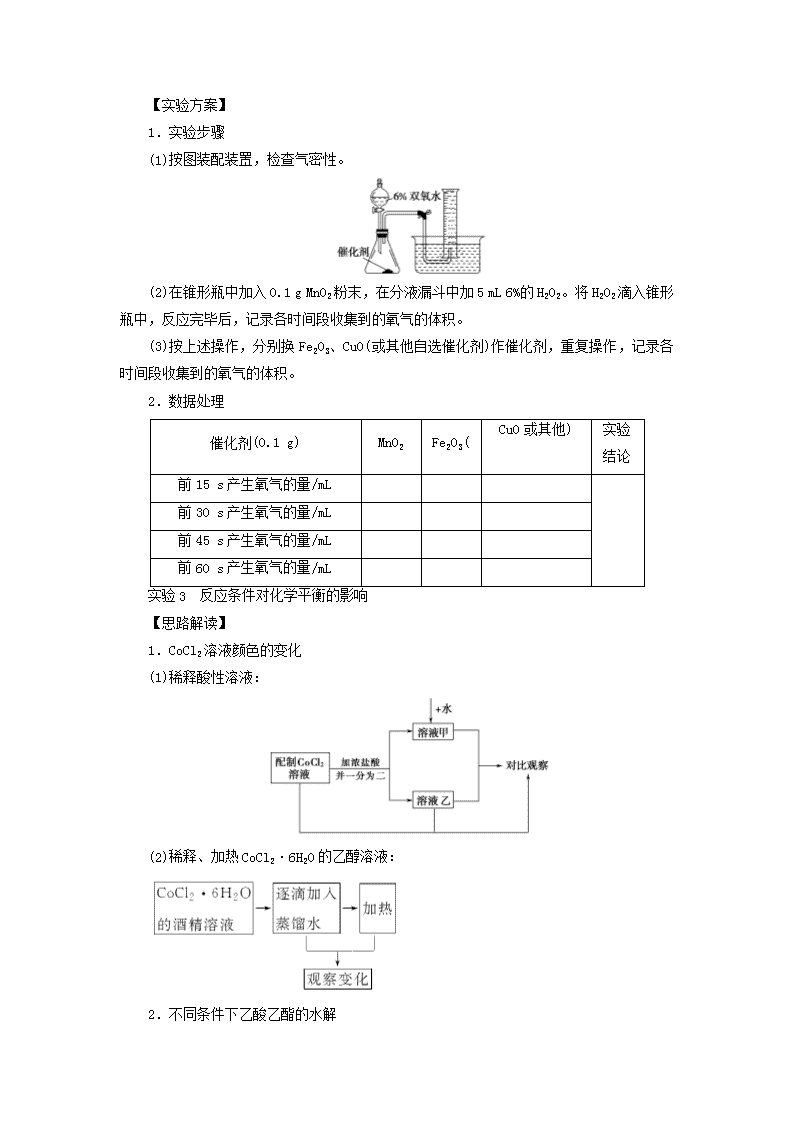
第三单元 化学实验原理的探究及反应条件的控制 浙江考 试标准 知识条目 必考要 求 加试要 求 1.硫代硫 酸钠与酸 反应速率 的影响因 素 (1)硫代硫酸钠和强酸反应的原理及实验现象 b (2)浓度、温度对硫代硫酸钠与酸反应速率的影 响 c 2.催化剂 对过氧化 氢分解反 应速率的 影响 3.反应条 件对化学 平衡的影 响 (1)不同的催化剂对同一反应的催化效果 c (2)变量控制在实验研究中的应用 c (1)氯化钴溶液的变色原理 b (2)浓度、温度变化对氯化钴溶液平衡体系的影 响 b (3)不同条件下(酸、碱性)乙酸乙酯水解的速率 和程度 b [实验过程透析] 实验 1 硫代硫酸钠与酸反应速率的影响因素 【思路解读】 【实验用品】 仪器:50 mL 锥形瓶(3 个)、烧杯、试管、温度计、白纸、计时器。 试剂:0.1 mol/L Na2S2O3 溶液、0.1 mol/L H2SO4 溶液、蒸馏水、热水。 【实验方案】 1.探究浓度对化学反应速率的影响 2.探究温度对化学反应速率的影响 实验 2 催化剂对过氧化氢分解反应速率的影响 【实验用品】 仪器:托盘天平、药匙、锥形瓶、双孔橡胶塞、导管、螺旋夹、水槽、量筒、计时器、 分液漏斗。 试剂:6% H2O2 溶液、MnO2、Fe2O3、蒸馏水、其他可作催化剂的物质(自选)。 【实验方案】 1.实验步骤 (1)按图装配装置,检查气密性。 (2)在锥形瓶中加入 0.1 g MnO2 粉末,在分液漏斗中加 5 mL 6%的 H2O2。将 H2O2 滴入锥形 瓶中,反应完毕后,记录各时间段收集到的氧气的体积。 (3)按上述操作,分别换 Fe2O3、CuO(或其他自选催化剂)作催化剂,重复操作,记录各 时间段收集到的氧气的体积。 2.数据处理 催化剂(0.1 g) MnO2 Fe2O3( CuO 或其他) 实验 结论 前 15 s 产生氧气的量/mL 前 30 s 产生氧气的量/mL 前 45 s 产生氧气的量/mL 前 60 s 产生氧气的量/mL 实验 3 反应条件对化学平衡的影响 【思路解读】 1.CoCl2 溶液颜色的变化 (1)稀释酸性溶液: (2)稀释、加热 CoCl2·6H2O 的乙醇溶液: 2.不同条件下乙酸乙酯的水解 【实验用品】 仪器:试管、酒精灯、烧杯、三脚架、石棉网、药匙、试管夹、火柴、温度计。 试剂:0.5 mol·L-1 CoCl2 溶液、浓盐酸、蒸馏水、95%乙醇溶液、CoCl2·6H2O 晶体、2 mol·L-1 H2SO4 溶液、4 mol·L-1 NaOH 溶液、甲基橙指示剂、石蕊溶液、乙酸乙酯。 【实验方案】 1.稀释酸性氯化钴溶液时的颜色变化 实验步骤 实验现象 结论与解释 慢慢滴入浓盐酸时,溶 液由粉红色→紫色→ 蓝紫色→蓝色 滴入浓盐酸时,Cl-浓度逐渐增 大,平衡向生成[CoCl4]2-的方 向移动 加水稀释时,溶液颜色 由蓝色→蓝紫色→紫 色→粉红色 加蒸馏水时,平衡向生成 [Co(H2O)6]2+的方向移动 2.稀释、加热 CoCl2·6H2O 溶液时的颜色变化 3.不同条件下乙酸乙酯的水解 续表 实验现象 三支试管都产生分层现象。下层 是水溶液,分别显橙、红和蓝色 试管 1 无明显变化,试 管 2、3 中油层减小, 试管 3 中油层减小幅 度较大 结论与解释 乙酸乙酯不溶于水,密度比水 小,浮于水面。甲基橙在水和酸 中分别呈现橙色和红色,石蕊在 碱溶液中呈蓝色 无酸、碱作催化剂时, 乙酸乙酯的水解很慢, 酸、碱性条件可促进水 解平衡朝正反应方向 移动 【知识秒记】 氯化钴溶液的变色原理 [核心要点提升] 1.外界条件对化学反应速率的影响 (1)内因 反应物本身的性质是主要因素。如相同条件下 Mg、Al 与稀盐酸反应的速率大小关系为 Mg>Al。 (2)外因(只改变一个条件,其他条件不变) (3)活化分子、有效碰撞与反应速率的关系 2.外界因素对化学平衡的影响 勒夏特列原理:如果改变影响化学平衡的条件之一(如温度、压强,以及参加反应的化 学物质的浓度),平衡将向着能够减弱这种改变的方向移动。 3.化学反应速率的测定 (1)测定步骤 (2)测定方法 化学反应速率的测定依据是与反应体系中任何一种化学物质的浓度(或质量)相关的性 质的变化,常见的方法有: ①根据颜色变化 在溶液中,当反应物或生成物本身有较明显的颜色时,人们常利用颜色深浅和显色物质 的浓度的正比关系来跟踪反应的过程和测量反应速率。 ②依据释放出的气体的体积 安装如图所示的两套装置 A、B(锌粒大小相同)通过分液漏斗分别加入 40 mL 1 mol·L -1 和 40 mL 4 mol·L-1 的硫酸后都立即产生气泡,我们可以根据产生相同体积的氢气所需要 的时间长短来判断 A、B 两套装置的反应速率大小。 4.气体的收集与气体体积的测量 (1)气体的收集 (2)气体体积的测量方法 ①间接测量法 注意事项:实验前广口瓶要充满水;短管进气,长管(插入到瓶底)出水;气体与水不反 应且难溶。 ②直接测量法 (3)气体体积的规范读数 ①视线:指出视线、刻度线和凹液面要在同一水平线上。 ②读数:读取与凹液面最低点相切的刻度线的数据。 [典型例题讲解] 碘在科研与生活中有重要应用。某兴趣小组用 0.50 mol·L-1KI、0.2% 淀粉溶液、0.20 mol·L-1K2S2O8、0.10 mol·L-1Na2S2O3 等试剂,探究反应条件对化学反应速 率的影响。 已知:S2O2- 8 +2I-===2SO2- 4 +I2 (慢) I2+2S2O2- 3 ===2I-+S4O2- 6 (快) (1)向 KI、Na2S2O3 与淀粉的混合溶液中加入一定量的 K2S2O8 溶液,当溶液中的________ 耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色,S2O 2- 3 与 S2O 2- 8 初始的物质的量 需满足的关系为 n(S2O2- 3 )∶n(S2O2- 8 )________。 (2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表: 其中 Vx=________mL,理由是___________________________________。 (3)已知某条件下,浓度 c(S2O2- 8 )~反应时间 t 的变化曲线如图所示,若保持其他条件 不变,请在坐标图中,分别画出降低反应温度和加入催化剂时 c(S2O2- 8 )~t 的变化曲线示意 图(进行相应的标注)。 【解析】 (1)淀粉溶液遇 I2 显蓝色,溶液由无色变为蓝色时,溶液中有 I2,说明 Na2S2O3 消耗尽。由题给离子反应可得关系式:S2O2- 8 ~I2~2S2O2- 3 ,则有 n(S2O2- 3 )∶n(S2O2- 8 )<2∶1 时, 能观察到蓝色。 (2)实验的目的是探究 K2S2O8 溶液的浓度对化学反应速率的影响,故应保证每组实验中 其他物质的浓度相等,即溶液的总体积相等(即为 20.0 mL),从而可知 Vx=2.0。 (3)降低温度时,化学反应速率减慢,c(S2O2- 8 )变化减慢;加入催化剂时,化学反应速率 加快,c(S2O2- 8 )变化加快;c(S2O2- 8 )~t 的变化曲线如图所示。 【答案】 (1)Na2S2O3 <2 (2)2.0 保证反应物 K2S2O8 的浓度改变,而其他物质的浓 度不变 (3) 1.变量探究实验题的解题策略 解答变量探究类试题关键是在其他条件相同的前提下,只改变一个条件对研究对象的影 响规律。注意:选择数据要有效,且变量统一,否则无法作出正确判断。 思路总结 2.规律探究实验题的解题策略 物质性质递变规律的探究也是中学化学实验探究的一个重要内容。研究同周期、同主族 元素性质的递变规律,物质的氧化还原反应(如置换反应)规律,物质的酸(碱)性强弱规律, 电解质溶液的导电规律等,都是开展有关规律探究的重要素材,也是高考命题的经典情境。 解决有关规律探究问题的实验设计,其常用方法示例如下: (1)同周期、同主族元素性质的递变规律,一般通过设计判断元素金属性、非金属性的 强弱实验来完成,如通过让金属单质与相同浓度的非氧化性酸反应产生 H2 的速率快慢来判 断金属单质的还原性强弱,推断元素金属性强弱,从而找出相应的性质递变规律。 (2)物质的酸(碱)性强弱的判断。 (3)钢铁发生电化学腐蚀的规律探究。可以通过控制所含的杂质是否与空气接触、所接 触的电解质溶液的酸碱度、钢铁在腐蚀过程中体系内的气体变化等角度设计实验,找出规律。 工业上从废铅蓄电池的铅膏回收铅的过程中,可用碳酸盐溶液与处理 后的铅膏(主要成分为 PbSO4)发生反应:PbSO4(s)+CO2- 3 (aq) PbCO3(s)+SO2- 4 (aq)。某课 题组用 PbSO4 为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。 【导学号:81640211】 (1)上述反应的平衡常数表达式:K=________。 (2)室温时,向两份相同的 PbSO4 样品中分别加入同体积、同浓度的 Na2CO3 和 NaHCO3 溶 液均可实现上述转化,在________溶液中 PbSO4 转化率较大,理由是 ________________________________________________。 (3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3·Pb(OH)2],它和 PbCO3 受热都 易分解生成 PbO。该课题组对固体产物(不考虑 PbSO4)的成分提出如下假设,请你完成假设 二和假设三: 假设一:全部为 PbCO3; 假设二:________________________________________________; 假设三:________________________________________________。 (4)为验证假设一是否成立,课题组进行如下研究。 ①定性研究:请你完成下表中内容。 实验步骤(不要求写出具体操作过程) 预期的实验现象和结论 取一定量样品充分干燥,________ ②定量研究:取 26.7 mg 的干燥样品,加热,测得固体质量随温度的变化关系如下图。 某同学由图中信息得出结论:假设一不成立。你是否同意该同学的结论,并简述理由: ____________________________________。 【解析】 (1)根据 PbSO4(s) +CO2- 3 (aq) PbCO3(s)+SO2- 4 (aq)知,化学平衡常数表 达式为 K=c SO2- 4 c CO2- 3 。(2)Na2CO3 溶液中 c(CO2- 3 )较大,根据平衡移动原理,可知 Na2CO3 溶液 中 PbSO4 转化率较大。(3)根据题中信息,提出另外两种假设。假设二:全部为碱式碳酸铅 [2PbCO3·Pb(OH)2];假设三:为 PbCO3 和 2PbCO3·Pb(OH)2 的混合物。(4)①因为 PbCO3 受热 分解不产生水,而 2PbCO3·Pb(OH)2 受热分解产生水,所以可利用此不同设计实验方案。② 因为 PbCO3===== △ PbO+CO2↑,所以可以利用固体加热前后质量的改变量来确定结论。 【答案】 (1)c SO2- 4 c CO2- 3 (2) Na2CO3 Na2CO3 溶液中的 c(CO2- 3 )大 (3)全部为 2PbCO3·Pb(OH)2 为 PbCO3 和 2PbCO3·Pb(OH)2 的混合物 (4)① 实验步骤(不要求写出具体操作过程) 预期的实验现象和结论 充分加热样品,将产生的气体通入盛有无水硫酸 铜的干燥管 若无水硫酸铜不变蓝,则假设一成立; 若无水硫酸铜变蓝,则假设一不成立 ②同意,若全部为 PbCO3 时,26.7 mg 完全分解后最终固体质量应为 22.3 mg(或:不同 意,实验最终得到固体的质量与全部为 PbCO3 分解所得固体质量相差不大,可能是实验过程 中产生的误差引起的)(本题属于开放性试题,合理答案均可) 猜想型实验题的思维流程 [题组对点训练] 1.漂白粉是生产生活中常用的消毒剂和杀菌剂。 实验室有一瓶密封不严的漂白粉样品,其中肯定存在 CaCl2,请设计实验,探究该样品 中可能存在的其他固体物质。 (1)提出合理假设。 假设 1:该漂白粉未变质,只含有________; 假设 2:该漂白粉全部变质,只含有________; 假设 3:该漂白粉部分变质,既含有________,又含________。 (2)设计实验方案,进行实验。请写出实验步骤、预期现象和结论。 限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、1 mol·L-1 盐酸、品红溶液、新制澄清石灰水。(提示:不必检验 Ca2+和 Cl-) 实验步骤 预期现象和结论 ① 取少量上述漂白粉于试管中,________ ② 【答案】 (1)Ca(ClO)2 CaCO3 Ca(ClO)2 CaCO3 (2) ① 加入适量 1 mol·L-1 盐酸溶 解后,再将产生的气体通入澄 清石灰水中 若澄清石灰水未变浑浊,则假 设 1 成立; 若澄清石灰水变浑浊,则假设 2 或假设 3 成立 ② 向步骤①反应后的试管中滴 入 1~2 滴品红溶液,振荡(或 另外取样操作) 若品红溶液褪色,则假设 1 或 假设 3 成立;若品红溶液不褪 色,则假设 2 成立 2.某研究小组将纯净的 SO2 气体通入 0.1 mol·L-1 的 Ba(NO3)2 溶液中,得到了 BaSO4 沉 淀。为探究上述溶液中何种微粒能氧化通入的 SO2,该小组提出了如下假设: 假设一:溶液中的 NO- 3 假设二:溶液中溶解的 O2 (1)验证假设一 该小组设计实验验证假设一,请在下表空白处填写相关实验现象。 (2)为深入研究该反应,该小组还测得上述两个实验中溶液 pH 随通入 SO2 体积的变化曲 线如图。 实验 1 中溶液 pH 变小的原因是_____________________________; V1 时,实验 2 中溶液 pH 小于实验 1 的原因是(用离子方程式表示)________。 (3)验证假设二 请设计实验验证假设二,写出实验步骤、预期现象和结论。 实验步骤、预期现象和结论(不要求写具体操作过程): (4)若假设二成立,请预测:在相同条件下,分别用足量的 O2 和 KNO3 氧化相同的 H2SO3 溶液(溶液体积变化忽略不计),充分反应后两溶液的 pH 前者________(填“大于”或“小 于”)后者,理由是___________________。 【解析】 (1)实验 1 中溶液和实验 2 中溶液的唯一区别就是一个含有 Cl-,一个含有 NO- 3 ,故可通过实验 1 未生成白色沉淀,而实验 2 生成白色沉淀来证明假设一正确。 (2)SO2 溶于水得到中强酸 H2SO3,故使得溶液的 pH 减小。在实验 2 中,NO - 3 将 SO2 氧化成 SO2- 4 ,自身被还原为 NO,同时有 H+生成,故溶液 pH 减小。 (3)在验证假设二时,应使用不含 NO - 3 的钡盐,如 BaCl2,可以向含有 O2 的 BaCl2 溶液中 缓慢通入 SO2,若有白色沉淀生成,则证明假设二成立。 (4)O2 和 KNO3 分别与 H2SO3 反应的离子方程式为 O2 +2H2SO3===4H + +2SO 2- 4 、3H2SO3 + 2NO- 3 ===3SO2- 4 +4H++2NO↑+H2O,故被 O2 氧化后溶液的 pH 小。 【答案】 (1)无明显现象 有白色沉淀 (2)SO2 溶于水生成 H2SO3 3SO2 +2NO- 3 + 2H2O===3SO2- 4 +2NO+4H+(或 3H2SO3+2NO- 3 ===3SO2- 4 +4H++2NO↑+H2O) (3)实验 1 作为参照实验 实验 3:将纯净的 SO2 气体缓慢通入未经脱 O2 处理的 25 mL 0.1 mol·L-1BaCl2 溶液中, 若有白色沉淀,表明假设二成立,否则不成立 (4)小于 反应的离子方程式表明,足量的 O2 和 NO - 3 分别氧化相同的 H2SO3,生成 H+的 物质的量前者多于后者(本题部分小题属于开放性题,答案合理即可) 3.已知亚硫酸钠在空气中能被氧气氧化生成硫酸盐。 Ⅰ.甲同学设计两种方案来检验 Na2SO3 溶液是否发生变质。 【导学号:81640212】 方案一:取样,加入稀盐酸有气泡生成,认为亚硫酸钠溶液没有变质。 方案二:取样,加入氯化钡溶液有白色沉淀生成,认为亚硫酸钠溶液完全变质。 请你对两方案作出评价: 方案一:________(填“合理”或“不合理”),理由是______________。 方案二:________(填“合理”或“不合理”),理由是____________。 Ⅱ.乙同学探究 Na2SO3 溶液是否发生变质,设计如下实验测定 1.0 mol·L-1Na2SO3 溶液的 实际浓度。 (1)分液漏斗中应加入足量的下列哪种试剂?________(填字母)。 a.浓硝酸 b.65%硫酸 c.浓盐酸 (2)实验前后测得 C 装置增重 3.2 g,则 Na2SO3 溶液实际的物质的量浓度为__。 (3)该实验装置还存在一个明显的缺陷是________________________。 【解析】 Ⅰ.加入稀盐酸有气泡生成,证明溶液中含有亚硫酸钠,Na2SO3 可能没有变 质,也可能有部分变质。亚硫酸钠、硫酸钠都能与氯化钡反应生成沉淀,故亚硫酸钠溶液未 变质、部分变质、全部变质时的现象相同,都会生成白色沉淀。Ⅱ.制备二氧化硫气体选用 硫酸。C 装置增重 3.2 g,产生的 n(SO2)=0.05 mol,所以 n(Na2SO3)=0.05 mol,c(Na2SO3) =0.05 mol÷0.06 L≈0.83 mol·L-1。该实验装置中一个明显的缺陷是缺少一个驱赶残留 二氧化硫气体的装置。 【答案】 Ⅰ.不合理 亚硫酸钠部分变质时加入稀盐酸也会产生气泡 不合理 亚硫 酸钠也能与氯化钡反应生成白色沉淀,亚硫酸钠未变质或部分变质时也会产生白色沉淀 Ⅱ.(1)b (2)0.83 mol·L-1 (3)缺少一个驱赶残留二氧化硫气体的装置(或其他合理答案) 4.某化学兴趣小组欲证明氧化铜也能加快氯酸钾的分解,并与二氧化锰的催化效果进 行比较,用如图装置进行实验,实验时均以生成 25 mL 气体为准,其他可能影响实验的因素 均已忽略。相关数据见下表。 实验编号 KClO3 质量 其他物质质量 待测数据 A 1.2 g 无其他物质 B 1.2 g CuO 0.5 g 回答下列问题: (1)上述实验中的“待测数据”指____________________________; (2)根据实验目的,还需增加一个实验 C,请在下表空格中填入相关内容。 实验编号 KClO3 质量 其他物质质量 待测数据 C—— (3)该小组学生在连接好实验装置后,进行装置的气密性检查,先往 b 处加适量水,使 a、b 两边液面相平,然后在试管处用酒精灯加热,发现 b 处液面上升,移开酒精灯后冷却 到原温度,发现两边液面又相平,由此断定,该装置的气密性良好。 认为他们的操作可行吗?请说明理由________________________。 如何操作可检验该装置的气密性?_________________________。 【解析】 (1)已知在不同条件下生成 25 mL 气体,若判断反应速率的大小,还需测定 的数据显然是时间。 (2)为比较 CuO、MnO2 的催化效果,应在 B 组实验的基础上,将 0.5 g CuO 换为 0.5 g MnO2, KClO3 仍为 1.2 g。 (3)只有确保装置内气压不等于大气压并保持稳定一段时间,才能说明装置气密性良好。 【答案】 (1)时间 (2) 实验编号 KClO3 质量 其他物质质量 待测数据 C 1.2 g MnO2 0.5 g — (3)不可行,若装置的气密性不好时也会产生同样的现象 连好装置,通过量气管右侧 向里加水至两侧形成液面差,若液面差长时间保持不变,可说明该装置气密性良好查看更多