r
(阳离子)
逐渐增大
性质
化合价
最高正化合价由+1→+7(O、F除
外),最低负化合价=-(8-主族序数)
最高正化合价=主族序数(O、F除外)
元素的金属性和非金属性
金属性逐渐减弱
非金属性逐渐增强
(稀有气体元素除外)
金属性逐渐增强
非金属性逐渐减弱
离子的氧化性、还原性
阳离子氧化性逐渐增强
阴离子还原性逐渐减弱
阳离子氧化性逐渐减弱
阴离子还原性逐渐增强
气态氢化物稳定性
逐渐增强
逐渐减弱
最高价氧化物对应的水化物的酸
碱性
碱性逐渐减弱
酸性逐渐增强
碱性逐渐增强
酸性逐渐减弱
第一电离能
呈增大趋势(ⅡA、ⅤA族元素除外)
逐渐减小
电负性
逐渐增大
逐渐减小
3.元素周期表中的位置、结构、性质的关系
元素的原子结构决定了元素在周期表中的位置和元素的主要性质,元素在周期表中的位置反映了元素的原子结构和元素的主要性质,故三者之间可相互推断。
考向一 元素周期律及其应用
1.(2019山东德州期末)已知X、Y是同周期主族元素,且电负性:X>Y,下列说
法错误的是
(
B
)
A.位置关系:X在Y右侧
B.第一电离能:X一定大于Y
C.简单气态氢化物稳定性:X大于Y
D.最高价含氧酸的酸性:X强于Y
答案
B A项,X、Y是同周期主族元素,且电负性:X>Y,则原子序数:X>Y,即
X在Y右侧;B项,一般情况下,同一周期元素从左向右第一电离能逐渐增大,但
ⅡA、ⅤA族元素的第一电离能大于同周期相邻元素,则X的第一电离能不一
定大于Y;C项,非金属性:X>Y,则简单气态氢化物稳定性:X>Y;D项,元素的非
金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:X>Y,则最高价
含氧酸的酸性:X>Y。
2.(2019北京理综,8,6分)2019年是元素周期表发表150周年,期间科学家为完
善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟
(
49
In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(
37
Rb)同
周期。下列说法
不正确
的是
(
D
)
A.In是第五周期第ⅢA族元素
B
In的中子数与电子数的差值为17
C.原子半径:In>Al
D.碱性:In(OH)
3
>RbOH
答案
D 铟和铷同属第五周期元素,铷在ⅠA族,铟在ⅢA族,铷的金属性比
铟强,所以RbOH的碱性强于In(OH)
3
的碱性,D错误。
3.(2019天津理综,7节选)氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周
期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置
。
Mc的中子数为
。
已知:
P(s,白磷)
P(s,黑磷) Δ
H
=-39.3 kJ·mol
-1
;
P(s,白磷)
P(s,红磷) Δ
H
=-17.6 kJ·mol
-1
;
由此推知,其中最稳定的磷单质是
。
(2)氮和磷氢化物性质的比较:
热稳定性:NH
3
PH
3
(填“>”或“<”)。
沸点:N
2
H
4
P
2
H
4
(填“>”或“<”),判断依据是
。
(3)PH
3
和NH
3
与卤化氢的反应相似,产物的结构和性质也相似。下列对PH
3
与
HI反应产物的推断正确的是
(填序号)。
a.不能与NaOH反应
b.含离子键、共价键
c.能与水反应
答案
(1)第四周期第ⅤA族 173 黑磷
(2)> > N
2
H
4
分子间存在氢键
(3)b、c
解析
(1)质量数=质子数+中子数;结合已知信息,应用盖斯定律可推出P(s,红
磷)
P(s,黑磷) Δ
H
=-21.7 kJ·mol
-1
,放热反应中反应物总能量高于生成物
总能量,物质能量越低越稳定,故稳定性:白磷<红磷<黑磷。(2)非金属性:N>P,
故热稳定性:NH
3
>PH
3
;N
2
H
4
的结构式为
,分子间存在氢键,故
沸点:N
2
H
4
>P
2
H
4
。(3)NH
4
I可与NaOH反应;NH
4
I中既有离子键,又有共价键;
NH
4
I可发生水解反应,由NH
4
I的性质可推测PH
4
I的性质。
方法技巧
“三看”比较微粒半径大小
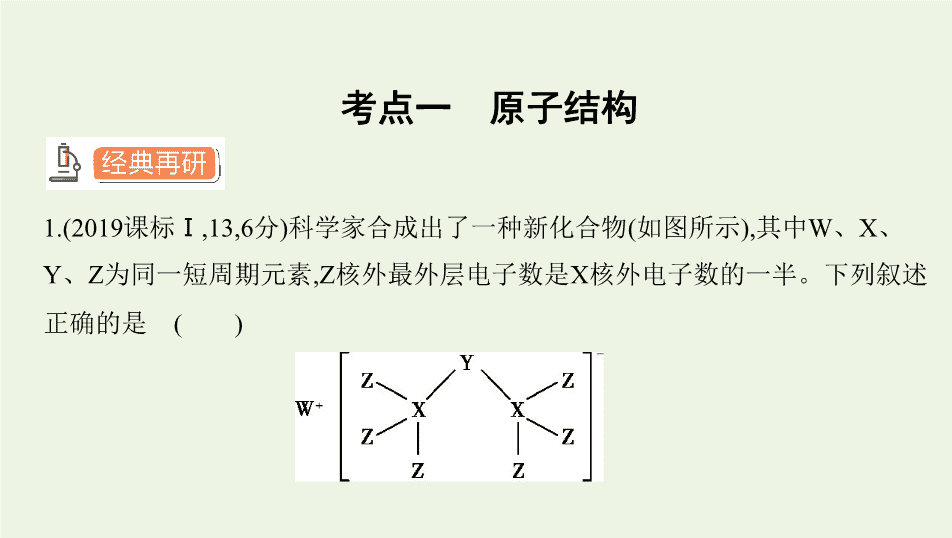
“一看”电子层数:当电子层数不同时,电子层数越多,半径越大。
例:
r
(Li)<
r
(Na)<
r
(K)<
r
(Rb)<
r
(Cs)
r
(O
2-
)<
r
(S
2-
)<
r
(Se
2-
)<
r
(Te
2-
)
r
(Na)>
r
(Na
+
)
“二看”核电荷数:当电子层数相同时,核电荷数越大,半径越小。
例:
r
(Na)>
r
(Mg)>
r
(Al)>
r
(Si)>
r
(P)>
r
(S)>
r
(Cl)
r
(O
2-
)>
r
(F
-
)>
r
(Na
+
)>
r
(Mg
2+
)>
r
(Al
3+
)
“三看”核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半
径越大。
例:
r
(Cl
-
)>
r
(Cl)
r
(Fe
2+
)>
r
(Fe
3+
)
考向二 周期表片段及其应用
4.(2019上海单科,15,2分)短周期元素m、n、p、q在元素周期表中的排序如
图所示,其中m的气态氢化物与其最高价氧化物对应的水化物能反应。下列
说法正确的是
(
C
)
A.非金属性:m>n
B.氢化物稳定性:nq
D.最高价氧化物对应水化物酸性:p>q
m
n
p
q
答案
C m的气态氢化物与其最高价氧化物对应的水化物能反应,即:NH
3
+
HNO
3
NH
4
NO
3
,则m为氮元素,再结合题给元素周期表结构片段可推知,n
为氧元素,p为硫元素,q为氯元素。A项,同周期主族元素从左到右,非金属性
逐渐增强,故非金属性:m(N)p(S);C项,电子层数目相同的阴离子,核电荷数越
大其离子半径越小,则离子半径:S
2-
>Cl
-
,即p>q;D项,元素非金属性越强,其最高
价氧化物对应水化物的酸性越强,由于非金属性:p(S)X
X
Y
Z
答案
A Q原子的最外层电子数是内层电子数的2倍,则Q为C;再根据Q、X、
Y、Z是原子序数依次增大的短周期主族元素,以及X、Y、Z在周期表中的位
置关系可推知X可能为N或O,Y可能为P或S,Z可能为S或Cl。若Z
为S,则
C、S可形成CS
2
,A项正确;若Y为P,则最高价氧化物的水化物(H
3
PO
4
)不是强酸,
B项错误;N、S和H三种元素可以形成离子化合物(NH
4
)
2
S,C项错误;若X为O,则
甲烷的沸点比水的低,D项错误。
6.(2019四川蓉城名校期中)如图所示的五种元素中,A、B、C、D为短周期元
素,这四种元素的原子最外层电子数之和为22,下列说法正确的是
(
C
)
A.应用高纯度单质A制成光导纤维,可提高信息传输速度
B.B、C、D三种元素的简单氢化物的沸点依次升高
C.由B、C和氢三种元素形成的化合物中可能含有离子键
D.E在元素周期表中的位置是第四周期第ⅣA族,简化电子排布式为[Ar]4s
2
4p
2
B
C
A
D
E
答案
C A、B、C、D为短周期元素,由A、B、C、D在周期表中的位置可
知A、D是第三周期元素,B、C是第二周期元素,令A原子的最外层电子数
是
x
,则B、C、D原子的最外层电子数分别是
x
+1、
x
+2、
x
+3,根据题意可列
式:
x
+
x
+1+
x
+2+
x
+3=22,解得
x
=4,所以A、B、C、D分别是Si、N、O、Cl,E是
Ge。A项,应用高纯度SiO
2
制成光导纤维,可提高信息传输速度;B项,B、C、D
三种元素的简单氢化物分别为NH
3
、H
2
O、HCl,其沸点从低到高的顺序为
HClC
B.热稳定性:A
2
D>AE
C.CA为离子化合物,溶于水所得溶液呈碱性
D.实验室制备AE时可选用D的最高价含氧酸
答案
B 短周期主族元素中原子半径最大的是钠元素(Na);化合物AE是常
见强酸,结合原子序数递增,可知A为氢元素(H)、E为氯元素(Cl);又A和D的质
子数之和等于E的核外电子数,则D为硫元素(S);因B和D同主族,则B为氧元素
(O)。B、C的简单离子分别是O
2-
、Na
+
,它们的电子排布相同,核电荷数较大
的Na
+
半径较小,A项正确;同周期主族元素,从左到右非金属性增强,氢化物的
稳定性增强,故氢化物热稳定性:H
2
SC
答案
C A项,A是地壳中含量最高的元素,即A为O;B为金属元素,它的原子
核外K、L层上电子数之和等于M、N层电子数之和,原子结构示意图应是
,即B为Ca;C在第三周期中第一电离能最小,D在第三周期中第一电
离能最大,根据同周期元素从左向右第一电离能有增大的趋势,推出C为Na,D
为Ar。B项,Ca、Na与O形成的化合物可能是CaO、CaO
2
、Na
2
O、Na
2
O
2
等。
C项,O形成的简单离子是O
2-
,Na形成的简单离子为Na
+
,电子层结构相同的微
粒半径随核电荷数的增加而减小,故离子半径为O
2-
>Na
+
。D项,Ca的第一电离
能大于Na的第一电离能。
素养引领·情境命题
1.短周期主族元素X、Y、Z、Q、R的原子序数依次增大,X的简单阴离子与
锂离子具有相同的电子层结构,Y原子最外层电子数等于内层电子数的2倍,Q
的单质与稀硫酸剧烈反应生成X的单质。向100 mL X
2
R的水溶液中缓缓通
入RZ
2
气体,溶液pH与RZ
2
体积关系如图。下列说法正确的是
( )
A.X
2
R溶液的浓度为0.03 mol·L
-1
B.最简单气态氢化物的稳定性:Y>Z>R
C.工业上通常采用电解法冶炼Q的单质
D.RZ
2
通入BaCl
2
、Ba(NO
3
)
2
溶液中,均无明显现象
答案
C X的简单阴离子与Li
+
具有相同的电子层结构,则X是氢元素;Y原子
最外层电子数等于内层电子数的2倍,Y为碳元素;Q为第三周期的活泼金属;
根据图像可知,R元素是硫元素。根据2H
2
S+SO
2
3S↓+2H
2
O可知,336 mL
SO
2
消耗的H
2
S的物质的量为0.03 mol,溶液体积为0.1 L,故H
2
S浓度为0.3 mol·
L
-1
,A项错误;非金属性越强,则气态氢化物越稳定,B项错误;Na、Mg、Al均通
过电解法制取,C项正确;SO
2
通入BaCl
2
溶液无明显现象,而通入Ba(NO
3
)
2
溶液
中,在酸性条件下N
将SO
2
氧化为S
,产生BaSO
4
沉淀,D项错误。
2.短周期元素X、Y、Z、M的原子序数依次增大,其中X、Y、Z三种元素中,
可形成含二种元素的10电子微粒m、n、p、q,且有反应m+n
p↑+q;M的
最高价氧化物对应的水化物为最强酸。则下列说法不正确是
(
C
)
A.简单离子半径Xf>g>h
B.由x、z、d三种元素形成的化合物中一定不含离子键
C.y、d、g的简单气态氢化物中沸点最高的是g的氢化物
D.装满zd
2
气体的小试管倒扣在水槽中充分反应,试管内液面上升约2/3
答案
D 由题意可知,x是H元素,y是C元素,z是N元素,d是O元素,f是Al元素,
e是Na元素,g是S元素,h是Cl元素。A项,离子半径:g>h>e>f,错误;B项,H、N、
O形成的硝酸铵中含有离子键,错误;C项,水分子之间存在氢键,所以y、d、g
的简单气态氢化物中沸点最高的是d(O)的氢化物,错误;D项,zd
2
气体为NO
2
,根
据反应方程式3NO
2
+H
2
O
2HNO
3
+NO可知,反应后试管内液面上升约
,
正确。