2020届高考化学二轮复习原子结构 元素周期律学案
原子结构 元素周期律
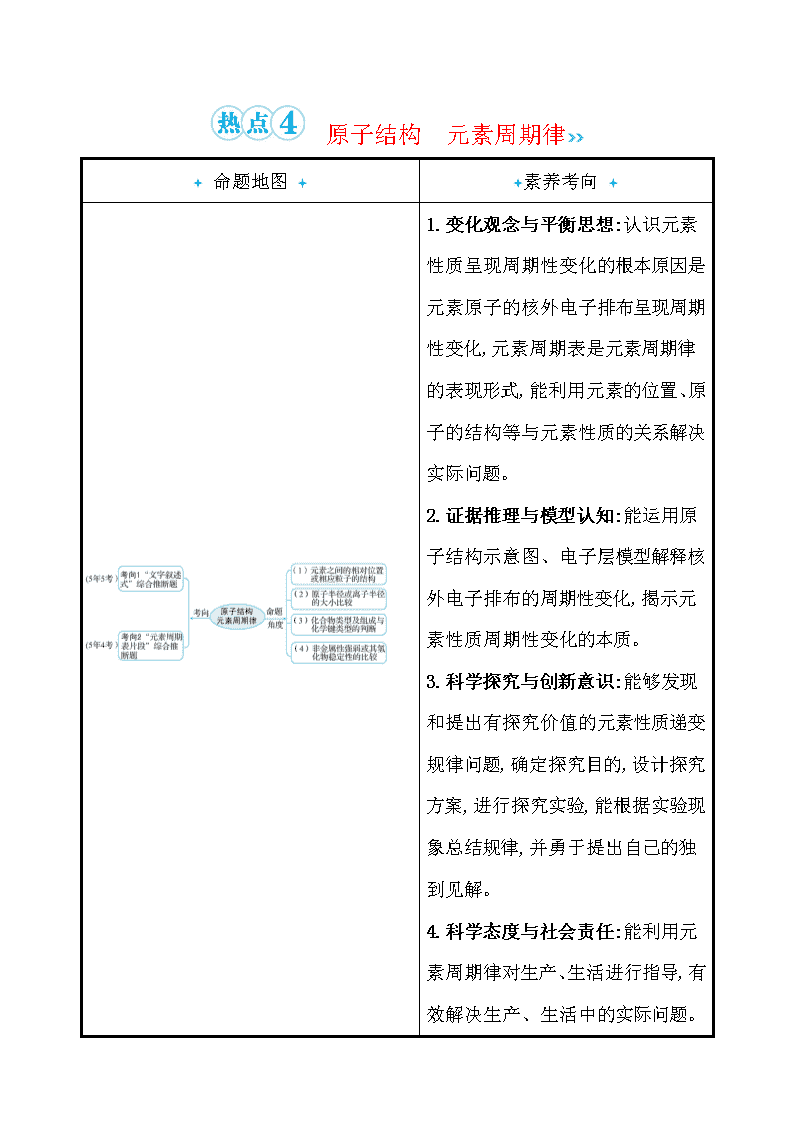
命题地图
素养考向
1.变化观念与平衡思想:认识元素性质呈现周期性变化的根本原因是元素原子的核外电子排布呈现周期性变化,元素周期表是元素周期律的表现形式,能利用元素的位置、原子的结构等与元素性质的关系解决实际问题。
2.证据推理与模型认知:能运用原子结构示意图、电子层模型解释核外电子排布的周期性变化,揭示元素性质周期性变化的本质。
3.科学探究与创新意识:能够发现和提出有探究价值的元素性质递变规律问题,确定探究目的,设计探究方案,进行探究实验,能根据实验现象总结规律,并勇于提出自己的独到见解。
4.科学态度与社会责任:能利用元素周期律对生产、生活进行指导,有效解决生产、生活中的实际问题。
考向1 “文字叙述式”综合推断题
【研磨真题·提升审题力】
真题再回访
破题关键点
专家话误区
(2019·全国卷Ⅲ·9)X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是 ( )
A.熔点:X的氧化物比Y的氧化物高
B.热稳定性:X的氢化物大于Z的氢化物
C.X与Z可形成离子化合物ZX
D.Y的单质与Z
【审题流程】
阅读题目→建立印象→分析题设条件→找到突破口→推断具体元素→分析选项→得出正确
【答题流程】
(1)审题找关键
①X与Z同族→二者最外层电子数相等。
② Y最外层电子数等于X次外层电子数→Y的最外层电子数为2。
(2)推断元素:X为碳元素,Y为镁元素,Z为硅元素。
(3)根据元素及其化合物的性质推断选项。
【一秒巧解】
X与Z同主族,
【思维误区】
(1)思维模糊。不能根据Y最外层电子数等于X次外层电子数推知Y的最外层电子数为2,导致无法确定元素。
(2)熔点大小比较的依据认识不足,易错选A选项。
【认知误区】
(1)同主族元素的递变规律认识不清,而不易判断出B选项。
(2)性质认知误区。分不清镁和硅与浓硝酸反应的情况,造成选择错误。
的单质均能溶于浓硝酸
同主族元素气态氢化物的稳定性从上到下依次减弱,速解得出选项B正确。
【答题要素·奠定考试力】
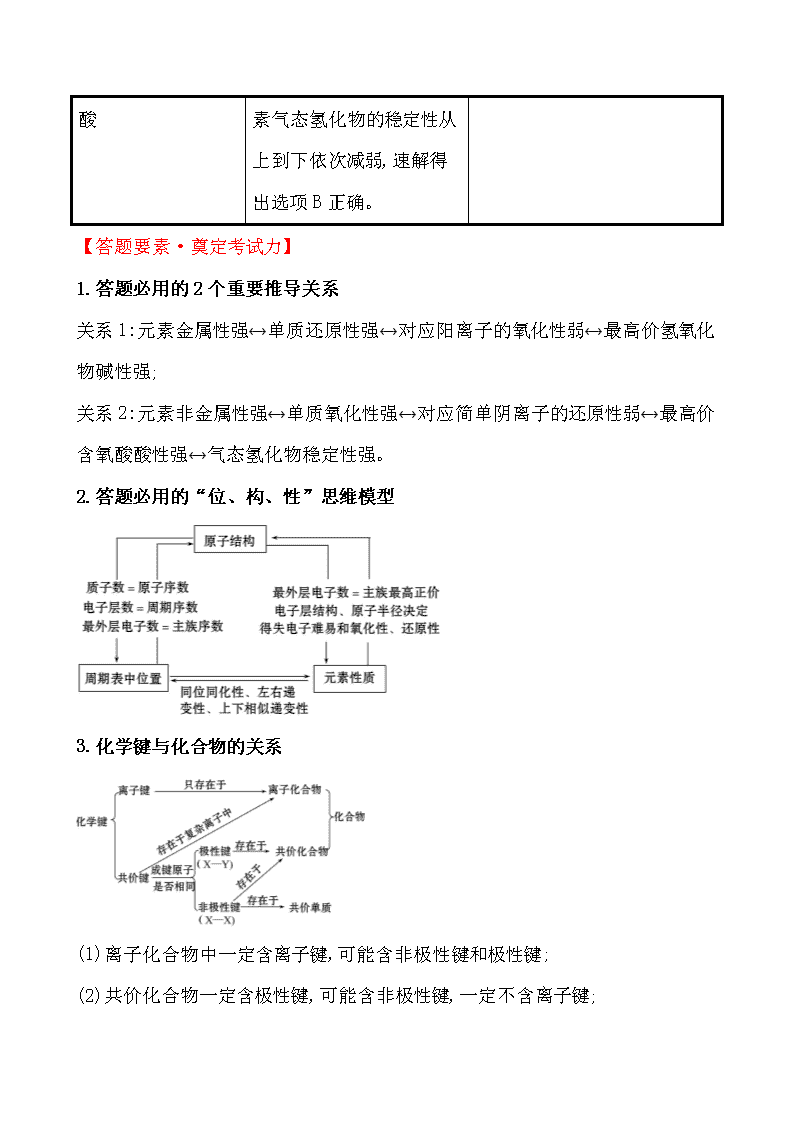
1.答题必用的2个重要推导关系
关系1:元素金属性强↔单质还原性强↔对应阳离子的氧化性弱↔最高价氢氧化物碱性强;
关系2:元素非金属性强↔单质氧化性强↔对应简单阴离子的还原性弱↔最高价含氧酸酸性强↔气态氢化物稳定性强。
2.答题必用的“位、构、性”思维模型
3.化学键与化合物的关系
(1)离子化合物中一定含离子键,可能含非极性键和极性键;
(2)共价化合物一定含极性键,可能含非极性键,一定不含离子键;
(3)既有极性键又有非极性键的共价化合物一般由多个原子组成,如H2O2、C2H4等;
(4)既有离子键又有极性共价键的物质,如NaOH、K2SO4等;既有离子键又有非极性共价键的物质,如Na2O2等。
【考场练兵·检验考试力】
1.主族元素X、Y、Z、W、R、T的原子序数依次增大,且均不大于20。其中X-的电子层结构与氦相同,R和Y同族,Y元素的某种单质是一种自来水消毒剂;Z3+和Y2-具有相同的电子层结构;T、W、Y三种元素组成盐T2WY3的溶液通入过量CO2后产生白色沉淀。下列说法不正确的是 ( )
A.原子半径:T>R>W>Z
B.T和R形成化合物的水溶液呈碱性
C.化合物TX具有很强的还原性,可与水反应
D.T、R、Z三种元素的最高价氧化物对应的水化物两两能发生反应
2.2019年是元素周期表诞生的第150周年,联合国大会宣布2019年是“国际化学元素周期表年”。W、X、Y和Z为原子序数依次增大的四种短周期主族元素。W的一种核素可用于文物年代的测定,X与W同周期相邻,四种元素中只有Y为金属元素,Z的单质为黄绿色气体。下列叙述正确的是 ( )
A.W的氢化物中只存在极性共价键
B.Z的氧化物对应的水化物均为强酸
C.X与Y的化合物可发生水解反应
D.Y与Z的化合物熔融电解一定得金属单质
考向2 “元素周期表片段”综合推断题
【研磨真题·提升审题力】
真题再回访
破题关键点
专家话误区
(2019·全国卷Ⅱ·9)今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是 ( )
A.原子半径:W
R>X>Y
B.原子半径由小到大的顺序为ZY>X
B. WX2中含有非极性共价键
C.简单氢化物的热稳定性:X>Y
D. 常温常压下Z的单质为气态
2.短周期主族元素X、Y、Z、W、Q的原子序数依次增加。已知,离子化合物甲是由X、Y、Z、W四种元素组成的,其中,阴阳离子个数比为1∶1,阳离子是一种5核10电子微粒;Q元素原子半径是短周期主族元素中最大的;乙为上述某种元素的最高价氧化物对应的水化物;甲与乙的浓溶液反应生成丙、丁、戊三种物质,其中丁在常温下为气体。下列说法正确的是 ( )
A.甲中既含离子键,又含共价键
B.丙和戊的混合物一定显酸性
C.丁一定能使湿润的红色石蕊试纸变蓝
D.原子半径:XZ>Y>X
B.气态氢化物热稳定性:Z>W
C.元素Z和W均存在两种以上的含氧酸
D.元素Z和W在自然界中均只能以化合态存在
4.短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为20。则下列说法不正确的是 ( )
X
Y
W
Z
A.最高价氧化物的水化物的酸性:Xr(Y)>r(W)
B. Y的最高价氧化物对应水化物的酸性比Z的强
C.由W、Y形成的化合物是离子化合物
D.由X、Y形成的化合物的水溶液呈中性
6.四种位于不同主族的短周期元素X、Y、Z、W的原子序数依次增大,X的内层电子与最外层电子数之比为2∶5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1∶2。下列说法正确的是 ( )
A.四种元素中至少有两种金属元素
B.四种元素的常见氢化物中熔点最高的是Z的氢化物
C.四种元素形成的简单离子中,离子半径最小的是元素Y形成的离子
D.常温下,X、Y、Z三种元素形成的化合物的水溶液的pH小于7
7.如图是某另类元素周期表的一部分,下列说法正确的是 ( )
A.简单阴离子的半径大小:X>Y>Z
B.单质的氧化性:X>Y>Z
C.Y的氢化物只有一种
D.X的最高价氧化物对应的水化物为强酸
8.2018年7月12日,我国科学家姜雪峰教授被评为“全球青年化学家元素周期表硫元素代言人”,他是目前为止第一位入选的中国学者。下列说法或推测正确的是 ( )
O
P
S
Cl
Se
A.单质S不溶于水,微溶于酒精,易溶于二硫化碳
B.含氧酸的酸性:Cl>S>P
C.沸点:H2Or(Z)>r(W)
B.化合物N与乙烯均能使溴水褪色,且原理相同
C.含W元素的盐溶液可能显酸性、中性或碱性
D.Z与X、Y、W形成的化合物中,各元素均满足8电子结构
10.短周期元素W、X、Y、Z的原子序数依次增加。p、q、r是由这些元素组成的二元化合物,常温常压下,p为无色无味气体,q为液态,r为淡黄色固体,s是气体单质。上述物质的转化关系如图所示。下列说法错误的是 ( )
A.原子半径:Z>Y>X
B.m、n、r都含有离子键和共价键
C.m、n、t都能破坏水的电离平衡
D.最简单气态氢化物的稳定性:Y>X
答案
考向1
【真题再回访】
B X、Y、Z为短周期主族元素,X与Z同族,所以二者最外层电子数相等,Y最外层电子数等于X次外层电子数,由于Y不是稀有气体,最外层电子数不是8,因此Y的最外层电子数为2,三种元素最外层电子数之和为10,可以求出X与Z的最外层电子数为4。结合Y原子半径大于Z,可知X为碳元素,Y为镁元素,Z为硅元素。因为CO、CO2常温下均是气体,MgO是固体,所以C的氧化物的熔点比Mg的氧化物的熔点低,A错误。因为碳元素的非金属性比硅元素强,所以碳的氢化物的热稳定性大于硅的氢化物,B正确。C和Si金属性、非金属性都不强,不易形成阴离子或阳离子,二者形成的化合物是共价化合物,C错误。金属Mg可以与浓硝酸反应而溶解,硅与浓硝酸常温下不反应,D错误。
【考场练兵·检验考试力】
1.A 主族元素X、Y、Z、W、R、T的原子序数依次增大,且均不大于20。其中X-的电子层结构与氦相同,则X为氢元素;R和Y同族,Y元素的某种单质是一种自来水消毒剂,为O3,则Y为氧元素;R为硫元素;Z3+和Y2-具有相同的电子层结构,Z在Y的下一周期,Z为铝元素;T、W、Y三种元素组成盐T2WY3的溶液通入过量CO2后产生白色沉淀,且W的原子序数大于铝而小于硫,故T2WY3为K2SiO3,生成的白色沉淀为硅酸。A.同周期元素原子半径从左而右依次减小,故原子半径:T(K)> Z(Al) >W(Si)> R(S),选项A不正确;B.T和R形成化合物K2S为强碱弱酸盐,水解呈碱性,选项B正确;C.化合物TX为KH,具有很强的还原性,可与水反应生成氢氧化钾和氢气,选项C正确;D.T、R、Z三种元素的最高价氧化物对应的水化物氢氧化钾、硫酸、氢氧化铝两两能发生反应,选项D正确。
2.C W、X、Y和Z为原子序数依次增大的四种短周期主族元素。W的一种核素可用于文物年代的测定,W为碳元素;X与W同周期相邻,则X为氮元素;Z的单质为黄绿色气体,Z为氯元素;四种元素中只有Y为金属元素,则Y可能为 钠、镁、铝元素,据此分析解答。A.W的氢化物为烃,烃中可能存在非极性共价键,如乙烷、乙烯等,故A错误;B.Z的氧化物对应的水化物不一定为强酸,如次氯酸为弱酸,故B错误;C.X与Y的化合物为氮化物,均可发生水解反应,如氮化钠水解生成氨气和氢氧化钠,氮化镁水解生成氨气和氢氧化镁,氮化铝水解生成氨气和氢氧化铝,故C正确;D.Y与Z的化合物可能为氯化铝,熔融状态不能导电,不能电解得到铝单质,故D错误。
考向2
【真题再回访】
D 主族元素的最高化合价与最外层电子数相等,由“W与X的最高化合价之和为8”可知,W为N,X为Al,Y为Si,Z为P。原子半径:Nr(Cl)>r(O)>r(F),错误;C项,最高价氧化物对应的水化物酸性:H3PO4<
HNO3O2->F-,即Z>X>Y,故A错误;B.WX2为CaO2,含有O—O非极性共价键,故B正确;C.非金属性越强,对应氢化物越稳定,则简单氢化物的热稳定性:HF>H2O,即Y>X,故C错误;D.Z的单质为P4或红磷,常温常压下均为固态,故D错误。
2.A 短周期主族元素X、Y、Z、W、Q的原子序数依次增加。离子化合物甲是由X、Y、Z、W四种元素组成的,其中阴阳离子个数比为1∶1,阳离子是一种5核10电子微粒,该阳离子为N,则X为氢元素;Q
元素原子半径是短周期主族元素中最大的,则Q为钠元素,因此Y、Z、W均为第二周期元素,阴离子组成元素的原子序数小于Na,则阴离子为碳酸氢根离子,则甲为NH4HCO3,因此Y为碳元素、Z为氮元素、W为氧元素;乙为上述某种元素的最高价氧化物对应的水化物;甲与乙的浓溶液反应生成丙、丁、戊三种物质,则乙为氢氧化钠或硝酸,与碳酸氢铵反应生成氨气、碳酸钠和水或硝酸铵、二氧化碳和水,其中丁在常温下为气体,则丁为氨气或二氧化碳。A.甲为NH4HCO3,属于离子化合物,含有离子键,铵根离子、HC中还含有共价键,故A正确;B.丙和戊的混合物可能为碳酸钠溶液或硝酸铵溶液,碳酸钠水解后溶液显碱性,故B错误;C.丁可能为二氧化碳,二氧化碳不能使湿润的红色石蕊试纸变蓝,故C错误;D.同一周期,从左到右,原子半径逐渐减小,同一主族,从上到下,原子半径逐渐增大,原子半径:XW>Y>X,A错误;B.原子的非金属性越强,其对应气态氢化物的稳定性越强,故气态氢化物热稳定性大小顺序为W>Z,B错误;C.元素Z和W均有多种正价态,故均存在两种以上的含氧酸,C正确;D.硫元素(Z)在自然界中以化合态和少量游离态的形式存在,D错误。
4.C 设X、Y之间的元素最外层电子数为a,W、X、Y、Z四种元素的原子最外层电子数之和为20,则a-1+a-2+a+1+a+2=4a=20,a=5,所以W、X、Y、Z分别是Al、C、O、Cl;最高价氧化物的水化物的酸性:H2CO3r(S)>r(O),A项正确;B.元素的非金属性越强,最高价氧化物对应的水化物的酸性越强,则S的最高价氧化物对应水化物的酸性比Cl的弱,B项错误;C.由W、Y形成的化合物可以是SO2或SO3,均为共价化合物,C项错误;D.由X、Y形成的化合物为Na2S,其水溶液中硫离子水解显碱性,D项错误。
6.B 原子序数依次增大,位于不同主族的四种短周期元素X、Y、Z、W,X的内层电子与最外层电子数之比为2∶5,X为氮元素,Z和W位于同周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Z为钠元素,W为氯元素。Y和Z可形成两种离子化合物,其中阴、阳离子数之比均为1∶2,Y为氧元素。A.四种元素中只有钠为金属元素,故A错误;B.氢化钠为离子化合物,四种元素的常见氢化物中熔点最高的是Z的氢化物,故B正确;C.四种元素形成的常见简单离子中,离子半径最小的是元素Z形成的离子,钠离子半径最小,故C错误;D.X、Y、Z三种元素形成的化合物为NaNO3或NaNO2,若为NaNO3溶液显中性,pH等于7,若为NaNO2,因水解溶液显碱性,pH大于7,故D错误。
7.A 根据周期表中元素的排列规律可知:X为磷元素,Y为氮元素,Z为氧元素,结合元素周期律分析判断。A.一般而言,电子层数越多,半径越大,电子层数相同,原子序数越大,半径越小,离子半径的大小:X>Y>Z,故A正确;B.
元素的非金属性越强,单质的氧化性越强,单质的氧化性XS>P,最高价氧化物对应水化物的酸性Cl>S>P,但含氧酸的酸性不一定,如次氯酸为弱酸,酸性小于强酸硫酸,故B错误;C项,水分子间能够形成氢键,增大了分子间作用力,而硫化氢和磷化氢分子间不能形成氢键,水的沸点高于硫化氢和磷化氢,故C错误;D项,硫化氢为共价化合物,用电子式表示硫化氢的形成过程为H×+··+×HH,故D错误。
9.C 乙是一种“绿色氧化剂”,即乙为H2O2,乙和丁的组成元素相同,则丁为H2O,化合物N是具有漂白性的气体(常温下),则N为SO2,根据转化关系,M是单质,H2O2分解成O2和H2O,即M为O2,甲在酸中生成丙,丙为二元化合物,且含有S元素,即丙为H2S,四种元素原子序数依次增大,且都为短周期元素,X为H,Y为O,如果W为S,X、Z原子序数之和是Y、W原子序数之和的1/2,则Z为Na,如果Z为S,则W不符合要求;A、同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,原子半径大小顺序是r(Na)>r(S)>r(O),故A错误;B、SO2能使溴水褪色,发生SO2+Br2+2H2O2HBr+H2SO4,利用SO2的还原性,乙烯和溴水反应,发生的是加成反应,故B错误;C、含硫元素的盐溶液,如果是Na2SO4,溶液显中性,如果是NaHSO4,溶液显酸性,如果是Na2SO3,溶液显碱性,故C正确;D
、形成化合物分别是NaH、Na2O/Na2O2、Na2S,NaH中H最外层有2个电子,不满足8电子结构,故D错误。
10.A 由题目分析可知,W为H,X为C,Y为O,Z为Na。A.电子层数越多,原子半径越大,同周期从左向右原子半径减小,原子半径C>O,则原子半径:Z>X>Y,故A错误; B.m为NaHCO3,n为Na2CO3,r为Na2O2,均含离子键、共价键,故B正确;C.m为NaHCO3,n为Na2CO3,t为NaOH,n、m促进水的电离,t抑制水的电离,则m、n、t都能破坏水的电离平衡,故C正确;D.非金属性Y>X,则最简单气态氢化物的稳定性:Y>X,故D正确。