- 2021-04-13 发布 |
- 37.5 KB |
- 16页

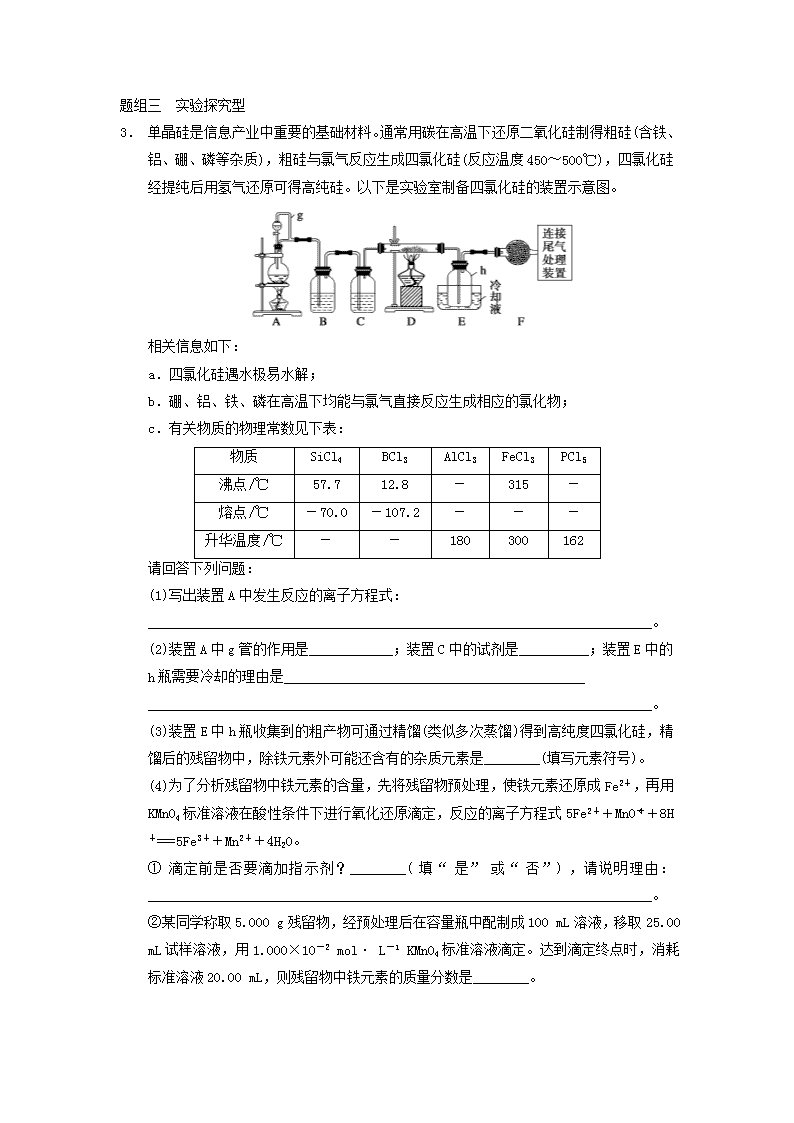
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学二轮通关复习专题十二常见非金属元素知识精讲题组集训
专题十二 常见非金属元素 【考纲要求】 1.了解常见非金属元素单质及其重要化合物的主要性质及应用。2.了解常见非金属元素单质及其重要化合物对环境质量的影响。3.以上各部分知识的综合运用。 考点串讲 考点一 碳、硅及其重要化合物 知识精讲 1. 理清知识主线 H4 ―→O―→O2 H4 ―→O2(H2SO3) 2. 注意网络构建 3. 必记重要反应 (1)碳及其化合物 C+CO22CO C+H2O(g)CO+H2 2C+SiO2Si+2CO↑ 提醒 由于C过量,SiO2与C反应产物是CO而不是CO2,该反应用于工业上制备粗硅,必须在隔绝空气的条件下进行。 (2)硅及其化合物 Si+4HF===SiF4↑+2H2↑ Si+2NaOH+H2O===Na2SiO3+2H2↑ SiO2+4HF===SiF4↑+2H2O SiO2+2NaOH===Na2SiO3+H2O SiO+2H+===H2SiO3↓ Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3 提醒 氢氟酸不能用玻璃容器盛放,NaOH溶液能用玻璃试剂瓶,但不能用玻璃塞。 4. 扫除知识盲点 (1)Si的还原性大于C,但C却能在高温下从SiO2中还原出Si:SiO2+2CSi+2CO↑。 (2)酸性氧化物一般能与水反应生成酸,但SiO2不溶于水;酸性氧化物一般不与酸作用,但SiO2能与HF反应。 (3)硅酸盐大多难溶于水,常见可溶性硅酸盐硅酸钠,其水溶液称为泡花碱或水玻璃,但却是盐溶液。 (4)H2CO3的酸性大于H2SiO3,所以有Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3,但高温下Na2CO3+SiO2Na2SiO3+CO2↑也能发生,原因可以从两方面解释:①硅酸盐比碳酸盐稳定;②从化学平衡角度,由高沸点难挥发固体SiO2制得低沸点易挥发的CO2。 (5)SiO2不导电,是用作光导纤维的材料;Si是半导体,是用作光电池的材料。 (6)水泥、玻璃与陶瓷是三大传统无机非金属材料;碳化硅、氮化硅等是新型无机非金属材料。 题组集训 题组一 性质用途型 1. 正误判断,正确的划“√”,错误的划“×” (1)石英只能用于生产光导纤维 (2)高温下用焦炭还原SiO2制取粗硅 (3)二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 (4)合成纤维和光导纤维都是新型无机非金属材料 (5)单质硅是将太阳能转变为电能的常用材料 (6)硅酸钠溶液与醋酸溶液混合:SiO+2H+===H2SiO3↓ (7)向一定浓度的Na2SiO3溶液中通入适量CO2气体,出现白色沉淀,则H2SiO3的酸性比H2CO3的酸性强 (8)SiO2与酸、碱均不反应 题组二 网络构建型 2. 正误判断,正确的划“√”,错误的划“×” (1)X(Si)、Y(SiO2)、Z(H2SiO3)或X(C)、Y(CO)、Z(CO2)均可实现的转化 (2)对于“甲乙丙”,若甲为焦炭,则丁可能是O2 题组三 实验探究型 3. 单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。 相关信息如下: a.四氯化硅遇水极易水解; b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物; c.有关物质的物理常数见下表: 物质 SiCl4 BCl3 AlCl3 FeCl3 PCl5 沸点/℃ 57.7 12.8 - 315 - 熔点/℃ -70.0 -107.2 - - - 升华温度/℃ - - 180 300 162 请回答下列问题: (1)写出装置A中发生反应的离子方程式: ________________________________________________________________________。 (2)装置A中g管的作用是____________;装置C中的试剂是__________;装置E中的h瓶需要冷却的理由是___________________________________________ ________________________________________________________________________。 (3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是________(填写元素符号)。 (4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+ ,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式5Fe2++MnO+8H+===5Fe3++Mn2++4H2O。 ①滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由:________________________________________________________________________。 ②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol· L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是________。 考点二 卤素及其重要化合物 知识精讲 1. 理清知识主线 HCCl2―→HCl ―→HO2―→HO3―→HO4 2. 注意网络构建 3. 必记重要反应 (1)Cl2+H2OH++Cl-+HClO (2)Cl2+NaOH===NaCl+NaClO+H2O (3)Ca(OH)2+2Cl2===Ca(ClO)2+CaCl2+2H2O (4)Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO (5)Ca2++3ClO-+SO2+H2O===CaSO4↓+Cl-+2HClO(少量SO2) (6)Ca2++2ClO-+2SO2+2H2O===CaSO4↓+2Cl-+SO+4H+(过量SO2) (7)2HClO2HCl+O2↑ (8)6FeBr2+3Cl2===4FeBr3+2FeCl3(Cl2少量) (9)2FeBr2+3Cl2===2FeCl3+2Br2(Cl2过量) (10)6FeBr2+6Cl2===4FeCl3+3Br2+2FeBr3 (11)4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O(实验室制Cl2) (12)2NaCl+2H2O2NaOH+H2↑+Cl2↑(工业制Cl2) 4. 扫除知识盲点 (1)液氯密封在钢瓶中,而氯水、次氯酸应保存在棕色试剂瓶中。 (2)1 mol Cl2参加反应,转移电子数可能为2NA,1NA,小于1NA(Cl2和H2O的反应为可逆反应)。 (3)实验室制Cl2,除了用MnO2和浓盐酸反应外,还可以用KMnO4、KClO3、NaClO与浓盐酸反应且都不需要加热,如ClO-+Cl-+2H+===Cl2↑+H2O。 (4)酸性KMnO4溶液,用的是H2SO4酸化而不是盐酸。 (5)ClO-不论在酸性环境中还是在碱性环境中均能体现强氧化性,如ClO-与SO、I- 、Fe2+均不能大量共存; ClO-体现水解性,因HClO酸性很弱,ClO-水解显碱性,如Fe3++3ClO-+3H2O===Fe(OH)3↓+3HClO,所以ClO-与Fe3+、Al3+均不能大量共存。 题组集训 题组一 性质判断型 1. 正误判断,正确的划“√”,错误的划“×” (1)实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 (2)用乙醇萃取的方法可以分离溶于水的碘,是因为碘在乙醇中的溶解度较大 (3)碘是人体必须的微量元素,所以要多吃富含高碘酸的食物 (4)HClO是弱酸,所以NaClO是弱电解质 (5)Fe2+、Al3+、ClO-、Cl-不能大量共存 (6)二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-===SO+Cl-+H2O (7)冷的NaOH溶液中通入Cl2:Cl2+2OH-===Cl-+ClO-+H2O (8)标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA 题组二 实验探究型 2. 在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。 ①下列收集Cl2的正确装置是________。 ②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是________。 ③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,____________。 3. 下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。 已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O 对实验现象的“解释或结论”正确的是 ( ) 选项 实验现象 解释或结论 A a处变蓝,b处变红棕色 氧化性:Cl2>Br2>I2 B c处先变红,后褪色 氯气与水生成了酸性物质 C d处立即褪色 氯气与水生成了漂白性物质 D e处变红色 还原性:Fe2+>Cl- 考点三 氧、硫及其化合物 知识精讲 1. 理清知识主线 H2 ―→ ―→O2―→O3(HO4) 2. 注意网络构建 3. 必记重要反应 (1)3S+6NaOH2Na2S+Na2SO3+3H2O (2)2SO2+O22SO3 (3)SO2+2OH-===SO+H2O (4)SO2+X2+2H2O===H2SO4+2HX(X2:Cl2、Br2、I2) (5)2H2S+SO2===3S↓+2H2O (6)SO2+2Fe3++2H2O===SO+2Fe2++4H+ (7)Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑ (8)C+2H2SO4(浓)2H2O+CO2↑+2SO2↑ (9)Na2SO3+H2SO4===Na2SO4+H2O+SO2↑ 4. 扫除知识盲点 (1)除去附着在试管内壁上的硫,除了用热的NaOH溶液,还可以用CS2,但不能用酒精。 (2)SO2使含有酚酞的NaOH溶液褪色,表现SO2 酸性氧化物的性质;使品红溶液褪色,表现SO2的漂白性;能使溴水、酸性KMnO4溶液褪色,表现SO2的还原性;SO2与H2S反应,表现SO2的氧化性;SO2和Cl2等体积混合通入溶液中,漂白性不但不增强,反而消失。 (3)把SO2气体通入BaCl2溶液中,没有沉淀生成,但若通入NH3或加入NaOH溶液,或把BaCl2改成Ba(NO3)2均有白色沉淀生成,前两者生成BaSO3沉淀,后者生成BaSO4沉淀。 (4)浓HNO3和Cu(足量)、浓H2SO4和Cu(足量)、浓盐酸和MnO2(足量)在反应时,随反应进行,产物会发生变化或反应停止。注意区分Zn和浓H2SO4的反应。 (5)C与浓硫酸反应产物的确定应按以下流程进行:无水CuSO4确定水→品红溶液确定SO2→酸性KMnO4溶液除去SO2→品红溶液检验SO2是否除净→澄清石灰水检验CO2。 题组集训 题组一 性质判断型 1. 正误判断,正确的划“√”,错误的划“×” (1)BaSO3与H2O2的反应为氧化还原反应 (2)二氧化硫可广泛用于食品的增白 (3)用Na2S作沉淀剂,除去废水中的Cu2+、Hg2+ (4)用硫酸清洗锅垢中的水垢 (5)用SO2漂白纸浆和草帽辫 (6)因为浓硫酸有强氧化性,故浓硫酸可用于干燥H2和CO (7)因为SO2有漂白性,所以SO2可使溴水褪色 (8)50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA (9)Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 题组二 网络构建型 2. 正误判断,正确的划“√”,错误的划“×” (1)SSO3H2SO4 题组三 实验探究型 3. 下图所示的是验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。将硫酸滴入装有亚硫酸钠固体的培养皿中。 关于此实验的“现象”、“解释或结论”以及对应关系均正确的是 ( ) 选项 现象 解释或结论 A a处黄色褪去 非金属性:Br>S B b处变为红色 二氧化硫与水反应生成酸性物质 C c处变为蓝色 二氧化硫具有一定的氧化性 D d处红色先褪去后恢复 二氧化硫具有漂白性且漂白性不稳定 考点四 氮及其重要化合物 知识精讲 1. 理清知识主线 H3―→ ―→2O―→O―→O2―→HO3 2. 注意网络构建 3. 必记重要反应 (1)N2+O22NO (2)2NO+O2===2NO2 (3)3NO2+H2O===2HNO3+NO (4)NH3+H2ONH3·H2ONH+OH- (5)4NH3+5O24NO+6H2O (6)NH4HCO3NH3↑+CO2↑+H2O (7)Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O (8)NH+OH-NH3↑+H2O (9)4HNO34NO2↑+O2↑+2H2O (10)Cu+4HNO3(浓)===Cu(NO3)2+2H2O+2NO2↑ (11)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O (12)C+4HNO3(浓)CO2↑+4NO2↑+2H2O 4. 扫除知识盲点 (1)NO只能用排水法或气囊法收集。 (2)NO2或NO与O2通入水的计算中常用到4NO+3O2+2H2O===4HNO3、4NO2+O2+2H2O===4HNO3两个方程式。 (3)浓HNO3显黄色是因为溶有NO2,而工业上制备的盐酸显黄色,是因为溶有Fe3+。 (4)硝酸、浓H2SO4、次氯酸具有强氧化性,属于氧化性酸,其中HNO3、HClO见光或受热易分解。 (5)强氧化性酸(如HNO3、浓H2SO4)与金属反应不生成H2;金属和浓HNO3反应一般生成NO2,而金属和稀HNO3反应一般生成NO。 (6)实验室制备NH3,除了用Ca(OH)2和NH4Cl反应外,还可用浓氨水的分解(加NaOH或CaO)制取,而检验NH须用浓NaOH溶液并加热,用湿润的红色石蕊试纸检验生成的气体,以确定NH的存在。 (7)收集NH3时,把一团干燥的棉花放在试管口,以防止与空气对流;收集完毕,尾气处理时,应放一团用稀硫酸浸湿的棉花放在试管口,以吸收NH3。 (8)铜与浓HNO3反应在试管内就能看到红棕色的NO2,而与稀HNO3反应时需在试管口才能看到红棕色气体。 (9)浓盐酸和浓氨水反应有白烟生成,常用于HCl和NH3的相互检验。 题组集训 题组一 性质判断型 1. 正误判断,正确的划“√”,错误的划“×” (1)可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 (2)液氨汽化时要吸收大量的热,可用作制冷剂 (3)NH4Cl为强酸弱碱盐,所以可用加热法除去NaCl中的NH4Cl (4)检验NH时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 (5)用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO===Ag++NO↑+H2O (6)向NH4HCO3溶液中加过量的NaOH溶液并加热:NH+OH-NH3↑+H2O (7)实验室用NH4Cl和Ca(OH)2制备NH3不涉及氧化还原反应 (8)工业上利用合成氨实现人工固氮涉及氧化还原反应 (9)用浓HNO3与Cu反应制备NO2 (10)NO2溶于水时发生氧化还原反应 题组二 网络构建型 2. 正误判断,正确的划“√”,错误的划“×” (1)a(HNO3)、b(NO)、c(NO2)可实现的转化 ( 题组三 装置判断型 3. 实验室制取少量干燥的氨气涉及下列装置,其中正确的是 ( ) A.①是氨气发生装置 B.③是氨气发生装置 C.②是氨气吸收装置 D.④是氨气收集、检验装置 4. 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是 ( ) 选项 a中的物质 b中的物质 c中收集的气体 d中的物质 A 浓氨水 CaO NH3 H2O B 浓硫酸 Na2SO3 SO2 NaOH溶液 C 稀硝酸 Cu NO2 H2O D 浓盐酸 MnO2 Cl2 NaOH溶液 考点五 环境污染与环境保护 知识精讲 人类社会进入二十世纪八十年代以来,人们越来越关心环境问题。我们在享受科学技术迅速发展带来物质文明的同时,也因一次次以牺牲环境为代价,而受到大自然的一次次报复。如全球变暖、臭氧层破坏、酸雨、死鱼事件、沙尘暴等。人们逐渐意识到:保护环境,就是保护人类赖以生存的空间。作为关系到千家万户的高考已经把环境问题列为一个重要考点。 1. 环境污染的主要类型 大气污染、水污染、土壤污染、食品污染、固体废弃物污染、放射性污染、噪音污染等类型。 2. 二氧化硫的污染及治理 二氧化硫是空气中有害气体的罪魁祸首。当空气中SO2的含量达到百万分之零点一到百万分之一时,植物、建筑物的结构材料就会严重受损;若达到百万分之一到百万分之十时,会引起呼吸道痉挛、流泪、咳嗽甚至死亡;若达到万分之一时,一切生命都无法存在。 控制酸雨的根本措施是减少SO2和NO2的人为排放量。火力发电厂是SO2主要的污染源之一。目前全世界的火力发电厂通常利用石灰石泥浆吸收尾气中的SO2生产石膏,较先进的方法是采取烟气脱硫、重油脱硫等方法。 生产硫酸的工厂也是主要的污染源,硫酸工业通常采用氨吸收法。 3. 化学中的环保 (1)环境:大气、土地、水、矿产、森林、生物及风景游览区、自然保护区、生活居住区等构成了人类生存的环境。 (2)环保措施:控制和减少污染物的排放,如硫酸厂尾气在排放前的回收处理、城市机动车的排气限制等。 (3)工业三废:废水、废气、废渣。 (4)粉尘:指煤、矿石、SiO2等固体物料在运输、筛选、粉碎、卸料等机械处理过程中产生的或是由风扬起的灰尘等。 (5)破坏臭氧层的物质:SO2、NO、NO2、CF2Cl2(氟利昂)等。 (6)氰化物:CN-有剧毒(电镀液中常含有),含CN-的污水、废气会严重污染环境。 (7)汞:剧毒。不慎洒出,可在汞上撒上硫粉(Hg+S===HgS)。为了排除室内汞蒸气,排风机应装在墙的下部。 题组集训 1. 今年3月修订的《环境空气质量标准》中新纳入的强制监测指标是( ) A.PM2.5 B.NOx C.SO2 D.可吸入颗粒物 2.化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用。下列做法与社会可持续发展理念相违背的是 ( ) A.改进汽车尾气净化技术,减少大气污染物的排放 B.开发利用可再生能源,减少化石燃料的使用 C.研发可降解高分子材料,减少“白色污染” D.过度开采矿物资源,促进地方经济发展 3.NOx是汽车尾气中的主要污染物之一。 (1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:________________________________________________________________________。 (3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。 ①当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:______________________________________________________________ ________________________________________________________________________。 ②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO。原因是________________________________, 元素的金属性逐渐增强,金属氧化物对NOx的吸收能力逐渐增强。 专题突破训练 1. “神九”飞船上载有活性炭材料的器材,其作用是 ( ) A.处理宇航员的生活垃圾 B.去除呼吸废气中的异味 C.提供生活中需要的能量 D.改善失重条件下的平衡 2. 将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系如下图所示,图中AB段表示的离子方程式先后顺序正确的是 ( ) ①CO2+OH-===HCO ②CO2+2OH-===CO+H2O ③CO+Ba2+===BaCO3↓ ④BaCO3+CO2+H2O===Ba2++2HCO ⑤CO+CO2+H2O===2HCO A.③① B.②⑤ C.⑤④ D.④② 3. 某化学小组用下图所示装置制取氯气,下列说法不正确的是 ( ) A.该装置图中至少存在两处明显错误 B.烧瓶中的MnO2可换成KMnO4 C.在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 D.在集气瓶的导管口处放一片湿润的淀粉KI试纸可以证明是否有氯气逸出 4. 下列有关物质的性质或用途的说法中正确的是 ( ) ①氯气具有漂白性,可以直接使有色布条褪色 ②二氧化硫具有较强的还原性,不能用浓硫酸干燥 ③SiO2是酸性氧化物,能与氢氟酸反应 ④Al(OH)3是两性氢氧化物,能溶于强酸或强碱 A.①②③ B.②③④ C.③④ D.①②④ 5. 下列有关物质的性质与应用不相对应的是 ( ) A.Na2O2能分别与H2O、CO2反应,可用作供氧剂 B.硅胶多孔、吸水能力强,常用作袋装食品的干燥剂 C.K2FeO4具有强还原性且被氧化生成Fe3+,可用于水的消毒和净化 D.液氨汽化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂 6. 下列有关物质用途的说法,错误的是 ( ) A.二氧化硫常用于漂白纸浆 B.漂粉精可用于游泳池水消毒 C.晶体硅常用于制作光导纤维 D.氧化铁常用于红色油漆和涂料 7. 咖喱是一种烹饪辅料,白色衬衣被咖喱汁玷污后,用普通肥皂洗涤,发现黄色污渍变成红色,经水漂洗后红色又变成黄色。与咖喱汁具有上述相似化学原理的试剂有 ( ) A.石蕊试液 B.品红试液 C.氯水 D.淀粉KI(aq) 8. 下列物质间能直接转化的元素是 ( ) A.氯 B.硫 C.铝 D.铁 9. 化学中有许多物质之间的反应符合下列关系图,图中其他产物及反应所需条件均已略去。 对于上图的变化下列判断不正确的是 ( ) A.当A是正盐、X是强酸时,D是酸性氧化物 B.当X是强碱溶液时,B一定是NH3 C.B可能是单质 D.D可能是一种酸 10.在下列物质转化关系中,反应的条件和部分产物已略去。 回答下列问题: (1)若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应。 ①反应Ⅰ中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是________(填字母)。 A.热分解法 B.热还原法 C.电解法 ②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是____________________________________________________________。 ③通过比较反应Ⅰ、Ⅱ的反应条件,可得出甲的金属性比乙的金属性________(填“强”或“弱”),比较二者金属性强弱的依据还可以是(写出一种即可)__________________。 (2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应。 ①反应Ⅲ的化学方程式是__________________________________________________。 ②反应Ⅰ的另一种产物为有机物,则该有机物的电子式是______________。 ③在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体。其反应的离子方程式是______________________________________________。 11.已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。 请回答下列问题: (1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是____________________;工业上制取A的离子方程式为______________________。 (2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为________________________。 (3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是____________________。 (4)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为____________________。 某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:_______________ ________________________________________________________________________。 12.(1)下列与含氯化合物有关的说法正确的是________(填字母)。 A.HClO是弱酸,所以NaClO是弱电解质 B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 D.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数) (2)无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。 装置B中盛放饱和NaCl溶液,该装置的主要作用是______________。F中试剂的作用是____________________。用一件仪器装填适当试剂后可同时起到F和G的作用,所装填的试剂为________________。 13.硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒,存在于多种生产过程以及自然界中。在人体的很多生理过程中也起着重要作用。 资料:①H2S可溶于水(约1∶2),其水溶液为二元弱酸。 ②H2S可与许多金属离子反应生成沉淀。 ③H2S在空气中燃烧,火焰呈淡蓝色。 (1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示。A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液。 回答下列问题: ①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为___________________。 ②B中的现象是__________________。 ③C中只有浅黄色沉淀产生,且溶液变浅绿色。则C中发生反应的离子方程式为______________。 ④D中盛放的试剂可以是________(填字母序号)。 a.水 b.盐酸 c.NaCl溶液 d.NaOH溶液 (2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小明同学又设计了下列实验。 实验操作 实验现象 实验1 将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 无明显现象 实验2 将H2S通入Na2SO3溶液中 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 实验3 将SO2通入Na2S溶液中 有浅黄色沉淀产生 已知:电离平衡常数: H2S Kal=1.3×10-7,Ka2=7.1×10-15 H2SO3 Ka1=1.7×10-2,Ka2=5.6×10-8 ①根据上述实验,可以得出结论:在__________条件下,+4价硫化合物可以氧化-2价硫的化合物。 ②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是________(填字母序号)。 (3)文献记载,常温下H2S可与Ag发生置换反应生成H2。现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应______。查看更多