- 2021-04-13 发布 |
- 37.5 KB |
- 29页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习鲁科版10-3化学实验方案的设计与评价教案
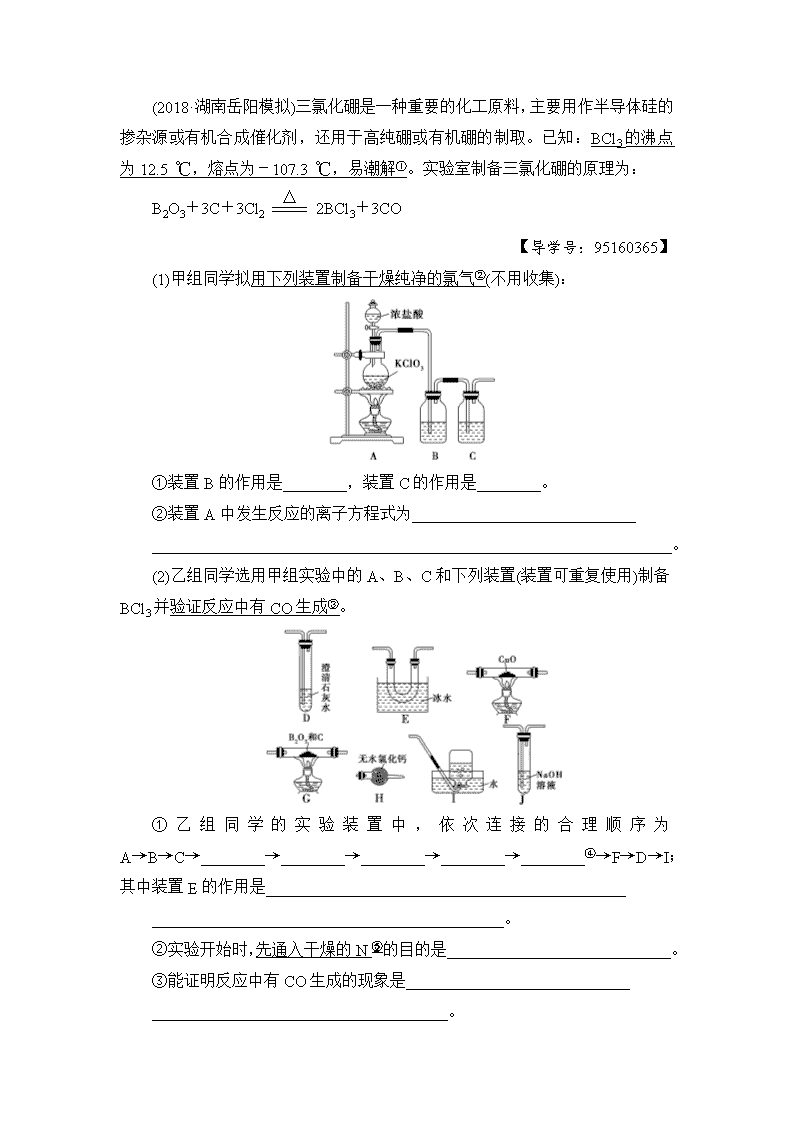
第3节 化学实验方案的设计与评价 考纲定位 全国卷5年考情 1.了解化学实验是科学探究过程中的一种重要方法。 2.根据化学实验目的和要求能做到: ①设计实验方案; ②正确选用实验装置; ③分析或处理实验数据得出合理结论; ④掌握控制实验条件的方法; ⑤评价或改进实验方案。 2017年:Ⅰ卷T26;Ⅱ卷T28;Ⅲ卷T26 2016年:Ⅰ卷T13;Ⅱ卷T10、T26(1);Ⅲ卷T9、T26(6) 2015年:Ⅰ卷T26;Ⅱ卷T28 2014年:Ⅰ卷T26;Ⅱ卷T28 2013年:Ⅰ卷T26;Ⅱ卷T26 考点1| 化学实验方案的设计 (对应学生用书第200页) [考纲知识整合] 1.基本原则 2.基本思路 了解实验目的→明确实验原理→掌握实验条件→选择仪器药品→设计装置步骤→记录现象数据→分析得出结论。 3.基本内容 4.实验设计的注意事项 (1)实验操作顺序 装置选择与连接→气密性检查→加固体药品→加液体药品→开始实验(按程序)→拆卸仪器→其他处理等。 (2)加热顺序选择 若气体制备实验需加热,应先加热气体发生装置,通入气体排出装置中的空气后,再给实验中需要加热的物质加热。目的:①防止爆炸(如氢气还原氧化铜);②保证产品纯度,防止反应物或生成物与空气中的物质反应。熄灭酒精灯的顺序则相反。 (3)防止试剂变质 ①实验中反应物或产物若易吸水、潮解、水解等,要采取措施防止其吸水; ②易挥发的液体产物要及时冷却; ③易挥发的液体反应物需在反应装置中加装冷凝回流装置(如长导管、竖直的干燥管、冷凝管等); ④注意防止倒吸。 (4)画简单装置图 能够绘制和识别典型的实验仪器装置图,一般能画出简单的装置图即可,但要符合要求,例如形状、比例等。 (5)仪器连接问题 注意所选仪器是否恰当,安装顺序是否恰当,接口顺序是否恰当。 [高考命题点突破] 命题点1 物质制备为主体的方案设计 类型一 无机物的制备 [典例导航] (2018·湖南岳阳模拟)三氯化硼是一种重要的化工原料,主要用作半导体硅的掺杂源或有机合成催化剂,还用于高纯硼或有机硼的制取。已知:BCl3的沸点为12.5_℃,熔点为-107.3_℃,易潮解①。实验室制备三氯化硼的原理为: B2O3+3C+3Cl22BCl3+3CO 【导学号:95160365】 (1)甲组同学拟用下列装置制备干燥纯净的氯气②(不用收集): ①装置B的作用是________,装置C的作用是________。 ②装置A中发生反应的离子方程式为____________________________ _________________________________________________________________。 (2)乙组同学选用甲组实验中的A、B、C和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成③。 ①乙组同学的实验装置中,依次连接的合理顺序为A→B→C→________→________→________→________→________④→F→D→I;其中装置E的作用是_____________________________________________ ____________________________________________。 ②实验开始时,先通入干燥的N的目的是____________________________。 ③能证明反应中有CO生成的现象是____________________________ _____________________________________。 ④三氯化硼接触潮湿空气时会形成腐蚀性浓厚白雾⑥,其与水反应的化学方程式为________________________________。 [审题指导] ①根据BCl3的熔、沸点可确定,易液化,可用冷却水冷凝;易潮解要注意BCl3制备时水蒸气的影响,气体要干燥。 ②干燥纯净的Cl2制取时注意除杂[杂质HCl、H2O(g)],及除杂的先后顺序为先除HCl再干燥。 ③验证CO生成,一般是利用CO的还原性与CuO反应生成CO2,根据CO2存在证明CO的生成,但要注意CO2干扰。 ④剩余4个装置,题中留有5个装置空白,说明有一装置重复。 ⑤装置中的O2要与C反应,干扰实验,N2排空气,防止O2干扰。 ⑥HCl在空气中易形成白雾。 【答案】 (1)①吸收Cl2中的HCl气体 干燥Cl2或吸收Cl2中的H2O(g) ②ClO+5Cl-+6H+3Cl2↑+3H2O (2)①G、E、H、J、H 冷凝BCl3为液体 ②排除装置中的空气,防止O2的干扰 ③装置,装置F中黑色粉末变为红色中D澄清石灰水变浑浊 ④BCl3+3H2O===H3BO3+3HCl [题后归纳] 物质制备与提纯的思维流程 [对点训练] 1.(2017·广州一测)高纯MnCO3是广泛用于电子行业的强磁性材料。MnCO3 为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于100 ℃开始分解。 Ⅰ.实验室以MnO2为原料制备MnCO3 (1)制备MnSO4溶液: ①主要反应装置如图所示,缓缓通入经N2稀释的SO2气体,发生反应H2SO3+MnO2===MnSO4+H2O。下列措施中,目的是加快反应速率的是________(填标号)。 A.MnO2加入前先研磨 B.搅拌 C.提高混合气中N2比例 ②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓)===2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有________(填标号)。 ③若用空气代替N2进行实验,缺点是_____________________________ ________________________________________________________________ (酸性环境下Mn2+不易被氧化)。 (2)制备MnCO3固体: 实验步骤:①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤; ②…… ③在70~80 ℃下烘干得到纯净干燥的MnCO3固体。步骤②需要用到的试剂有________。 Ⅱ.设计实验方案 (3)利用沉淀转化的方法证明Ksp(MnCO3)查看更多