2019届高考化学一轮复习化学反应与能量作业
1、N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应为:
N2O(g)+CO(g) CO2(g)+N2(g) △H,有关化学反应的物质变化过程如图1,能量变化过程如图2,下列说法正确的是( )
A. 由图1可知:△H1=△H+△H2
B. 由图2可知△H = -226 kJ·mol-1
C. 为了实现转化需不断向反应器中补充Pt2O+和Pt2O2+
D. 由图2可知该反应正反应的活化能大于逆反应的活化能
2、灰锡(以粉末状存在)和白锡是锡的两种同素异形体,已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) ΔH1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) ΔH2
③Sn(s、灰) Sn(s、白) ΔH2=+2.1kJ/mol;
下列说法正确的是( )
A.ΔH1>ΔH2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
3、已知:H2O(g)===H2O(l) ΔH1=Q1kJ·mol-1
C2H5OH(g)===C2H5OH(l) ΔH2=Q2kJ·mol-1
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=Q3kJ·mol-1。
若使用23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
A. Q1+Q2+Q3 B. 0.5(Q1+Q2+Q3)
C. 1.5Q1-0.5Q2+0.5Q3 D. 0.5Q2-1.5Q1-0.5Q3
4、下列说法或表示法不正确的是( )
A. 测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸起始温度、NaOH
起始温度和反应后的终止温度
B. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为H2(g)+1/2O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1
C. Zn(s)+CuSO4(aq)== ZnSO4(aq)+Cu(s) ΔH=-216 kJ/mol,E反应物>E生成物
D. 放热反应不需要任何条件即可发生
5、已知:2SO2(g)+O2(g) 2SO3(g);ΔH=-196.6 kJ/mol。实验室测得4 mol SO2发生上述化学反应时放出314.3 kJ热量,SO2的转化率最接近于( )
A. 40% B. 50% C. 80% D. 90%
6、关于反应:①2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH=-2600 kJ·mol-1;
②2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1;
③CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+216 kJ·mol-1。
下列叙述正确的是( )
A. CO的燃烧热为-283 kJ·mol-1
B. 在③进行时,若加入催化剂,可以使ΔH减小
C. 若生成相同质量的CO2,C2H2放出的热量大于CO
D. 若有3.2 g CH4与足量水蒸气按③反应,则放出的热量是43.2 kJ
7、已知2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol
CO(g)+1/2O2(g)=CO2(g) ΔH=-282.9 kJ/mol
某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,则原混合气体中H2和CO的物质的量之比为( )
A. 2∶1 B. 1∶2 C. 1∶1 D. 2∶3
8、已知胆矾溶于水时溶液温度降低,室温下将1 mol无水硫酸铜制成溶液时放出热量为Q1。而胆矾分解的热化学方程式为:CuSO4·5H2O(s)===CuSO4(s)+5H2O(l);ΔH=+Q2 kJ·mol-1则Q1和Q2的关系为( )
A. Q1
Q2 C. Q1=Q2 D. 无法确定
9、下列图示关系不正确的是( )
A. A B. B C. C D. D
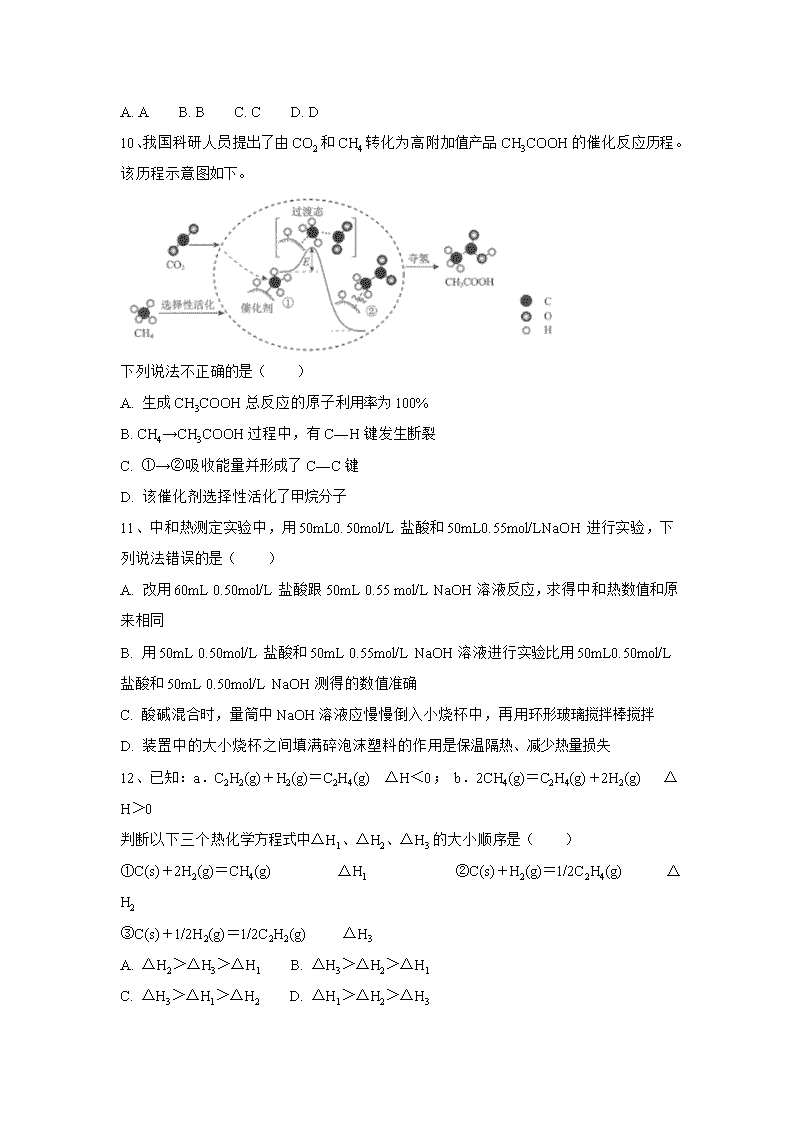
10、我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
下列说法不正确的是( )
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②吸收能量并形成了C―C键
D. 该催化剂选择性活化了甲烷分子
11、中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法错误的是( )
A. 改用60mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液反应,求得中和热数值和原来相同
B. 用50mL 0.50mol/L盐酸和50mL 0.55mol/L NaOH溶液进行实验比用50mL0.50mol/L盐酸和50mL 0.50mol/L NaOH测得的数值准确
C. 酸碱混合时,量筒中NaOH溶液应慢慢倒入小烧杯中,再用环形玻璃搅拌棒搅拌
D. 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失
12、已知:a.C2H2(g)+H2(g)=C2H4(g) △H<0; b.2CH4(g)=C2H4(g)+2H2(g) △H>0
判断以下三个热化学方程式中△H1、△H2、△H3的大小顺序是( )
①C(s)+2H2(g)=CH4(g) △H1 ②C(s)+H2(g)=1/2C2H4(g) △H2
③C(s)+1/2H2(g)=1/2C2H2(g) △H3
A. △H2>△H3>△H1 B. △H3>△H2>△H1
C. △H3>△H1>△H2 D. △H1>△H2>△H3
13、通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) ΔH1=571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g)ΔH2=131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH3=206.1kJ·mol–1
A. 反应①中电能转化为化学能
B. 反应②为放热反应
C. 反应③使用催化剂,ΔH3减小
D. 反应CH4(g)=C(s)+2H2(g)的ΔH3=74.8kJ·mol–1
14、下列说法正确的是( )
A. S(s)+3/2O2(g)=SO3 (g) △H=-315kJ·mol-1(燃烧热)(△H的数值正确)
B. 氢气的燃烧热为285.5kJ?mol-1,则2H2O(l)=2H2(g)+O2(g) △H=+285.5kJ?mol-1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)2NH3(g) △H=-92.4kJ?mol-1;将3 mol H2和过量的N2在此条件下充分反应,放出的热量小于92.4kJ
D. 已知HCl和NaOH反应的中和热△H=-57.3 kJ·mol-1,则HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(aq) △H=-57.3 kJ·mol-1
15、依据题意,完成下列各题:
(1)1.0 g乙醇完全燃烧生成液态水放出1.37 kJ热量,表示乙醇的燃烧热的热化学方程式为__________________________________________________;
(2) “长征”2号火箭的发动机中用“偏二甲肼”(分子式为C2H8N2)和四氧化二氮作为液态燃料。已知a g偏二甲肼与b g四氧化二氮在发动机内燃烧生成稳定的、对环境友好的物质。若生成1 mol N2(g) 的反应热为c kJ,写出热化学方程式______________________________________________;
(3) T ℃时,如图所示, 对应的化学方程式为______________________;
(4) 向足量的H2SO4溶液中加入100 mL 0.4 mol·L-1的Ba(OH)2溶液,放出的热量是5.12 kJ。向足量的Ba(OH)2溶液中加入100 mL 0.4 mol·L-1的HCl溶液,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH=______________;
(5) 研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单地理解为断开1 mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
化学键
P—P
P—O
O==O
P==O
键能kJ/mol
197
360
499
x
已知白磷(P4)的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物(P4O10)的结构如图所示,则上表中x=_________________。
16、甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备。甲醛与气态甲醇之间转化的能量关系如图所示。
(1)甲醇催化脱氢转化为甲醛的反应是_______(填“吸热”或“放热”)反应;
(1)过程Ⅰ与过程Ⅱ的反应热______(填“相同”或“不同”),原因是___________________________________________________________;
(2)写出甲醇催化脱氢转化为甲醛的热化学方程式
__________________________________________________________;
(3) 甲醇催化脱氢转化为甲醛的过程中,如果要使反应温度维持在700℃,需向体系中通入空气,通过计算确定进料甲醇与空气的物质的量理论比值为___________________________。(假设:H2(g)+1/2O2(g)===H2O(g) ΔH=-a kJ·mol-1,空气中氧气含量为20%)
17、(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能最为E2,且E1>E2,则该反应为_____,(填“吸热”或“放热”)反应。
②已知拆开1molH-H键,1molN-H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________。
(2)N2H4和H2O2混合可作火箭推进剂,已知: 16g液态N2H4和足量氧气反应生成N2(g)和H2O(1),放出310.6 kJ的热量,2H2O2(1)=O2(g)+2H2O(1) ΔH=-196.4kJ/mol.反应N2H4(1)+2H2O2(g)=N2(g)+4H2O(l)的△H=_____kJ·mol-1.
(3)实验室用50mL 0.50mol/L盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为_______;实验室提供了0.50mol/L和0.55mol/L两种浓度的NaOH溶液。应选择_____mol/L的溶液进行实验。
18、CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品。
(1)用CO2来生产燃料甲醇的方法,可以将CO2变废为宝。
已知在常温常压下,甲醇、CO的燃烧热分别是726.5kJ·mol-1、110.5 kJ·mol-1。写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____;
(2)CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g) +Cl2(g) COCl2(g) ΔH = a kJ/mol反应过程中测定的部分数据如下表:
t/min
n(CO)/mol
n(Cl2)/mol
0
1.20
0.60
1
0.90
2
0.80
4
0.20
①反应0~2min末的平均速率v(COCl2)=__________mol/(L·min)。
②在2min~4min间,v(Cl2)正______v(Cl2)逆 (填“>”、“=”或“<”), 该温度下K =______。
③已知X、L可分别代表温度或压强,右图表示L一定时,CO的 转化率随X的变化关系。X代表的物理量是__________;a_________0 (填“>”,“=”,“<”)。
(3)在催化剂作用下NO和CO转化为无毒气体:
2CO(g)+2NO(g)2CO2 (g)+N2 (g)
ΔH=-748 kJ·mol-1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是____________________。
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为______________________;方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式_______________。
(4)用CO和H2可以制备甲醇,反应为CO(g)+2H2(g) CH3OH(g
),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是_______________。
19、近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________、____________________________,制得等量H2所需能量较少的是_____________。
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中。2 min后,反应达到平衡,水的物质的量为0.01mol。
① H2S的平衡转化率α=_______%
②从反应开始到平衡,CO2的平均反应速率为_________________
(3)在一定条件下,用H2O2氧化H2S。随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。在酸性溶液中,当n(H2O2)/n(H2S)=4时,写出离子方程式___________________________________。
20、碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源 物质。请回答下列问题:
(1)有机物 M 经过太阳光光照可转化成 N,转化过程如下:
ΔH=+88.6 kJ·mol-1。则 M、N 相比,较稳定的是_____。
(2已知 CH3OH(l)的燃烧热ΔH=-726.5 kJ·mol-1,CH3OH(l)+1/2O2(g)===CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则 a_____726.5(填“>”“<”或“=”)。
(3)使 Cl2 和 H2O(g)通过灼热的炭层,生成 HCl 和 CO2,当有 1 mol Cl2 参与反应时释 放出 145 kJ 热量,写出该反应的热化学方程式:_____。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合 在高温下煅烧,所得物质可作耐高温材料,4Al(s) +3TiO2(s) +3C(s)=2Al2O3(s) +3TiC(s) ΔH =-1176 kJ·mol-1 ,则反应过程中,每转移 1 mol 电子放出的热量为________。
21、丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)= 3CO2(g)+4H2O(l) ΔH1=-a kJ·mol-1
途径Ⅱ:C3H8(g)= C3H6(g)+H2(g) ΔH2=+b kJ·mol-1
2C3H6(g)+9O2(g)= 6CO2(g)+6H2O(l) ΔH3=-c kJ·mol-1
2H2(g)+O2(g)= 2H2O(l) ΔH4=-d kJ·mol-1(a、b、c、d均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量____(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)由于C3H8(g)= C3H6(g)+H2(g)的反应中,反应物具有的总能量____(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要___(填“放出”或“吸收”)能量才能转化为生成物,因此其反应条件是____。
(3)b与a、c、d的数学关系式是_______。
参考答案
1、【答案】B
【解析】解:A、由图1可知:N2O(g)→N2(g)△H1,CO(g)→CO2(g)△H2,根据盖斯定律,△H=△H1+△H2,故A错误;B、由图2可知,反应物为N2O(g)+CO(g),生成物为CO2(g)+N2(g),△H =134kJ/mol-360kJ/mol=-226 kJ/mol,故B正确;C、由图1可知,Pt2O+是催化剂,转化过程中无需不断向反应器中补充催化剂,故C错误;D、由图2可知该反应正反应的活化能小于逆反应的活化能,故D错误;故选B。
2、【答案】D
【解析】解:A.根据③:Sn(s,灰) Sn(s,白)ΔH3=+2.1kJ·mol-1,则②-①=③,所以△H2-ΔH1=ΔH3>0,所以ΔH1<ΔH2,故A错误;
B.根据③:Sn(s,灰) Sn(s,白),当温度>13.2℃时,灰锡转化为白锡,则锡在常温下以白锡状态存在,故B错误;
C.根据ΔH3=+2.1kJ·mol-1,焓变大于0,所以灰锡转为白锡的反应是吸热反应,故C错误;
D.根据③:Sn(s,灰) Sn(s,白)ΔH3=+2.1kJ·mol-1,当温度<13.2℃时,会自行毁坏,故D正确;
故选D。
3、【答案】C
【解析】 已知:①H2O(g)===H2O(l) ΔH1=Q1kJ·mol-1;②C2H5OH(g)===C2H5OH(l) ΔH2=Q2kJ·mol-1;③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=Q3kJ·mol-1;根据盖斯定律可以知道, ①×3-②+③得C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=(3Q1+Q3- Q2)kJ·mol-1;即1mol液态酒精完全燃烧并恢复至室温,则放出的热量为(3Q1+Q3-Q2)kJ,则23 g(即0.5mol)液态酒精完全燃烧并恢复至室温,则放出的热量为(1.5Q1+0.5Q3- 0.5Q2)kJ·;综上所述,本题选C。
4、【答案】D
【解析】 A、测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸起始温度、NaOH起始温度和反应后最高温度,故A正确;
B、2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为H2(g)+1/2O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1,故B正确;
C. Zn(s)+CuSO4(aq)== ZnSO4(aq)+Cu(s) ΔH=-216 kJ/mol,反应放热,反应物的总能量大于生成物的总能量,即E反应物>E生成物,故C正确;
D. 放热反应不一定不用加热就能进行,如铝热反应,为放热反应,但应在高温下才能进行,故D错误;
综上所述,本题选D。
5、【答案】C
【解析】
2SO2(g)+O2(g)═2SO3(g);△H=-196.6kJ/mol
2mol 196.6KJ
n 314.3kJ
n==3.20mol,SO2的转化率=×100%=80%,故选C。
6、【答案】C
【解析】 A.燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,由2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1知,CO的燃烧热为283 kJ·mol-1,故A错误;
B.焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,在反应体系中加入催化剂,催化剂改变反应速率,不改变化学平衡,反应热不变,故B错误;
C.假设都生成2molCO2, C2H2燃烧放出1300 kJ热量,CO燃烧放出566 kJ,前者大于后者,故C正确;
D. 3.2gCH4物质的量为0.2mol,0.2molCH4与足量水蒸气按③反应,则吸收的热量是43.2 kJ,故D错误;
7、【答案】C
【解析】
水的物质的量为 0.2mol,由2H2+O2═2H2O可知,n(H2)=n(H2O)=0.2mol,由2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1可知,0.2molH2燃烧放出的热量为57.16KJ,则CO燃烧放出的热量为113.74KJ-57.16KJ=56.58KJ,设混合气体中CO的物质的量为x,
则
解得x=0.2mol,即n(CO)=0.20mol,
则原混合气体中H2和CO的物质的量之比为1:1,故C正确。
8、【答案】A
【解析】 根据题的叙述可把胆矾溶于水看成二个过程,第一个过程是:CuSO4?5H2OCuSO4(s)+5H2O;△H=+Q2KJ/mol这一过程是吸出热量的,一摩尔CuSO4 ?5H2O分解吸收的热量为Q2KJ;第二过程是:无水硫酸铜制成溶液的过程,此过程是放出热量的,1mol无水硫酸铜制成溶液时放出热量为Q1KJ,但整个过程要使溶液温度降低,说明吸收的热量大于放出的热量,所以Q2>Q1,故选A。
9、【答案】B
【解析】A.
物质的燃烧和中和反应均为化学反应,故燃烧热和中和热均属于反应热,两者是并列关系,A正确。
B.能源分为一次能源和二次能源,一种能源不可能同时是一次能源和二次能源,二者为并列关系,而非交叉关系,B错误。
C.氧化还原反应既有放热反应又有吸热反应,非氧化还原反应也有放热反应又有吸热反应,C正确。
D.根据能源的分类可知,有太阳能、新能源、可再生能源、沼气等,D正确。
10、【答案】C
【解析】 A项,根据图示CH4与CO2在催化剂存在时生成CH3COOH,总反应为CH4+CO2CH3COOH,只有CH3COOH一种生成物,原子利用率为100%,A项正确;
B项,CH4选择性活化变为①的过程中,有1个C-H键发生断裂,B项正确;
C项,根据图示,①的总能量高于②的总能量,①→②放出能量,对比①和②,①→②形成C-C键,C项错误;
D项,根据图示,该催化剂选择性活化了甲烷分子,D项正确;
答案选C。
11、【答案】C
【解析】 A项,改用60mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液反应,反应放出的热量不相等,但中和热以生成1molH2O(l)为标准,求得中和热数值和原来相同,A项正确;
B项,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验比用50mL0.50mol/L盐酸和50mL0.50mol/LNaOH测得的数值准确,原因是NaOH溶液稍过量能保证盐酸完全中和,B项正确;
C项,酸碱混合时,应将量筒中NaOH溶液一次性快速倒入小烧杯中,盖好盖板,用环形玻璃搅拌棒轻轻搅拌,以减少热量的损失,C项错误;
D项,装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失,D项正确;
12、【答案】B
【解析】 应用盖斯定律,将②×2-③×2得a,2ΔH2-2ΔH3<0,则ΔH3>ΔH2;将②×2-①×2得b,2ΔH2-2ΔH1>0,则ΔH2>ΔH1;则ΔH3>ΔH2>ΔH1,答案选B。
13、【答案】D
【解析】 A项,反应①中光能转化为化学能,故A项错误;
B项,反应②的ΔH >0,该反应为吸热反应,故B项错误;
C项,催化剂能改变反应速率,但对化学平衡和反应热没有影响,故C项错误。
D项,根据盖斯定律,③-②得CH4(g)=C(s)+2H2(g)的ΔH3=+74.8kJ·mol–1,故D项正确;
14、【答案】C
【解析】 A项,S(s)完全燃烧生成的稳定氧化物为SO2(g),不是SO3(g),A项错误;
B项,H2的燃烧热为285.5kJ/mol,指1molH2完全燃烧生成1molH2O(l)放出285.5kJ的热量,H2燃烧热表示的热化学方程式为H2(g)+O2(g)=H2O(l)ΔH=-285.5kJ/mol,则2H2O(l)=2H2(g)+O2(g)ΔH=+571kJ/mol,B项错误;
C项,由于N2与H2化合成NH3的反应为可逆反应,3molH2不可能完全反应,3molH2与过量N2在此条件下充分反应放出的热量小于92.4kJ,C项正确;
D项,HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)ΔH=-57.3kJ/mol,D项错误;
答案选C。
15、【答案】 (1). C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)ΔH=-63.02 kJ·mol-1 (2). C2H8N2(l)+2N2O4(l)===2CO2(g)+3N2(g)+4H2O(l) ΔH=-3c kJ·mol-1 (3). A(g)+3B(g) 2C(g) (4). -18 kJ·mol-1 (5). 433.75 kJ·mol-1
【解析】 (1)1.0 g乙醇完全燃烧生成液态水放出1.37 kJ热量,46.0 g乙醇完全燃烧生成液态水放出 63.02kJ热量, 表示乙醇的燃烧热的热化学方程式为: C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)ΔH=-63.02 kJ·mol-1;综上所述,本题答案是:C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)ΔH=-63.02 kJ·mol-1。
(2)由题意可知 C2H8N2与N2O4可以发生氧化还原反应,反应方程式C2H8N2+2N2O4=2CO2+4H2O+3N2;据反应可知生成3molN2时放出热量为3ckJ,因此热化学反应方程式为C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-3c kJ·mol-1;综上所述,本题答案是:C2H8N2(l)+2N2O4(l)===2CO2(g)+3N2(g)+4H2O(l) ΔH=-3c kJ·mol-1。
(3) T ℃时,通过图示可知,A 、B的浓度均减小,C的浓度增大,A 、B为反应物,C为生成物;A 减小0.2mol/L,B减小0.6mol/L,C增加0.4 mol/L,系数比和浓度的变化量成正比,因此对应的化学方程式为:A(g)+3B(g) 2C(g);综上所述,本题答案是:A(g)+3B(g) 2C(g)。
(4)100 mL 0.4 mol·L-1的Ba(OH)2溶液中Ba(OH)2的物质的量为0.04mol,足量H2SO4溶液中加入100 mL 0.4 mol·L-1的Ba(OH)2溶液,放出的热量是5.12 kJ ,则1 mol Ba(OH)2 参与反应时,放出的热量为5.12/0.04=128 kJ ,则有①2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l),ΔH1 =-128 kJ·mol-1;100 mL 0.4 mol·L-1盐酸中HCl的物质的量为0.04mol,足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ ,则2molHCl 参与反应时放出的热量为2×2.2/0.04=110 kJ·mol-1,则有②2H+(aq)+ 2OH-(aq)=2H2O(l),ΔH2 =-110 kJ·mol-1,根据盖斯定律①-②可得,SO42-(aq)+Ba2+(aq)= BaSO4(s) ΔH=ΔH1-ΔH2=-18 kJ·mol-1;综上所述,本题答案是:-18 kJ·mol-1 。
(5) 白磷燃烧的方程式为P4+5O2===P4O10 ΔH =-2378 kJ·mol-1,1mol白磷完全燃烧需拆开6molP-P、5molO=O,形成12molP-O、4molP=O,所以12mol×360kJ/mol+4mol×xkJ/mol-(6mol×197 kJ/mol+5 mol×499 kJ/mol)=2378.0kJ,x=433.75;综上所述,本题答案是:433.75 kJ·mol-1。
16、【答案】 (1). 吸热 (2). 相同 (3). 一个化学反应的反应热仅与反应的始态和终态有关,而与反应的途径无关 (4). CH3OH(g)===HCHO(g)+H2(g) ΔH=+(E2-E1) kJ·mol-1 (5). n(CH3OH)∶n(空气)=2a∶5(E2-E1)
【解析】 (1)通过图示变化可知,反应物的总能量小于生成物总能量,该反应为吸热反应;相对于过程Ⅰ,过程Ⅱ为降低了反应活化能,加入了催化剂,但是不影响反应的反应热,因为一个化学反应的反应热仅与反应的始态和终态有关,而与反应的途径无关,所以过程Ⅰ与过程Ⅱ的反应热相同;综上所述,本题答案是:吸热,相同 ,一个化学反应的反应热仅与反应的始态和终态有关,而与反应的途径无关。
(2) 通过图象可以看出,反应物的总能量比生成物的总能量低,故为吸热反应,反应热=生成物总能量-反应物的总能量=(E2-E1) kJ·mol-1,甲醇催化脱氢转化为甲醛的热化学方程式:CH3OH(g)===HCHO(g)+H2(g) ΔH=+(E2-E1) kJ·mol-1 ;综上所述,本题答案是:CH3OH(g)===HCHO(g)+H2(g) ΔH=+(E2-E1) kJ·mol-1。
(3) 反应维持在一定温度持续进行,应保证反应:H2(g)+1/2O2(g)===H2O(g) ΔH=-a
kJ·mol-1,放出的热量恰好被反应CH3OH(g)=CH2O(g)+H2(g) ΔH=+(E2-E1) kJ·mol-1全部利用,即CH3OH反应吸收的热量等于氢气燃烧放出的热量,设需甲醇的物质的量为n(CH3OH),需氧气的物质的量为n(O2),则有: n(CH3OH)×(E2-E1)= n(O2)×2×a,计算得出:甲醇与氧气的物质的量之比n(CH3OH):n(O2)= 2a:(E2-E1),根据空气中氧气的体积分数0.2,即可得出n(CH3OH):n(空气)= 2a:5(E2-E1);因此本题答案是:n(CH3OH)∶n(空气)=2a∶5(E2-E1)。
17、【答案】(1) ① 放热
②N2(g)+3H2(g)2NH3(g) △H=-92kJ/mol
(2) -817.6
(3) 环形玻璃搅拌棒 ; 0.55
【解析】解:(1)①反应物的总能量为E1,生成物的总能量为E2,而当反应物的总能量大于生成物的总能量时,E1>E2,反应为放热反应;
②在反应N2+3H22NH3中,断裂3molH-H键,1mol NN键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,即N2(g)+3H2(g)2NH3(g)△H=-92kJ·mol-1;
(2)16g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6kJ的热量,热化学方程式为N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-621.2 kJ·mol-1 ①
2H2O2(l)=2H2O(l)+O2(g)△H=-196.4kJ·mol-1 ②
根据盖斯定律,①+②得:N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-817.6kJ·mol-1 ;
(3)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;实验室提供了0.50mol·L-1和0.55mol·L-1两种浓度的NaOH溶液,为了使反应充分,NaOH应过量,所以选择0.55mol·L-1的溶液进行实验。
18、【答案】 CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-616 kJ·mol-1 0.1 = 5 温度 < 温度升高到710K时,反应达到平衡状态,由于该反应是放热反应,升高温度,平衡逆向移动,氮氧化物转化率降低 CO-2e-+H2O=CO2+2H+ 2NO+3H2O2=2NO3-+2H2O+2H+ c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
【解析】(1)由于甲醇、CO的燃烧热分别是726.5kJ·mol-1、110.5 kJ·mol-1所以可知①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H =-1453 kJ·mol-1②2CO(g)+O2
(g)=2CO2(g)△H =-221 kJ·mol-1,由①-②可得2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l) △H=-1232 kJ·mol-1,所以甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-616 kJ·mol-1。答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-616 kJ·mol-1
(2)①由表中数据,可知0~2min内△n(CO)=1.2mol-0.8mol=0.4mol,
由方程式可知,所以v(COCl2)==0.1 mol/(L·min);②4min内,反应的氯气为:0.6mol-0.2mol=0.4mol,由方程式可知参加反应的CO为0.4mol,故4min时CO为1.2mol-0.4mol=0.8mol,与2min时CO的物质的量相等,则2min、4min处于平衡状态,在2min~4min间,v(Cl2)正=v(Cl2)逆,
由方程式可知,平衡时生成COCl2为0.4mol,该温度下平衡常数K===5③正反应为气体体积减小的反应,增大压强平衡正向移动,CO转化率增大,而图中随X增大时,CO的平衡转化率降低,平衡逆向移动,则X为温度,正反应为放热反应.答案为:① 0.1 ② = 、 5 ③ 温度 、<
(3)①当温度升高到710K时,单位时间内反应达平衡,由于该反应是放热反应,再升高温度,平衡向左移动,转化率降低②该装置是原电池,通入一氧化碳的电极是负极,负极上一氧化碳失电子发生氧化反应,电极反应式为:CO-2e-+H2O=CO2+2H+,NO被H2O2溶液氧化成强酸硝酸,双氧水被还原成水,则反应的离子方程式2NO+3H2O2=2NO3-+2H2O+2H+ 答案为:①温度升高到710K时,反应达到平衡状态,由于该反应是放热反应,升高温度,平衡逆向移动,氮氧化物转化率降低② CO-2e-+H2O=CO2+2H+ 、2NO+3H2O2=2NO3-+2H2O+2H+
(4)当有0.5mol甲醇参与反应时,产生的二氧化碳是0.5mol,和0.8mol氢氧化钾反应,根据元素守恒可以计算n(K2CO3)=0.3mol,n(KHCO3)=0.2mol,二者的水溶液均为碱性,所以c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)答案为:c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
19、【答案】 (1). H2O(l)=H2(g)+1/2O2(g) ΔH=+286 kJ/mol (2). H2S(g)=H2(g)+S(s)
ΔH=+20 kJ/mol (3). 系统(II) (4). 2.5 (5). 0.002mol/(L?min) (6). 4H2O2+H2S=SO42—+ 2H++ 4H2O
【解析】 (1)系统(I)中发生的反应有:H2SO4(aq)=SO2(g)+H2O(l)+O2(g)ΔH1=327kJ/mol(①)、SO2(g)+I2(s)+2H2O(l)=2HI(aq)+H2SO4(aq)ΔH2=-151kJ/mol(②)、2HI(aq)=H2(g)+I2(s)ΔH 3=110kJ/mol(③),应用盖斯定律,将①+②+③得,系统(I)中制氢的热化学方程式为H2O(l)=H2(g)+O2(g)ΔH=327kJ/mol+(-151kJ/mol)+110kJ/mol=+286kJ/mol。系统(II)中发生的反应有:SO2(g)+I2(s)+2H2O(l)=2HI(aq)+H2SO4(aq)ΔH2=-151kJ/mol(②)、2HI(aq)=H2(g)+I2(s)ΔH 3=110kJ/mol(③)、H2S(g)+H2SO4(aq)=S(s)+SO2(g)+2H2O(l)ΔH4=61kJ/mol(④),应用盖斯定律,将②+③+④得,系统(II)制氢的热化学方程式为H2S(g)=H2(g)+S(s)ΔH=(-151kJ/mol)+110kJ/mol+61kJ/mol=+20kJ/mol。根据上述热化学方程式,制得等量H2所需能量较少的是系统(II)。
(2)用三段式, H2S(g)+CO2(g)COS(g)+H2O(g)
c(起始)(mol/L)0.16 0.04 0 0
c(转化)(mol/L)0.004 0.004 0.004 0.004
c(平衡)(mol/L)0.156 0.036 0.004 0.004
①H2S的平衡转化率α=×100%=2.5%。
②从反应开始到平衡,CO2的平均反应速率υ(CO2)==0.002mol/(L·min)。
(3)H2O2将H2S氧化,H2O2被还原成H2O,1molH2O2得到2mol电子,4molH2O2参与反应得到8mol电子,当n(H2O2)/n(H2S)=4时,根据得失电子守恒,1molH2S参与反应失去8mol电子,H2S的氧化产物为H2SO4,根据得失电子守恒、原子守恒和电荷守恒,当n(H2O2)/n(H2S)=4时,反应的离子方程式为4H2O2+H2S=SO42-+2H++4H2O。
20、【答案】 (1). M (2). < (3). 2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH=-290 kJ·mol-1 (4). 9 8 kJ
【解析】 (1)有机物M经过太阳光光照可转化成N:△H=+88.6kJ·mol-1
,过程是吸热反应,N暗处转化为M,是放热反应,能量越低越稳定,M稳定;
(2)燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量小于燃烧热;
(3)1molCl2参与反应时释放出145KJ热量,则反应2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)会放出290KJ的能量,即2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)△H=-290.0 kJ·mol-1;
(4)4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1176kJ?mol-1,转移12mol电子放热1176KJ,则反应过程中,每转移1mol电子放热98kJ;
21、【答案】 (1). 等于 (2). 小于 (3). 吸收 (4). 加热 (5). 2b=c+d-2a
【解析】 (1)根据盖斯定律,煤作为燃料不管是一步完成还是分两步完成,反应物和产物的焓值是一定的,所以两途径的焓变值一样,放出的热量一样,故答案为:等于;
(2)由于C3H8(g)= C3H6(g)+H2(g) ΔH2=+b kJ·mol-1)的反应中△H>0,该反应是吸热反应,反应物具有的总能量小于生成物的总能量,需要吸收能量,反应条件是加热,故答案为:小于;吸收;加热;
(3)途径I:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-a kJ?mol-1
途径II:②C3H8(g)═C3H6(g)+H2(g)△H=+b kJ?mol-1
③2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=-c kJ?mol-1
④2H2(g)+O2(g)═2H2O(l)△H=-d kJ?mol-1 反应①=反应②+反应③×1/2+反应④×1/2,所以-a=b+1/2(-c-d),所以2b=-2a+(c+d),故答案为:2b=-2a+(c+d)。