- 2021-04-13 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学复习——化学反应速率及其影响因素知识点复习
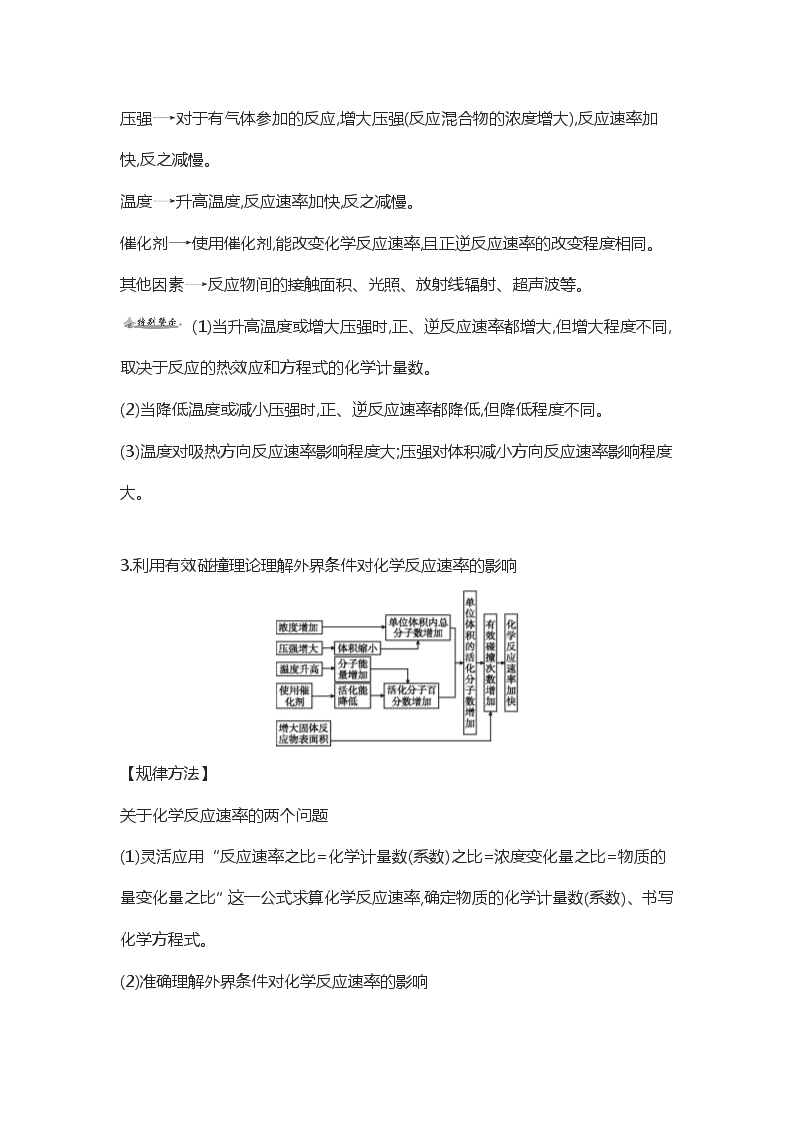
高考化学复习——《化学反应速率及其影响因素》知识点复习 一、化学反应速率及其影响因素 【知识整合】 1.化学反应速率 (1)概念:通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。 (2)表达式:v= 常用单位:mol·L-1·s-1、mol·L-1·min-1。 (3)速率大小判断方法:对同一个反应,用不同物质表示时,数值可能不同,比较的方法是将其换算为同一种物质再进行比较,同时,还要注意其单位是否统一,若单位不统一,要先将单位统一,否则可能会得出错误结论。 ①对反应物来说,Δc=c(始)-c(终);对生成物来说,Δc=c(终)-c(始)。 ②表示化学反应速率时,要注明具体物质。同一反应中,用不同的物质表示反应速率时,数值可能不同,但意义相同。各物质的化学反应速率之比等于反应方程式中的化学计量数(系数)之比。例如反应:mA(g)+nB(g)pC(g),其速率比为v(A)∶v(B)∶v(C)=m∶n∶p。 ③固体和纯液体的浓度视为常数,因此表示化学反应速率时一般不用固体或纯液体来表示。 2.外界条件对反应速率的影响 (其他条件不变,改变一个条件) 浓度增大反应物的浓度,反应速率增大,反之减小。 压强对于有气体参加的反应,增大压强(反应混合物的浓度增大),反应速率加快,反之减慢。 温度升高温度,反应速率加快,反之减慢。 催化剂使用催化剂,能改变化学反应速率,且正逆反应速率的改变程度相同。 其他因素反应物间的接触面积、光照、放射线辐射、超声波等。 (1)当升高温度或增大压强时,正、逆反应速率都增大,但增大程度不同,取决于反应的热效应和方程式的化学计量数。 (2)当降低温度或减小压强时,正、逆反应速率都降低,但降低程度不同。 (3)温度对吸热方向反应速率影响程度大;压强对体积减小方向反应速率影响程度大。 3.利用有效碰撞理论理解外界条件对化学反应速率的影响 【规律方法】 关于化学反应速率的两个问题 (1)灵活应用“反应速率之比=化学计量数(系数)之比=浓度变化量之比=物质的量变化量之比”这一公式求算化学反应速率,确定物质的化学计量数(系数)、书写化学方程式。 (2)准确理解外界条件对化学反应速率的影响 ①固体、纯液体的浓度视为定值,不因其量的增减而影响反应速率,但因表面积(接触面)的变化而改变反应速率。如将硫铁矿粉碎是为了增大接触面,加快反应速率。 ②改变压强,对化学反应速率产生影响的根本原因是引起浓度的改变。在讨论压强对反应速率的影响时,应区分引起压强改变的原因,这种改变对反应体系的浓度产生何种影响。 对于气体体系,有以下几种情况: 恒温时:增大压强体积缩小气体物质浓度增大反应速率加快 恒容时:a.充入气体反应物浓度增大总压增大反应速率加快 b.充入“惰气”总压增大(分压不变)各反应物浓度不变反应速率不变 恒压时:充入“惰气”体积增大各反应物浓度减小反应速率减慢 【典例1】 在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( ) A.图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响 B.图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响 C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高 D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 解析:图Ⅰ中t0时刻的v(正)、v(逆)都高于原平衡化学反应速率且v(正)>v(逆),应是增大体系的压强所致,A项错;图Ⅱ中图像显示v(正)=v(逆)都高于原平衡体系, 而体系中通入氦气,并未改变各组分的浓度,故不影响v(正)、v(逆),B项错;催化剂只能改变化学反应速率,对化学平衡无影响,因而加入催化剂后,甲、乙能达到同一平衡状态,C项错;图Ⅲ中乙比甲到达平衡所需时间短,其他条件不变时,T(乙)>T(甲),且此反应的ΔH<0,温度[由T(乙)→T(甲)]降低,α(SO2)降低,符合曲线变化,D项正确。 答案:D。 化学反应速率及其影响因素 1.一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是( ) A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等 B.溶液酸性越强,R的降解速率越小 C.R的起始浓度越小,降解速率越大 D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1 解析:由图像可看出,50 min时,pH=2和pH=7时R均完全降解,A正确;在反应物起始浓度小的情况下,pH=2时R的降解速率明显大于pH=7和pH=10时的降解速率,若起始浓度相等,pH=2时的降解速率会更大,说明酸性越强,R降解速率越大,B错误;图像中出现了两个影响速率的条件:反应物起始浓度和pH。因pH不同,不能由图像判断反应物浓度对反应速率的影响。对于所有的化学反应而言, 均为反应物浓度越大,反应速率越大,C错误;20~25 min之间,pH=10时R的平均降解速率为:= 4×10-6 mol·L-1·min-1,D错误。 答案:A。 此题以图像题的形式考查了影响反应速率的条件,且同时出现了两个影响速率的条件,考生容易错选C。 2.(双选题)对于可逆反应H2(g)+I2(g)2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( ) A.H2(g)的消耗速率与HI(g)的生成速率之比为2∶1 B.反应进行的净速率是正、逆反应速率之差 C.正、逆反应速率的比值是恒定的 D.达到平衡时,正、逆反应速率相等 解析:各物质的反应速率之比等于各物质化学计量数之比,H2的消耗速率与HI的生成速率之比为1∶2,A错;该反应进行的净速率是指某一物质的正反应速率与逆反应速率之差,B正确;随反应进行正反应速率在减小,逆反应速率在增大,二者之比逐渐减小,C错;正、逆反应速率相等是平衡建立的特征,D正确。 答案:BD。 3.对于化学反应3W(g)+2X(g)4Y(g)+3Z(g),下列反应速率关系中,正确的是( ) A.v(W)=3v(Z) B.2v(X)=3v(Z) C.2v(X)=v(Y) D.3v(W)=2v(X) 解析:用不同物质表示同一反应的反应速率时,其速率值之比等于其化学计量数之比,即===,故C正确。 答案:C。 4.化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( ) A.2.5 μmol·L-1·min-1和2.0 μmol·L-1 B.2.5 μmol·L-1·min-1和2.5 μmol·L-1 C.3.0 μmol·L-1·min-1和3.0 μmol·L-1 D.5.0 μmol·L-1·min-1和3.0 μmol·L-1 解析:分析图像可知,在4~8 min时间段内反应物的浓度由20 μmol·L-1下降到10 μmol·L-1,浓度变化量为10 μmol·L-1,故反应速率为=2.5 μmol·L-1·min-1。随着反应的进行,反应速率逐渐减慢,大致的变化规律是反应每进行4 min,反应速率降低一半,所以当反应进行到16 min时,反应物的浓度降到大约2.5 μmol·L-1。 答案:B。 5.碘在科研与生活中有重要应用。某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。 已知:S2+2I-2S+I2(慢) I2+2S22I-+S4(快) (1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色,S2与S2初始的物质的量需满足的关系为:n(S2)∶n(S2) 。 (2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表: 实验 序号 体积V/mL K2S2O8溶液 水 KI溶液 Na2S2O3溶液 淀粉溶液 ① 10.0 0.0 4.0 4.0 2.0 ② 9.0 1.0 4.0 4.0 2.0 ③ 8.0 Vx 4.0 4.0 2.0 表中Vx= mL,理由是 。 (3)已知某条件下,浓度c(S2)反应时间t的变化曲线如图,若保持其他条件不变, 请在答题卡坐标图中,分别画出降低反应温度和 加入催化剂时c(S2)t的变化曲线示意图(进行相应的标注)。 (4)碘也可用作心脏起搏器电源-锂碘电池的材料。该电池反应为:2Li(s)+I2(s)2LiI(s) ΔH 已知:4Li(s)+O2(g)2Li2O(s) ΔH1 4LiI(s)+O2(g)2I2(s)+2Li2O(s) ΔH2 则电池反应的ΔH= ;碘电极作为该电池的 极。 解析:(1)根据提供的2个反应可知,当S2耗尽后,生成的I2不再被转化为I-,溶液变为蓝色,若要保证能看到蓝色需有I2剩余。所以n(S2)∶n(S2)<2∶1。 (2)由表格可知溶液的总体积V是定值,所以三次实验的总体积应该是20.0 mL,所以Vx应为2 mL。 (3)降温会使反应速率减慢,加入催化剂会加快反应。 (4)4Li(s)+O2(g)2Li2O(s) ΔH1① 4LiI(s)+O2(g)2I2(s)+2Li2O(s) ΔH2② 由①-②得:2Li(s)+I2(s)2LiI(s) ΔH=, I2I-发生还原反应,做正极。 答案:(1)S2 <2∶1 (2)2 为完成实验目的,①②③三组实验中总体积应该是20.0 mL (3)如图 (4)ΔH= 正 本题主要考查了化学反应原理的知识,涉及化学反应速率,焓变计算和原电池等知识,主要目的是考查学生分析问题,解决问题的能力,难度中。 6.臭氧是一种强氧化剂,常用于消毒、灭菌等。 (1)O3与KI溶液反应生成的两种单质是 和 (填分子式)。 (2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.021 6 mol/L。 表 ppHtt/minT/℃ 3.0 4.0 5.0 6.0 20 301 231 169 58 30 158 108 48 15 50 31 26 15 7 ①pH增大能加速O3分解,表明对O3分解起催化作用的是 。 ②在30 ℃、pH=4.0条件下,O3的分解速率为 mol/(L·min)。 ③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为 (填字母代号)。 a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0 (3)O3可由臭氧发生器(原理如图)电解稀硫酸制得。 ①图中阴极为 (填“A”或“B”),其电极反应式为 。 ②若C处通入O2,则A极的电极反应式为 。 ③若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为 。(忽略O3的分解) 解析:(1)O3具有氧化性可把I-氧化为I2同时生成O2。 (2)①pH增大,OH-浓度增大,加速了O3分解,表明OH-对O3分解具有催化作用。 ②30 ℃、pH=4.0时,O3分解的Δc==0.010 8 mol/L,用时108 min,则O3分解速率v==1.00×10-4mol/(L·min)。 ③据表中递变规律,40 ℃、pH=3.0时,所用时间介于31 min~158 min;10 ℃、pH=4.0时所用时间>231 min;30 ℃、pH=7.0时所用时间<15 min,而浓度变化同为0.0108 mol/L,则分解速率依次增大顺序为:b查看更多