- 2021-04-13 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届浙江学考一轮复习考点精讲通用版考点32原电池的工作原理学案
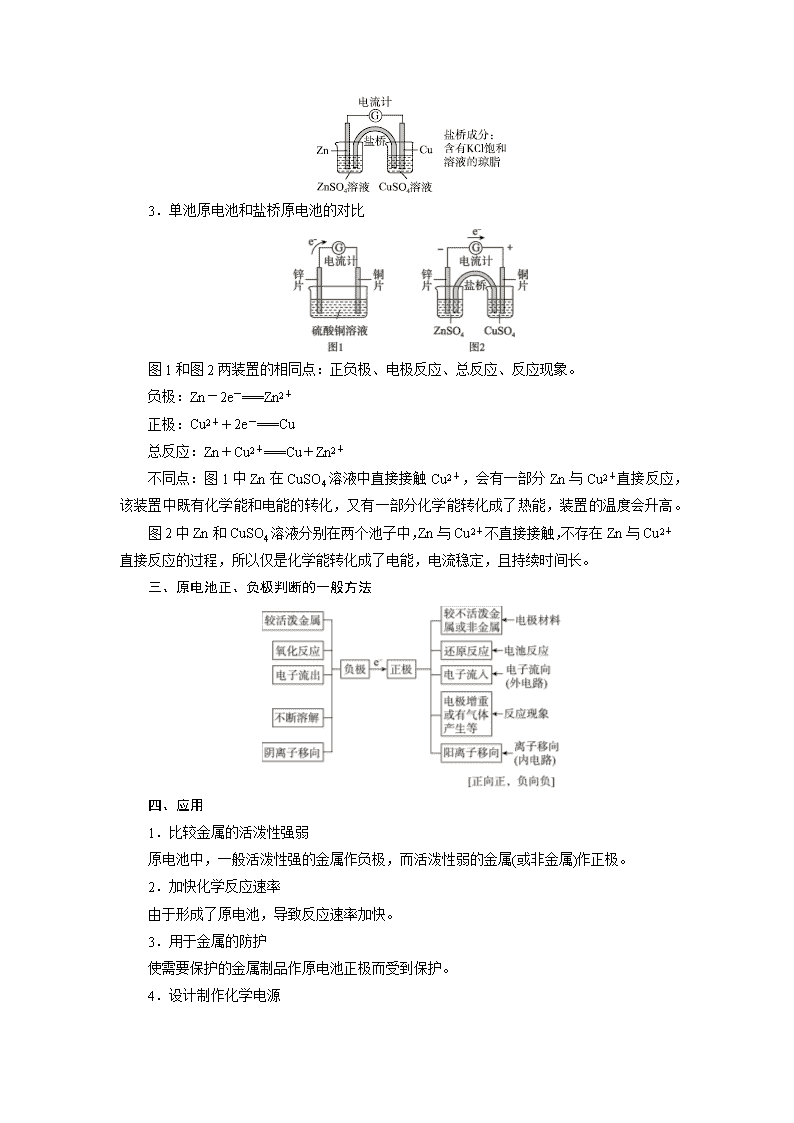
考点32 原电池的工作原理 知识条目 必考要求 加试要求 1.原电池的概念 a a 2.铜-锌原电池的原理及电极反应式 b b 3.原电池的构成条件 a b 4.原电池的构造与工作原理,盐桥的作用 b 5.判断与设计简单的原电池 c 6.原电池的电极反应式及电池反应方程式 b 7.原电池的正、负极和电子流向的判断 c 一、概念 把化学能转化成电能的装置。 二、工作原理 1.单池原电池(以铜锌原电池为例) 电极名称 负极 正极 电极材料 锌片 铜片 电极反应 Zn-2e-===Zn2+ Cu2++2e-===Cu 反应类型 氧化反应 还原反应 电子流向(外电路) 由锌电极经过导线流向铜电极 离子移动方向(内电路) SO移向负极,Cu2+移向正极 2.盐桥原电池(加试) 盐桥的作用:a.连接内电路,形成闭合回路;b.平衡电荷,使原电池不断产生电流。 3.单池原电池和盐桥原电池的对比 图1和图2两装置的相同点:正负极、电极反应、总反应、反应现象。 负极:Zn-2e-===Zn2+ 正极:Cu2++2e-===Cu 总反应:Zn+Cu2+===Cu+Zn2+ 不同点:图1中Zn在CuSO4溶液中直接接触Cu2+,会有一部分Zn与Cu2+直接反应,该装置中既有化学能和电能的转化,又有一部分化学能转化成了热能,装置的温度会升高。 图2中Zn和CuSO4溶液分别在两个池子中,Zn与Cu2+不直接接触,不存在Zn与Cu2+直接反应的过程,所以仅是化学能转化成了电能,电流稳定,且持续时间长。 三、原电池正、负极判断的一般方法 四、应用 1.比较金属的活泼性强弱 原电池中,一般活泼性强的金属作负极,而活泼性弱的金属(或非金属)作正极。 2.加快化学反应速率 由于形成了原电池,导致反应速率加快。 3.用于金属的防护 使需要保护的金属制品作原电池正极而受到保护。 4.设计制作化学电源 【例1】 下列说法正确的是( ) A.构成原电池的两个电极必须是活泼性不同的两种金属 B.右图原电池中,电流由锌棒经外电路流向铜棒 C.通过构成原电池,能将反应的化学能全部转化为电能 D.银锌纽扣电池的放电反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应 【解析】 原电池的两个电极也可以是一种金属和一种非金属,比如石墨,故A错;电子由负极流向正极而电流是由正极经外电路流向负极,B错;原电池把化学能大部分转化成电能,也有一部分转化为热能,C错。 【答案】 D 【提炼】 原电池就是一种将化学能转化为电能的装置,其两个电极由两种活泼性不同的金属或金属与其他能导电的材料(非金属或某些氧化物等)组成。外电路电子从原电池的负极流出,沿导线流向正极,而内电路是离子的定向移动,阳离子移向正极,阴离子移向负极。 【例2】 如图所示进行实验,下列说法不正确的是( ) A.装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生 B.甲、乙装置中的能量变化均为化学能转化为电能 C.装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转 D.装置乙中负极的电极反应式:Zn-2e-===Zn2+ 【解析】 本题考查原电池工作原理。装置甲中锌与稀硫酸反应产生气体,乙装置是原电池装置,铜为正极,在铜片上有气体产生,锌为负极,锌片上电极反应式为Zn-2e-===Zn2+,装置乙工作时有电流产生,电流方向由铜流向锌,故A、C、D正确;装置甲不能构成原电池,故化学能不能转化为电能,B错。 【答案】 B 【提炼】 原电池的电极反应,一般负极是负极材料本身失电子,正极是表面的电解质阳离子得电子。 【例3】 分析下图所示的四个原电池装置,其中结论正确的是( ) A.①②中Mg作负极,③④中Fe作负极 B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑ C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+ D.④中Cu作正极,电极反应式为2H++2e-===H2↑ 【解析】 ②中Mg不与NaOH溶液反应,而Al能和NaOH溶液反应失去电子,故Al是负极;③中Fe在浓硝酸中钝化,Cu和浓HNO3反应,失去电子作负极,A、C错;②中电池总反应为2Al+2NaOH+2H2O===2NaAlO2+3H2↑,负极反应式为2Al+8OH--6e-===2AlO+4H2O,二者相减得到正极反应式为6H2O+6e-===6OH-+3H2↑,B正确;④中Cu是正极,电极反应式为O2+2H2O+4e-===4OH-,D错。 【答案】 B 【提炼】 原电池一般是自发进行的氧化还原反应,一般负极比较活泼。当然也有特殊情况,如Mg—Al/NaOH溶液、Fe—Cu/浓HNO3,虽然活泼性:Mg>Al、Fe>Cu,由于分别发生的氧化还原反应为:2Al+2NaOH+2H2O===2NaAlO2+3H2↑、Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,因此负极分别为Al、Cu。 【例4】 某电化学气敏传感器的工作原理如图所示。下列说法不正确的是( ) A.a极为负极 B.b极的电极反应式为O2+2H2O+4e-===4OH- C.电解质溶液中的OH-移向a极 D.该传感器在工作一段时间后,电解质溶液的pH值变大 【解析】 传感器在工作过程中,负极上氨气失电子生成氮气,则a为负极,氧气在正极上得电子生成氢氧根离子,其电池的总反应为4NH3+3O2===2N2+6H2O。A.传感器在工作过程中,负极上氨气失电子生成氮气,则a为负极,故A正确;B.氧气在正极上得电子生成氢氧根离子,b极的电极反应式为O2+4e-+2H2O===4OH-,故B正确;C.碱性条件下,氨气失电子生成氮气和水,则a极的电极反应式为2NH3+6OH--6e-===N2+6H2O ,消耗OH-,电解质溶液中的OH-移向a极,故C正确;D.该传感器在工作过程中总反应为4NH3+3O2===2N2+6H2O,由于反应生成了H2O,而KOH的物质的量不变,故KOH的物质的量浓度变小,pH值变小,故选D。 【答案】 D 【提炼】 正确理解原电池原理,能根据图示分析电池的总反应,一般正极反应比较容易书写,而负极反应则利用总反应减去正极反应即可。 【例5】 某化学小组构想将汽车尾气(NOx)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料。写出总化学方程式________________________________________________________________________。 【解析】 分析所给图:通O2的为正极,通尾气的为负极,题中汽车尾气(NOx)转化为重要的化工原料HNO3,根据质量守恒及电子得失守恒,即可写出总反应为4NOx+(5-2x)O2+2H2O===4HNO3。 【答案】 4NOx+(5-2x)O2+2H2O===4HNO3 【提炼】 根据所给装置图,首先要分析是原电池原理还是电解池工作原理,其次找到两极发生反应的物质,弄清楚电子流向及得失电子情况。查看更多