- 2021-02-27 发布 |
- 37.5 KB |
- 18页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习化学反应速率和化学平衡图像解题方法学案
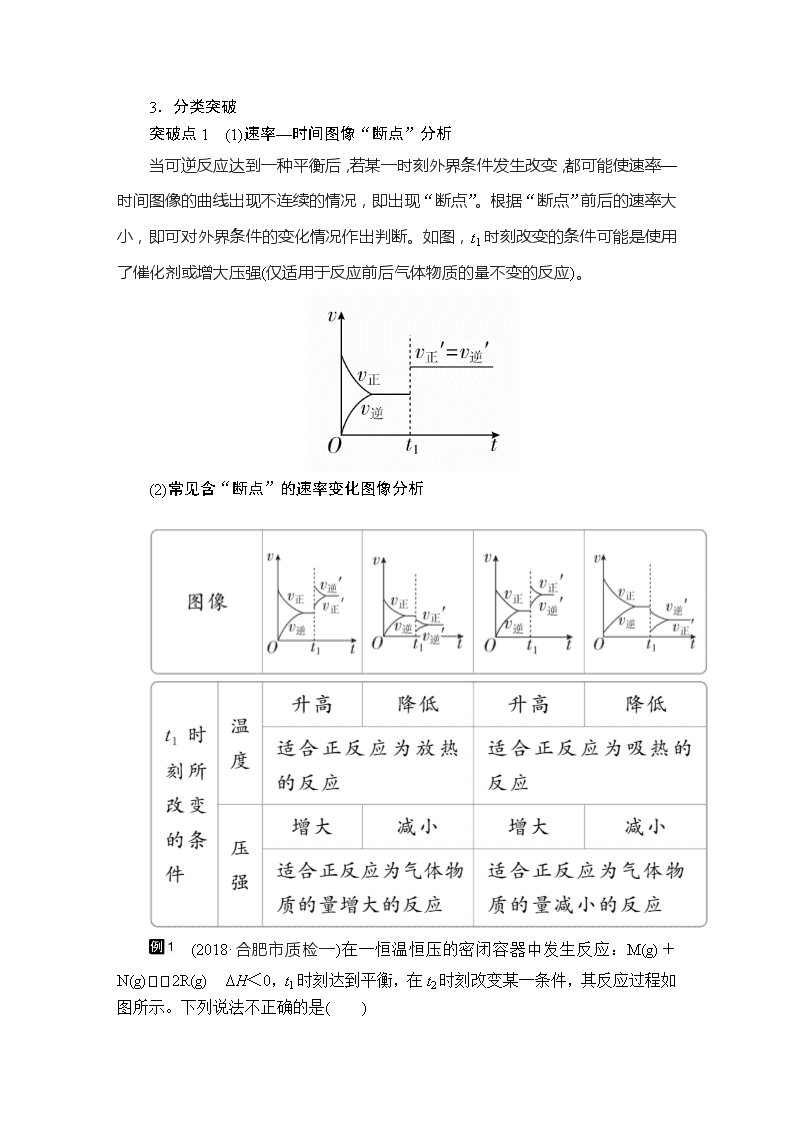
化学反应速率和化学平衡图像解题方法 命题分析:化学反应速率和化学平衡图像分析类试题是高考的热点题型,该类试题经常涉及的图像类型有含量—时间—温度(压强)图像、恒温、恒压曲线等,图像中蕴含着丰富的信息,具有简明、直观、形象的特点,命题形式灵活,难度不大,解题的关键是根据反应特点,明确反应条件,认真分析图像,充分挖掘蕴含的信息,紧扣化学原理,找准切入点解决问题。 突破方法 1.解题步骤 2.解题技巧 (1)先拐先平 在含量(转化率)—时间曲线中,先出现拐点的先达到平衡,说明该曲线反应速率快,表示温度较高、有催化剂、压强较大等。 (2)定一议二 当图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系,有时还需要作辅助线。 (3)三步分析法 一看反应速率是增大还是减小;二看v正、v逆的相对大小;三看化学平衡移动的方向。 3.分类突破 突破点1 (1)速率—时间图像“断点”分析 当可逆反应达到一种平衡后,若某一时刻外界条件发生改变,都可能使速率—时间图像的曲线出现不连续的情况,即出现“断点”。根据“断点”前后的速率大小,即可对外界条件的变化情况作出判断。如图,t1时刻改变的条件可能是使用了催化剂或增大压强(仅适用于反应前后气体物质的量不变的反应)。 (2)常见含“断点”的速率变化图像分析 (2018·合肥市质检一)在一恒温恒压的密闭容器中发生反应:M(g)+N(g)2R(g) ΔH<0,t1时刻达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法不正确的是( ) A.t1时刻的v(正)小于t2时刻的v(正) B.t2时刻改变的条件是向密闭容器中加R C.Ⅰ、Ⅱ两过程达到平衡时,M的体积分数相等 D.Ⅰ、Ⅱ两过程达到平衡时,反应的平衡常数相等 解析 恒温恒压下t2时刻改变某一条件,逆反应速率瞬间增大,再次建立的平衡与原平衡等效,根据等效平衡原理,t2时刻改变的条件是向密闭容器中加R,B项正确;t1时刻反应达到平衡,v(正)=v(逆),而t2时刻加R,体积增大,v(正)瞬间减小,v(逆)瞬间增大,故t1时刻的v(正)大于t2时刻的v(正),A项错误;Ⅰ、Ⅱ两过程达到的平衡等效,M的体积分数相等,C项正确;Ⅰ、Ⅱ两过程的温度相同,则反应的平衡常数相等,D项正确。 答案 A 对于反应2SO2(g)+O2(g)2SO3(g) ΔH<0已达平衡,如果其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡产生影响,下列条件与图像不相符的是(O~t1:v正=v逆;t1时改变条件,t2时重新建立平衡)( ) 答案 C 解析 分析时要注意改变条件瞬间v正、v逆的变化。增加O2的浓度,v正增大,v逆瞬间不变,A正确;增大压强,v正、v逆都增大,v正增大的倍数大于v逆增大的倍数,B正确;升高温度,v正、v逆都瞬间增大,C错误;加入催化剂,v正、v逆同时同倍数增大,D正确。 突破点2 物质的量(或浓度)—时间图像 将物质的量(或浓度)减少的物质作为反应物,将物质的量(或浓度)增加的物质作为产物;依据物质的转化量之比一定等于方程式系数比来确定化学方程式。如: 某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。 则该反应的化学方程式为3X+Y2Z,前2 min内v(X)=0.075 mol·L-1·min-1。 (2018·郑州市质检一)汽车发动机工作时会引发反应N2(g)+O2(g)2NO(g)。2000 K时,向固定容积的密闭容器中充入等物质的量的N2、O2发生上述反应,各组分体积分数(φ)的变化如图所示。N2的平衡转化率为________。 解析 设起始时N2、O2均为a mol,平衡建立过程中N2转化x mol,则平衡时N2、O2均为(a-x) mol,NO为2x mol,则=0.6,解得x=0.6a,故N2的平衡转化率为×100%=60%。 答案 60% (全国卷Ⅱ)在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。 在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1。 答案 0.0010 解析 由题图可知,0~60 s时段,N2O4的物质的量浓度变化为0.060 mol·L-1,v(N2O4)==0.0010 mol·L-1·s-1。 突破点3 转化率(或百分含量)—时间—温度(或压强)图像 已知不同温度或压强下,反应物的转化率α(或百分含量)与时间的关系曲线,推断温度的高低及反应的热效应或压强的大小及气体物质间的化学计量数的关系。[以aA(g)+bB(g)cC(g)中反应物的转化率αA为例说明] (1)“先拐先平,数值大”原则 分析反应由开始(起始物质相同时)达到平衡所用时间的长短可推知反应条件的变化。 ①若为温度变化引起,温度较高时,反应达平衡所需时间短。如甲中T2>T1。 ②若为压强变化引起,压强较大时,反应达平衡所需时间短。如乙中p1>p2。 ③使用催化剂时,反应达平衡所需时间短。如图丙中a使用催化剂。 (2)正确掌握图像中反应规律的判断方法 ①图甲中,T2>T1,升高温度,αA降低,平衡逆向移动,正反应为放热反应。 ②图乙中,p1>p2,增大压强,αA升高,平衡正向移动,则正反应为气体分子数减小的反应。 (2018·全国卷Ⅲ节选)三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题: (1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式___________________________________。 (3)对于反应2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。 ①343 K时反应的平衡转化率α=________%,平衡常数K343 K=________(保留两位小数)。 ②在343 K下:要提高SiHCl3转化率,可采取的措施是________________;要缩短反应达到平衡的时间,可采取的措施有________________、________________。 解析 (1)根据题目表述,三氯氢硅和水蒸气反应得到(HSiO)2O,方程式为:2SiHCl3+3H2O===(HSiO)2O+6HCl。 (3)①温度越高反应速率越快,达到平衡用的时间就越少,所以由图可知,曲线a代表343 K的反应。从图中读出,达到平衡状态时反应的转化率为22%。设初始加入的三氯氢硅的浓度为1 mol·L-1,得到: 2SiHCl3(g)SiH2Cl2(g)+SiCl4(g) 1 0 0 0.22 0.11 0.11 0.78 0.11 0.11 所以平衡常数K=0.112÷0.782≈0.02。 ② 温度不变,提高三氯氢硅转化率的方法可以是将产物从体系分离(两边气体体积相等,压强不影响平衡)。缩短达到平衡的时间,就是加快反应速率,所以可以采取的措施是提高反应物压强(浓度)、加入更高效的催化剂(改进催化剂)。 答案 (1)2SiHCl3+3H2O===(HSiO)2O+6HCl (3)①22 0.02 ②及时移去产物 改进催化剂 提高反应物压强(浓度) ③大于 1.3 (重庆高考)在恒容密闭容器中通入X并发生反应:2X(g)Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( ) A.该反应进行到M点放出的热量大于进行到W点放出的热量 B.T2下,在0~t1时间内,v(Y)= mol·L-1·min-1 C.M点的正反应速率v正大于N点的逆反应速率v逆 D.M点时再加入一定量X,平衡后X的转化率减小 答案 C 解析 依据题中图示,可看出T1>T2,由于T1时X的平衡浓度大,可推出该反应为放热反应。A项,M点与W点比较,X的转化量前者小于后者,故进行到M点放出的热量应小于进行到W点放出的热量,错误;B项,2v(Y)=v(X)= mol·L-1·min-1,错误;C项,T1>T2,温度越高,反应速率越大,M点的正反应速率v正>W点的正反应速率v正′,而W点的正反应速率v正′=其逆反应速率v逆′>N点的逆反应速率v逆,正确;D项,恒容时充入X,压强增大,平衡正向移动,X的转化率增大,错误。 突破点4 转化率(或含量)—温度—压强图像 这类图像的纵坐标为物质的平衡浓度或反应物的转化率,横坐标为温度或压强。[以mA(g)+nB(g)xC(g)+qD(g)为例] m+n>x+q,ΔH>0 m+n<x+q,ΔH>0 m+n>x+q,ΔH<0 m+n>x+q,ΔH>0 m+n>x+q,ΔH>0 m+n<x+q,ΔH<0 (1)“定一议二”原则:可通过分析相同温度下不同压强时反应物A的转化率(或C的含量)大小来判断平衡移动的方向,从而确定反应方程式中反应物与产物气体物质间的化学计量数的大小关系。 (2)通过分析相同压强下不同温度时反应物A的转化率(或C的含量)的大小来判断平衡移动的方向,从而确定反应ΔH的正、负。 (2018·北京高考改编)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下: (1)反应Ⅱ:3SO2(g)+2H2O(g)===2H2SO4(l)+S(g) ΔH=-254 kJ·mol-1 (2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。 p2________p1(填“>”或“<”),得出该结论的理由是 ________________________________________________________________________________________________________________________________________。 (3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。 ⅰ.SO2+4I-+4H+===S↓+2I2+2H2O ⅱ.I2+2H2O+________===________+________+2I- (4)探究ⅰ、ⅱ反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中) ①B是A的对比实验,则a=________。 ②比较A、B、C,可得出的结论是____________________________________。 ③实验表明,SO2的歧化反应速率D>A,结合ⅰ、ⅱ反应速率解释原因:__________________________________________________。 解析 (2)在横坐标上任取一点,作纵坐标的平行线,可见温度相同时,p2时H2SO4物质的量分数大于p1时;反应Ⅱ是气体分子数减小的反应,增大压强平衡向正反应方向移动,H2SO4物质的量增加,体系总物质的量减小,H2SO4物质的量分数增大,则p2>p1。 (3)反应Ⅱ的总反应为3SO2+2H2O===2H2SO4+S,I-可以作为水溶液中SO2歧化反应的催化剂,催化剂在反应前后质量和化学性质不变,(总反应-反应ⅰ)÷2得反应ⅱ的离子方程式为I2+2H2O+SO2===4H++SO+2I-。 (4)①B是A的对比实验,采用控制变量法,B比A多加了0.2 mol·L-1 H2SO4,A与B中KI浓度应相等,则a=0.4。 ②对比A与B,加入H+可以加快SO2歧化反应的速率;对比B与C,单独H+不能催化SO2的歧化反应;比较A、B、C,可得出的结论是:I-是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可以加快歧化反应速率。 ③对比D和A,D中加入KI的浓度小于A,D中多加了I2,反应ⅰ消耗H+和I-,反应ⅱ中消耗I2,D中“溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快”,反应速率D>A,由此可见,反应ⅱ比反应ⅰ速率快,反应ⅱ产生H+使c(H+)增大,从而使反应ⅰ加快。 答案 (2)> 反应Ⅱ是气体物质的量减小的反应,温度一定时,增大压强使反应正向移动,H2SO4的物质的量增大,体系总物质的量减小,H2SO4的物质的量分数增大 (3)SO2 SO 4H+ (4)①0.4 ②I-是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可以加快歧化反应速率 ③反应ⅱ比ⅰ快;D中由反应ⅱ产生的H+使反应ⅰ加快 (2016·四川高考)一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)。设起始=Z,在恒压下,平衡时φ(CH4)(CH4的体积分数)与Z和T(温度)的关系如图所示。下列说法正确的是( ) A.该反应的焓变ΔH>0 B.图中Z的大小为a>3>b C.图中X点对应的平衡混合物中=3 D.温度不变时,图中X点对应的平衡在加压后φ(CH4)减小 答案 A 解析 由图可知,随着温度升高甲烷的体积分数逐渐减小,说明升温平衡正向移动,则正反应为吸热反应,即焓变ΔH>0,A正确;增大水蒸气的物质的量,平衡正向移动,则的比值越大,甲烷的体积分数越小,故a<3查看更多