2020版高考一轮复习化学通用版学案:第三章第2课时 难点专攻——碳酸钠、碳酸氢钠及氢氧化铝的图像
第2课时 难点专攻——碳酸钠、碳酸氢钠与氢氧化铝的图像问题
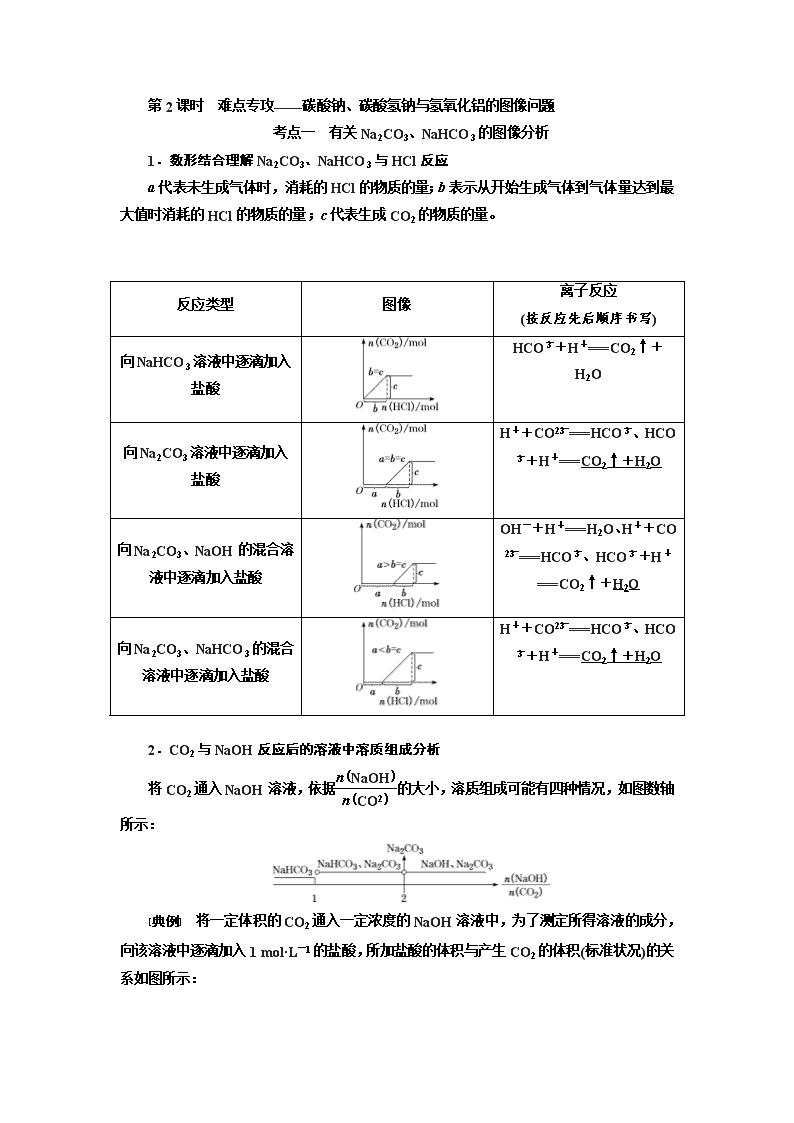
考点一 有关Na2CO3、NaHCO3的图像分析
1.数形结合理解Na2CO3、NaHCO3与HCl反应
a代表未生成气体时,消耗的HCl的物质的量;b表示从开始生成气体到气体量达到最大值时消耗的HCl的物质的量;c代表生成CO2的物质的量。
反应类型
图像
离子反应
(按反应先后顺序书写)
向NaHCO3溶液中逐滴加入盐酸
HCO+H+===CO2↑+H2O
向Na2CO3溶液中逐滴加入盐酸
H++CO===HCO、HCO+H+===CO2↑+H2O
向Na2CO3、NaOH的混合溶液中逐滴加入盐酸
OH-+H+===H2O、H++CO===HCO、HCO+H+===CO2↑+H2O
向Na2CO3、NaHCO3的混合溶液中逐滴加入盐酸
H++CO===HCO、HCO+H+===CO2↑+H2O
2.CO2与NaOH反应后的溶液中溶质组成分析
将CO2通入NaOH溶液,依据的大小,溶质组成可能有四种情况,如图数轴所示:
[典例] 将一定体积的CO2通入一定浓度的NaOH溶液中,为了测定所得溶液的成分,向该溶液中逐滴加入1 mol·L-1的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)的关系如图所示:
(1)加入35 mL盐酸时,产生CO2的体积为(标准状况)________mL。
(2)溶液中所含溶质及物质的量为_______________________________________。
[解析] (1)由图像所示消耗盐酸的体积与产生CO2的体积可知,该溶液的溶质是NaOH和Na2CO3。OA段H+先与OH-反应生成H2O,待OH-消耗完,H+再与CO反应生成HCO。AB段发生反应H++HCO===CO2↑+H2O,加入35 mL盐酸时,产生的n(CO2)=n(H+)=(35-25)mL×10-3 L·mL-1×1 mol·L-1=0.01 mol,则V(CO2)=22.4 L·mol-1×0.01 mol=0.224 L=224 mL。(2)由H++CO===HCO及H++HCO===CO2↑+H2O可知,n(CO)=(45-25)mL×10-3 L·mL-1×1 mol·L-1=0.02 mol,故OA段与H+反应的OH-为25 mL×10-3 L·mL-1×1 mol·L-1-0.02 mol=0.005 mol,即溶液中含NaOH 0.005 mol、Na2CO3 0.02 mol。
[答案] (1)224 (2)NaOH 0.005 mol、Na2CO3 0.02 mol
[备考方略] 依据图像特点判断溶质成分的方法
(1)若a=0(即图像从原点开始)
溶液中的溶质为NaHCO3
(2)若V(Oa)=V(ab)(即Oa段与ab段消耗盐酸的体积相同)
溶液中的溶质为Na2CO3
(3)若V(Oa)>V(ab)(即Oa段消耗盐酸的体积大于ab段消耗盐酸的体积)
溶液中的溶质为Na2CO3和NaOH
(4)若V(Oa)
AB。
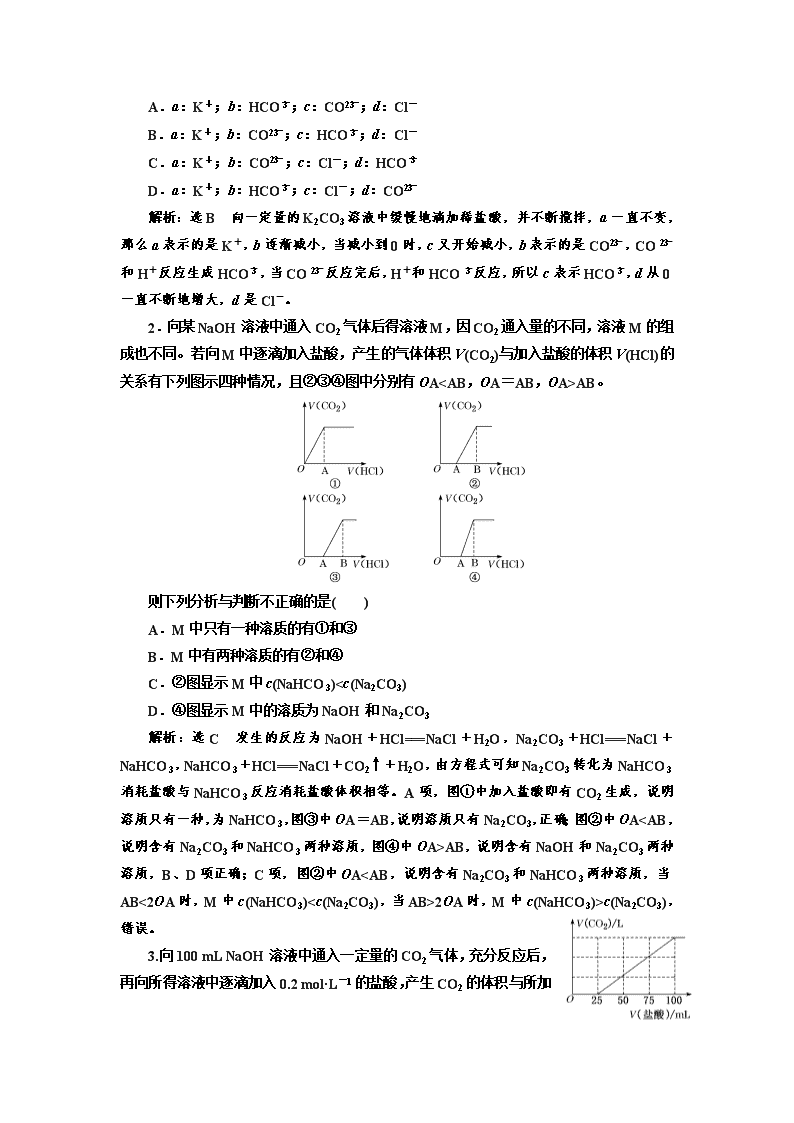
则下列分析与判断不正确的是( )
A.M中只有一种溶质的有①和③
B.M中有两种溶质的有②和④
C.②图显示M中c(NaHCO3)AB,说明含有NaOH和Na2CO3两种溶质,B、D项正确;C项,图②中OA2OA时,M中c(NaHCO3)>c(Na2CO3),错误。
3.向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸的体积之间的关系如图所示。下列判断正确的是( )
A.原NaOH溶液的浓度为0.2 mol·L-1
B.通入CO2在标准状况下的体积为448 mL
C.通入CO2后,所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D.通入CO2后,所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1
解析:选A 当向100 mL NaOH溶液中通入一定量的CO2气体时,反应有两种可能情况:2NaOH+CO2===Na2CO3+H2O或NaOH+CO2===NaHCO3。再加入盐酸100 mL时,无论是NaOH、NaHCO3还是Na2CO3都会生成NaCl,当盐酸体积为100 mL时,n(Na+)=n(Cl-),所以n(NaOH)=n(HCl)=0.02 mol,溶质为NaCl时所用NaOH溶液和盐酸的体积相同,那么浓度也相同,即原NaOH溶液的浓度为0.2 mol·L-1,A项正确。盐酸由25 mL滴至100 mL时,发生的反应为NaHCO3+HCl===NaCl+CO2↑+H2O,消耗盐酸0.015 mol,生成CO2 0.015 mol,故通入CO2后溶液的溶质为Na2CO3和NaHCO3;设通入CO2后所得溶液中的Na2CO3为x mol,NaHCO3为y mol,根据原子守恒:2x+y=0.02、x+y=0.015,解得x=0.005,y=0.01,所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=2∶1,C、D项错误。根据碳原子守恒,通入CO2在标准状况下的体积为336 mL,B项错误。
考点二 有关Al(OH)3的图像分析与计算
1.可溶性铝盐溶液与NaOH溶液反应的图像
滴加顺序
向Al3+中滴加OH-
向OH-中滴加Al3+
现象
立即产生白色沉淀→渐多→最多→渐少→消失
无沉淀(有但即溶)→沉淀→渐多→最多→不消失
图像
离子方程式
OA段
Al3++3OH-===Al(OH)3↓
4OH-+Al3+===AlO+2H2O
AB段
Al(OH)3+OH-===AlO+2H2O
3AlO+Al3++6H2O===4Al(OH)3↓
2.偏铝酸盐溶液与盐酸反应的图像
滴加顺序
向AlO中滴加H+
向H+中滴加AlO
现象
立即产生白色沉淀→渐多→最多
无沉淀(有但即溶)→沉淀→渐多→
→渐少→消失
最多→不消失
图像
离子方程式
OA段
AlO+H++H2O===Al(OH)3↓
4H++AlO=== Al3++2H2O
AB段
Al(OH)3+3H+===Al3++3H2O
Al3++3AlO+6H2O===4Al(OH)3↓
1.向AlCl3溶液中逐滴加入氨水或NaAlO2溶液至过量
图像
离子方程式
Al3++3NH3·H2O=== Al(OH)3↓+3NH或Al3++3AlO+6H2O===4Al(OH)3↓
2.向NaAlO2溶液中通入CO2或加入AlCl3至过量
图像
离子方程式
AlO+CO2+2H2O===Al(OH)3↓+HCO
或3AlO+Al3++6H2O===4Al(OH)3↓
3.向MgCl2、AlCl3和盐酸的混合溶液中逐滴加入NaOH溶液至过量
图像
离子方程式
OA段
H++OH-===H2O
AB段
Mg2++2OH-===Mg(OH)2↓Al3++3OH-===Al(OH)3↓
BC段
Al(OH)3+OH-===AlO+2H2O
4.向MgCl2、AlCl3混合溶液中先加入NaOH溶液,后加入盐酸(NaOH与盐酸的物质的量浓度相等)
图像
离子方程式
OA段
Mg2++2OH-===Mg(OH)2↓
Al3++3OH-===Al(OH)3↓
AB段
Al(OH)3+OH-===AlO+2H2O
BC段
AlO+H++H2O===Al(OH)3↓
CD段
Al(OH)3+3H+===Al3++3H2O
Mg(OH)2+2H+===Mg2++2H2O
5.向含MgCl2、AlCl3、盐酸、NH4Cl的混合溶液中,逐滴加入NaOH溶液至过量
图像
离子方程式
OA段
H++OH-===H2O
AB段
Al3++3OH-===Al(OH)3↓
Mg2++2OH-===Mg(OH)2↓
BC段
NH+OH-===NH3·H2O
CD段
Al(OH)3+OH-===AlO+2H2O
6.把Ba(OH)2溶液逐滴加入到明矾溶液中至过量
图像
离子方程式
OA段
2Al3++3SO+3Ba2++6OH-
===2Al(OH)3↓+3BaSO4↓
AB段
2Al(OH)3+SO+Ba2++2OH-
===BaSO4↓+2AlO+4H2O
[典例] 向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1 mol·L-1 Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
A.图中C点铝元素存在形式是AlO
B.向D点溶液中通入CO2气体,立即产生白色沉淀
C.原混合溶液中c[Al2(SO4)3]∶c(AlCl3)=1∶2
D.OA段反应的离子方程式为2Al3++3SO+3Ba2++8OH-===2AlO+3BaSO4↓+4H2O
[解析] C点生成BaSO4(3 mol)沉淀和Ba(AlO2)2,此时铝元素以AlO的形式存在,A正确;D点溶液溶质为Ba(AlO2)2和Ba(OH)2,通入CO2气体,立即产生BaCO3和Al(OH)3沉淀,B正确;B点为Al(OH)3和BaSO4沉淀,此时Al(OH)3的物质的量为7 mol-3 mol=
4 mol,故原混合液中有1 mol Al2(SO4)3,AlCl3物质的量为4 mol-1 mol×2=2 mol,即c[Al2(SO4)3]∶c(AlCl3)=1∶2,C正确;OA段反应的离子方程式为2Al3++3SO+3Ba2++6OH-===3BaSO4↓+2Al(OH)3↓,D错误。
[答案] D
[备考方略] Al(OH)3沉淀图像题的分析方法
Al(OH)3可以溶解在强酸、强碱中,但不溶于氨水和碳酸。所以围绕Al3+与强酸、强碱的反应存在过量问题。解决过量问题常借助“一种思维”和“两种方法”。
(1)“一种思维”——极值思维模型
(2)“两种方法”
①一维坐标分析法:结合极值,画出数轴,分段分析;
②二维坐标分析法:横坐标代表反应物的量,纵坐标代表产物的量,结合极值,分析产物的量随反应物的量的变化情况并画出相应曲线。
[综合训练]
1.某实验小组对含有Al3+的一种未知溶液进行了如下实验分析:
顺序
实验操作
实验现象
①
滴入少量NaOH溶液
无明显变化
②
在操作①的基础上,继续滴加NaOH溶液
产生白色沉淀
③
在操作②的基础上,滴入过量的NaOH溶液
白色沉淀明显减少
实验小组经定量分析,得出如图所示沉淀的物质的量与滴入NaOH溶液体积的关系。下列说法错误的是( )
A.该未知溶液中至少含有三种阳离子
B.滴加的NaOH溶液的物质的量浓度为5 mol·L-1
C.若溶液中只含三种阳离子且另一种离子为二价金属阳离子,则a=10
D.若将最终沉淀过滤、洗涤、灼烧,得到固体的质量一定为6 g
解析:选D 由图像信息可知,混合液中至少含有H+、Al3+和另外一种金属阳离子(其可与NaOH溶液反应生成沉淀,同时沉淀不溶于NaOH溶液),A项正确;溶解0.05 mol Al(OH)3消耗的NaOH溶液的体积为10 mL,由离子方程式Al(OH)3+OH-===AlO+2H2O可知,NaOH溶液的物质的量浓度是5 mol·L-1,B
项正确;由图像信息可知,另外一种沉淀为0.15 mol,若溶液中只含三种阳离子且另外一种离子为二价金属阳离子,则消耗的NaOH溶液的体积为60 mL,又因为生成Al(OH)3消耗的NaOH溶液为30 mL,可知沉淀二价金属阳离子、生成Al(OH)3、溶解Al(OH)3共消耗NaOH溶液的体积为100 mL,故a=110-100=10,C项正确;由题目已知信息不能确定另外的金属阳离子,故不能确定最终沉淀的质量,D项错误。
2.如图所示为向一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线。
请回答下列问题:
(1)A点时已参加反应的AlCl3和NaOH的物质的量之比为________。
(2)AB段曲线所表示的反应的离子方程式为_______________________________
________________________________________________________________________。
(3)向B处生成的溶液中通入二氧化碳,可观察到的现象是
________________________________________________________________________。
(4)向含有0.1 mol NH4Al(SO4)2的溶液中逐滴加入 5 mol·L-1 NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在图中画出生成沉淀的物质的量与加入NaOH 溶液体积的关系示意图。
解析:(1)分析题中图像可知,OA段表示的是AlCl3和NaOH反应生成Al(OH)3和NaCl 的过程,反应的化学方程式为AlCl3+3NaOH===Al(OH)3↓+3NaCl,A点时已参加反应的AlCl3和NaOH 的物质的量之比为1∶3。
(2)AB段是Al(OH)3沉淀溶解的过程,反应生成NaAlO2和H2O,离子方程式为Al(OH)3+OH-===AlO +2H2O。
(3)向B处生成的溶液中通入二氧化碳,发生反应2AlO +CO2+3H2O===2Al(OH)3↓+CO,生成Al(OH)3 白色沉淀。
(4)含有0.1 mol NH4Al(SO4)2的溶液中含有NH 的物质的量为0.1 mol,Al3+的物质的量为 0.1 mol,逐滴加入5 mol·L-1NaOH 溶液,依次发生反应的离子方程式为 Al3+ +3OH-===Al(OH)3↓,NH+OH-===NH3↑+H2O,Al(OH)3+OH-===AlO+2H2O。先生成Al(OH)3沉淀,消耗NaOH的物质的量为0.3 mol,对应溶液体积为=0.060 L=60 mL;与NH反应的NaOH的物质的量为0.1 mol,对应的溶液体积为=0.020 L=20 mL;生成的Al(OH)3沉淀的物质的量为0.1 mol,溶解0.1 mol Al(OH)3沉淀需要消耗NaOH
的物质的量为0.1 mol,则对应的溶液的体积为20 mL,依据沉淀的物质的量和消耗NaOH溶液的体积画出图像。
答案:(1)1∶3
(2)Al(OH)3+OH-===AlO+2H2O
(3)生成白色沉淀
(4)