2020年高考化学一轮复习化学反应速率和化学平衡作业1
化学反应速率和化学平衡
一、选择题
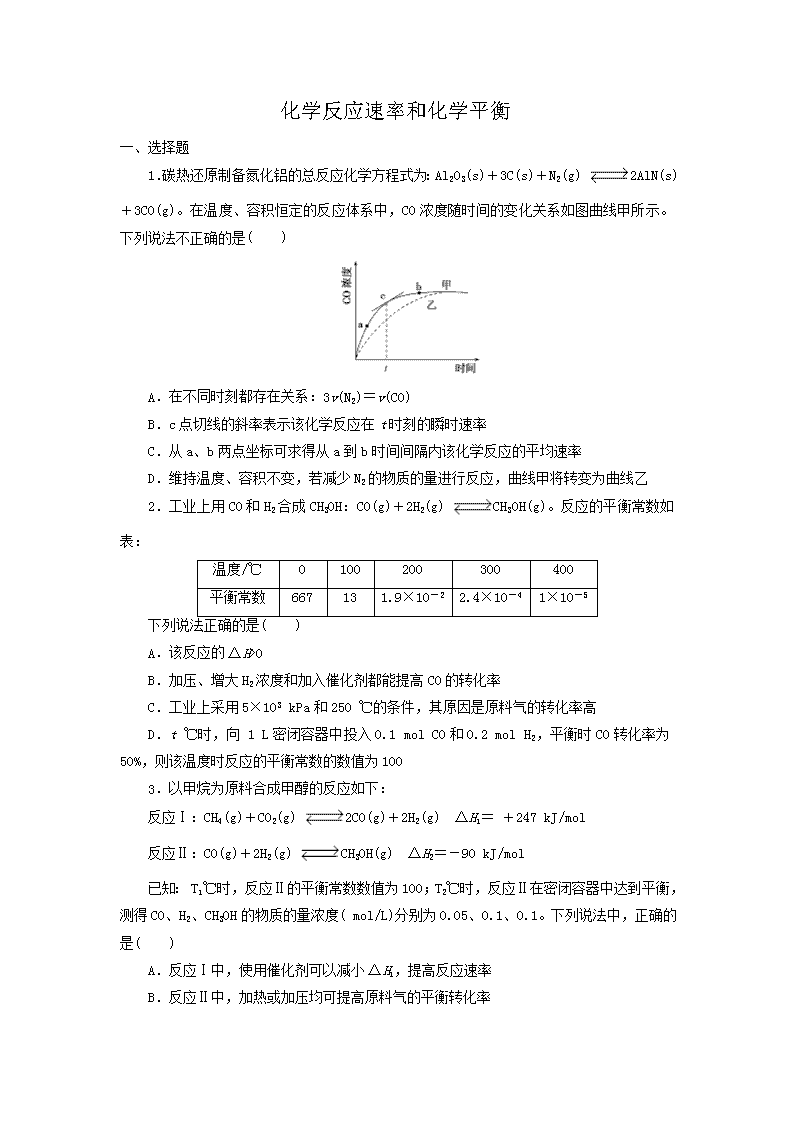
1.碳热还原制备氮化铝的总反应化学方程式为:Al2O3(s)+3C(s)+N2(g) 2AlN(s)+3CO(g)。在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如图曲线甲所示。下列说法不正确的是( )
A.在不同时刻都存在关系:3v(N2)=v(CO)
B.c点切线的斜率表示该化学反应在t时刻的瞬时速率
C.从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率
D.维持温度、容积不变,若减少N2的物质的量进行反应,曲线甲将转变为曲线乙
2.工业上用CO和H2合成CH3OH:CO(g)+2H2(g) CH3OH(g)。反应的平衡常数如表:
温度/℃
0
100
200
300
400
平衡常数
667
13
1.9×10-2
2.4×10-4
1×10-5
下列说法正确的是( )
A.该反应的ΔH>0
B.加压、增大H2浓度和加入催化剂都能提高CO的转化率
C.工业上采用5×103 kPa和250 ℃的条件,其原因是原料气的转化率高
D.t ℃时,向 1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100
3.以甲烷为原料合成甲醇的反应如下:
反应Ⅰ:CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1= +247 kJ/mol
反应Ⅱ:CO(g)+2H2(g) CH3OH(g) ΔH2=-90 kJ/mol
已知: T1℃时,反应Ⅱ的平衡常数数值为100;T2℃时,反应Ⅱ在密闭容器中达到平衡,测得CO、H2、CH3OH的物质的量浓度( mol/L)分别为0.05、0.1、0.1。下列说法中,正确的是( )
A.反应Ⅰ中,使用催化剂可以减小ΔH1,提高反应速率
B.反应Ⅱ中,加热或加压均可提高原料气的平衡转化率
C.由上述数据可判断反应Ⅱ的温度: T1>T2
D.CO(g)+CH3OH(g) CH4(g)+CO2(g) ΔH=+157
kJ/mol
4. 100 ℃时,向容积为2 L的密闭容器中充入一定量的X气体,发生如下反应:X(g)+2Y(g)Z(g),反应过程中测定的部分数据见下表( )
反应时间/min
n(X)/mol
n(Y)/mol
0
2.00
2.40
10
1.00
30
0.40
下列说法正确的是( )
A.温度为200 ℃时,上述反应平衡常数为20,则正反应为吸热反应
B.若密闭容器体积可变,其他条件不变,在达到平衡后缩小容器体积为原来一半,则n(X)>1 mol/L
C.保持其他条件不变,向容器中再充入1.00 mol X气体和1.20 mol Y气体,到达平衡后,X转化率增大
D.保持其他条件不变,若再向容器中通入0.10 mol X气体,0.10 mol Y和0.10 mol Z,则v(正)<v(逆)
5.探究2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O反应速率的影响因素,有关实验数据如下表所示:
实验编号
温度℃
催化剂用量g
酸性KMnO4溶液
H2C2O4溶液
KMnO4溶液褪色平均时间(min)
体积(mL)
浓度( mol·L-1)
体积(mL)
浓度( mol·L-1)
1
25
0.5
4
0.1
8
0.2
12.7
2
80
0.5
4
0.1
8
0.2
a
3
25
0.5
4
0.01
8
0.2
6.7
4
25
0
4
0.01
8
0.2
b
下列说法不正确的是( )
A.a<12.7,b>6.7
B.用KMnO4表示该反应速率,v(实验3)>v(实验1)
C.用H2C2O4表示该反应速率,v(实验1)约为6.6×10-3 mol·L-1·min-1
D.可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢
6.在一密闭容器中发生反应:2X(g)+Y(g)aZ(g) ΔH=Q kJ·mol-1
,开始按体积比2∶1将X、Y充入反应器中,一定条件下发生反应,下列有关说法正确的是( )
A.图甲,p1>p2,a<3
B.图甲,T1
0
C.图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体
D.图乙,如果a=3,t2时表示向体系中加入了催化剂
7.一定量的CO2与足量碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示。
下列说法正确的是( )
A.550 ℃时,若充入惰性气体,v(正)、v(逆)均减小,平衡不移动
B.650 ℃时,反应达平衡后CO2的转化率为25.0%
C.T ℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925 ℃时,此反应的平衡常数K=2 304,保持温度不变,若缩小体积,K值将变小
8.下列说法正确的是( )
A.ΔH<0、ΔS>0的反应在温度低时不能自发进行
B.NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系由自发地向混乱度增加方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
9.298 K时,各反应的平衡常数如下:
①N2(g)+O2(g)2NO(g) K=1×10-30
②2H2(g)+O2(g)2H2O(g) K=2×1 081
③2CO2(g)2CO(g)+O2(g) K=4×10-92
则常温下,NO、H2O、CO2这三个化合物分解放氧的倾向最大的是( )
A.① B.② C.③ D.无法判断
10.在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)
2Fe(s)+3CO2(g),不可用上述反应中某种物理量来说明该反应已达到平衡状态的是( )
A.CO的生成速率与CO2的生成速率相等
B.气体密度不再变化
C.CO的质量不变
D.体系的压强不再发生变化
11.在密闭容器中,5 mol H2与2 mol CO2发生反应:3H2(g)+CO2(g)CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是( )
A.p1>p2>p3>p4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.若T1>T2>T3>T4,则该反应为放热反应
D.缩小容积,可以提高CH3OH在混合物中的质量分数
12.用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)===CH3OH(g)。在体积一定的密闭容器中按物质的量之比1∶2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是( )
A.该反应的ΔH<0,且p1<p2
B.反应速率:v逆(状态A)>v逆(状态B)
C.在C点时,CO转化率为75%
D.在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数不同
13.某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
t/s
0
5
15
25
35
n(A)/mol
1.0
0.85
0.81
0.80
0.80
A.反应在前5 s的平均速率v(A)=0.17 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)>v(逆)
14.一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s) CaO(s)+CO2(g),达到平衡,下列说法正确的是( )
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度不变
B.将体积增大为原来的2倍,再次达到平衡时,气体的密度变大
C.因CaCO3(s)需加热条件才分解生成CaO(s)和CO2(g),所以是ΔH<0
D.保持容器压强不变,充入He,平衡向逆反应方向进行
15.将质量相同的锌粉分别投入下列四个烧杯的溶液中,反应速率最快的是( )
二、非选择题
12.[2018·全国卷Ⅱ]CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义,回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g)。
已知:C(s)+2H2(g)===CH4(g) ΔH=-75 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH=-394 kJ·mol-1
C(s)+O2(g)===CO(g) ΔH=-111 kJ·mol-1
该催化重整反应的ΔH=________ kJ·mol-1。有利于提高CH4平衡转化率的条件是________(填标号)。
A.高温低压 B.低温高压
C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为________ mol2·L-2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应CH4(g)===C(s)+2H2(g)
消碳反应CO2(g)+C(s)===2CO(g)
ΔH/(kJ·mol-1)
75
172
活化能/ (kJ·mol-1)
催化剂X
33
91
催化剂Y
43
72
①由上表判断,催化剂X________Y(填“优于”或“劣于”),理由是________________________________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图1所示,升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________(填标号)。
A.K积、K消均增加 B.v积减小、v消增加
C.K积减小、K消增加 D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图2所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为__________________。
17.将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度/℃
15.0
20.0
25.0
30.0
35.0
平衡总压强/kPa
5.7
8.3
12.0
17.1
24.0
平衡气体总浓度/(×10-3 mol·L-1)
2.4
3.4
4.8
6.8
9.4
(1)该反应的焓变ΔH___0,熵变ΔS___0(填“>”“<”或“=”)。
(2)可以判断该分解反应已经达到化学平衡的是___(填字母)。
A.2v正(NH3)=v逆(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(3)根据表中数据计算,在25.0 ℃时,反应2NH3(g)+CO2(g)NH2COONH4(s)的平衡常数K=___。
(4)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25 ℃下达到平衡状态。若在恒温下压缩容器体积,氨基甲酸铵固体的质量___(填“增加”“减小”或“不变”)。
18.三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式
_____________________________________________________。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g)
ΔH1=48 kJ·mol-1
3SiH2Cl2(g)===SiH4(g)+2SiHCl3(g)
ΔH2=-30 kJ·mol-1
则反应4SiHCl3(g)===SiH4(g)+3SiCl4(g)的ΔH为____kJ·mol-1。
(3)对于反应2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
①343 K时反应的平衡转化率α=________%。平衡常数K343 K=________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是________;要缩短反应达到平衡的时间,可采取的措施有________、________。
③比较a、b处反应速率大小:va________vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的=________(保留1位小数)。
答案
DDCCB CBBAD BCDAD
16. (1)247 A
(2)①劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大 AD
②pc(CO2)、pb(CO2)、pa(CO2)
17 (1)> >
(2)BC
(3)6.1×107
(4)增大
18 (1)2SiHCl3+3H2O===(HSiO)2O+6HCl
(2)+114 (3)①22 0.02 ②及时移去产物 改进催化剂 提高反应物压强(浓度) ③大于 1.3