- 2021-04-13 发布 |
- 37.5 KB |
- 33页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
新课标RJ2020中考化学复习方案主题二物质构成的奥秘第09课时构成物质的微粒认识化学元素课件
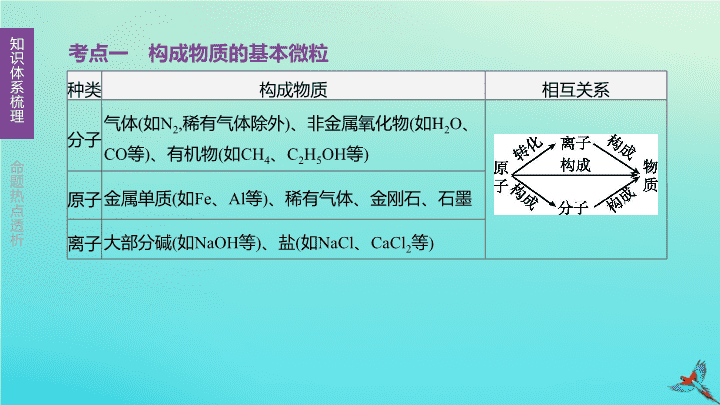
第 9 课时 构成物质的微粒 认识化学元素 主题二 物质构成的奥秘 考点一 构成物质的基本微粒 种类 构成物质 相互关系 分子 气体 ( 如 N 2 , 稀有气体除外 ) 、非金属氧化物 ( 如 H 2 O 、 CO 等 ) 、有机物 ( 如 CH 4 、 C 2 H 5 OH 等 ) 原子 金属 单质 ( 如 Fe 、 Al 等 ) 、稀有气体、金刚石、石墨 离子 大部分 碱 ( 如 NaOH 等 ) 、盐 ( 如 NaCl 、 CaCl 2 等 ) 考点二 分子 1. 概念 由分子构成的物质 , 是保持物质 的最小粒子。 2. 性质 (1) 分子的质量和体积都 。 (2) 分子在不断地运动着。 (3) 分子之间 。 (4) 分子间存在相互作用力 —— 斥力和引力。 分子 化学性质 很小 有间隔 3. 分子运动的实验 (1) 现象 : 烧杯 A 中的溶液逐渐由 色变为 色。 (2) 结论 : 分子在不断 ; 浓氨水能使酚酞溶液变红。 无 红 图 9-1 运动 考点三 原子 1. 定义 中的最小粒子 ( 但不是一定不可分 , 一定条件下可再分 , 如核裂变 ) 。 2. 原子的结构 (1) 构成 原子是不显电性的 , 原子序数 = 质子数 = 数 = 核外 数。 化学变化 原子核 核外电子 质子 中子 核电荷 电子 (2) 表示 ( 原子结构示意图 ) 图 9-2 质子数 各层上的电子数 (3) 应用 应用分类 结论及判断依据 判断原子、离子 原子 核内质子数 = 核外电子数 离子 阴离子 核内质子数 < 核外电子数 阳离子 核内质子数 > 核外电子数 判断元素种类 金属元素 最 外层电子数 <4( 氢、氦、硼除外 ) 非金属元素 最外层电子数≥ 4 (续表) 应用分类 结论及判断依据 判断得失电子情况 易失电子 最外层电子数 <4 易得电子 最外层电子数 >4 化学性质对比 原子的 数 相等 , 化学性质相似 最外层电子 3. 相对原子质量 (1) 定义 : 以一个碳 -12 原子质量的 ____ 作为 标准 , 任何一种原子的平均原子质量跟一个碳 -12 原子质量的 ___ 的比值 , 称为作为该原子的相对原子质量。 (2) 近似计算式 : 原子质量主要集中在 ________ 上 , 相对原子质量≈ ________ 数 +______ 数。 (3) 单位 : 相对原子质量的单位是“ 1 ” , 不是“ g ” , 一般省略不写。 原子核 质子 中子 考点四 离子 1. 定义 带电的原子或原子团。 2. 分类 阳离子带 电 ; 阴离子带 电。 3. 表示 在元素符号的右上角用“ + ”“ - ”号表示离子的电性 , 用数字表示离子所带的电荷数 , 先写数字 , 后写正负号 , 当数字为“ 1 ”时 , 省略不写。 正 负 4. 离子符号及其周围的数字 图 9-3 考点五 元素 1. 元素 (1) 定义 : 数 ( 即 数 ) 相同的一类原子的总称。元素属于宏观概念 , 只讲种类不讲个数。 质子 核电荷 分类 内容 金属元素 “钅” 字旁 ( 汞除外 ), 最外层电子数一般 4 个 , 易 电子 , 形成 离子 非金属元素 “石” “氵”“气”字旁 , 最外层电子数一般 4 个 ( H 、 He 、 B 除外 ), 易 电子 , 形成 离子 ; 稀有气体最外层电子数为 8( 氦为 2), 化学性质稳定 , 不易得失电子 (2) 分类 < 失去 阳 ≥ 得到 阴 (3) 在自然界中的分布 ( 按质量分数 ) ① 地壳中含量居前四位的元素是 。 ② 生物体内含量最多的元素是 ; 人体中含量最高的金属元素是 。 ③ 空气中含量最多的元素是 。 ④ 农作物生长必需的化学元素 : 、磷、钾。 (4) 元素与原子结构的关系 : 元素的种类由原子中 决定 , 元素的化学性质和原子的 密切相关。 氧、硅、铝、铁 氧 钙 氮 氮 质子数 最外层电子数 (5) 元素符号 ① 写法 : 由一个字母表示的元素符号要大写 ; 由两个字母表示的元素符号 , 第一个字母大写 , 第二个字母小写 , 即“一大二小”。 ② 意义 分类 举例 宏观 表示一种元素 O 表示 _______ 表示 由 构成的一种物质 Cu 表示 ____________ 微观 表示组成元素的一个原子 O 表示 ______________ 氧元素 原子 物质铜 一个氧原子 2. 元素周期表 (1) 组成及规律 ① 横行 ( 周期 ) 每一个横行叫作一个周期 , 共 7 个周期 ; 同周期 数相同 , 从左至右逐渐增加。 ② 纵行 ( 族 ) 每一个纵行叫作一个族 , 共 18 个纵行 ,16 个族 (8,9,10 三个纵行共同组成一个族 ); 同族 数相同 ( 化学性质相似 ), 数逐渐增加。 电子层 最外层电子数 最外层电子 电子层 (2) 在元素周期表中 , 每一种元素均占据一格。如图 9-4 。 图 9-4 还可以得出的信息有 。 原子序数 元素符号 相对原子质量 碳属于非金属元素 考向一 粒子的性质 1. [2019 · 益阳 ] 建立宏观和微观之间的联系对学习化学十分重要。下列宏观事实的微观解释错误的是 ( ) A. 品红在水中扩散 —— 分子在不断运动 B. 水蒸发由液态变成气态 —— 水分子发生改变 C.NO 与 NO 2 化学性质不同 —— 构成物质的分子不同 D.10 mL H 2 O 与 10 mL C 2 H 5 OH 混合后体积小于 20 mL —— 分子间有间隔 [ 答案 ] B [ 解析 ] 水蒸发由液态变成气态 , 是因为水分子间的间隔发生了改变。 2. [2019 · 武汉 ] 下列说法正确的是 ( ) A. 分子是化学变化中的最小粒子 B. 不同元素的本质区别是电子数不同 C. 原子核由电子和质子构成 D. 墙内开花墙外香说明分子在不断运动 [ 答案 ]D [ 解析 ] 化学变化中的最小粒子是原子而不是分子 ; 不同种元素之间的本质区别是质子数不同 ; 原子核由质子和中子构成 ; 墙内开花墙外香 , 是因为花香中含有的分子是在不断运动的 , 向四周扩散 , 使人们闻到花香。 考向二 粒子结构示意图 3. [2019 · 营口 ] 根据以下几种粒子的结构示意图 , 回答下列问题 ( 填序号 ) 。 (1) 属于同种元素的粒子是 。 图 9-5 [ 答案 ] (1)② 和④ [ 解析 ] (1) 元素是质子数 ( 即核电荷数 ) 相同的一类原子的总称 , 质子数相同的粒子属于同种元素。②和④的质子数相同 , 属于同种元素。 3. [2019 · 营口 ] 根据以下几种粒子的结构示意图 , 回答下列问题 ( 填序号 ) 。 (2) 在化学反应中易失去电子的粒子是 。 图 9-5 [ 答案 ] (2)③ [ 解析 ] (2)③ 的最外层电子数是 2, 在化学反应中易失去电子。 3. [2019 · 营口 ] 根据以下几种粒子的结构示意图 , 回答下列问题 ( 填序号 ) 。 (3) 具有相对稳定结构的粒子是 。 图 9-5 [ 答案 ] (3)① 和④ [ 解析 ] (3)① 和④的最外层电子数均为 8, 均具有相对稳定结构。 3. [2019 · 营口 ] 根据以下几种粒子的结构示意图 , 回答下列问题 ( 填序号 ) 。 (4) 化学性质相似的原子是 。 图 9-5 [ 答案 ] (4)② 和⑤ [ 解析 ] (4)② 和⑤表示的粒子为氟原子和氯原子 , 最外层电子均为 7, 化学性质相似。 4. [2019 · 宿迁节选 ] “宏观辨识与微观探析”是化学学科的核心素养之一。在宏观、微观和符号之间建立联系是化学学科的重要思维方式。根据下列粒子结构示意图 , 回答问题。 (1) 上述示意图中 , 共包含 种元素。 图 9-6 [ 答案 ] (1)4 [ 解析 ] (1) 从粒子结构示意图中可以看出 , 共包含氢、钠、硫、氯四种元素。 (2)A 、 B 、 C 、 E 中属于阴离子的是 ( 填离子符号 ) 。 图 9-6 [ 答案 ] (2)S 2- [ 解析 ] (2)A 粒子中电子数等于质子数 , 表示氢原子 ;B 粒子中质子数大于电子数 , 表示钠离子 , 属于阳离子 ;C 粒子中质子数等于电子数 , 表示硫原子 ;E 粒子中质子数小于电子数 , 表示硫离子 , 符号为 S 2- , 属于阴离子。 (3) 若 D 表示某元素的原子 , 则该粒子在化学变化中容易 ( 填“得到”或“失去” ) 电子。 图 9-6 [ 答案 ] (3) 得到 [ 解析 ] (3) 若 D 表示某元素的原子 , 质子数等于电子数 , 故 m 为 7, 最外层电子数大于 4, 在化学反应中易得到电子。 4. [2019 · 宿迁节选 ] “宏观辨识与微观探析”是化学学科的核心素养之一。在宏观、微观和符号之间建立联系是化学学科的重要思维方式。根据下列粒子结构示意图 , 回答问题。 (4) 若 D 为离子 , 则 B 、 D 构成的化合物的化学式为 。 图 9-6 [ 答案 ] (4)NaCl [ 解析 ] (4)B 钠元素与 D 氯元素形成的化合物为氯化钠 , 化学式为 NaCl 。 考向三 元素和元素周期表 5. [2018 · 益阳 ] 下列有关元素的说法不正确的是 ( ) A. 原子的质子数不同 , 则元素种类不同 B.Cl 与 Cl - 可以相互转化 C. 元素可分为金属元素和非金属元素 D. 混合物中一定含有多种元素 [ 答案 ] D [ 解析 ] 决定元素种类的是原子的核内质子数或核电荷数 , 所以原子的质子数不同 , 则元素种类不同 ; 氯原子能通过得到电子形成氯离子 , 氯离子能通过失去电子形成氯原子 ; 元素可以分为金属元素、非金属元素 ; 混合物中不一定含有多种元素 , 如氧气和臭氧的混合物 , 含有一种元素。 6. [2019 · 大庆节选 ] 元素周期表是学习和研究化学的重要工具。如图 9-7 是元素周期表部分内容 , 请根据表中的信息完成相关问题。 (1) 铍原子的相对原子质量是 , 它属于 ( 填“金属”或“非金属” ) 元素。 图 9-7 9.012 金属 6. [2019 · 大庆节选 ] 元素周期表是学习和研究化学的重要工具。如图 9-7 是元素周期表部分内容 , 请根据表中的信息完成相关问题。 (2) 第三周期中含有的非金属元素共有 种。 图 9-7 5 6. [2019 · 大庆节选 ] 元素周期表是学习和研究化学的重要工具。如图 9-7 是元素周期表部分内容 , 请根据表中的信息完成相关问题。 (3) 元素周期表中的纵行叫做族 , 分为主族、副族、 Ⅷ 族和 0 族。主族用字母“ A ”表示 , 共有七个主族 , 依次用 ⅠA 族、 ⅡA 族、 ⅢA 族、 ⅣA 族、 VA 族、 ⅥA 族、 ⅦA 族表示。同一主族元素化学性质相似。 ① 甲同学研究了同主族元素原子结构的共同点 , 提出将氦元素放在第 ⅡA 族 , 甲同学的依据是 ____________________________________________ ; 乙同学进行了反驳 , 认为氦元素属于 0 族元素的一种 , 乙同学的依据是 _________________ _________________________________________ 。 [ 答案 ] (3)① 氦原子的最外层电子数为 2 氦原子只有一层电子 , 最外层为第一层时 , 有 2 个电子 , 就达到了稳定结构 , 和 0 族元素的原子结构类似 [ 解析 ] (3)① 同一主族元素 , 化学性质相似 , 决定元素化学性质的是最外层电子数。氦原子的最外层电子数为 2, 和 ⅡA 族元素的原子最外层电子数相等 , 所以甲同学提出将氦元素放在第 ⅡA 族 ; 乙同学进行了反驳 , 认为氦元素属于 0 族元素的一种 , 乙同学的依据是氦原子只有一层电子 , 最外层为第一层时 , 有 2 个电子 , 就达到了稳定结构 , 和 0 族元素的原子结构类似。 ② 硒元素是人体必需的微量元素之一 , 有防腐、抗癌的作用。硒原子结构示意 图为 , 请你分析硒元素在元素周期表中的位置是第 4 周期、第 ____ 族。 图 9-7 [ 答案 ] (3) ② ⅥA [ 解析 ] (3) ②硒原子有 4 个电子层 , 最外层有 6 个电子 , 故硒元素在元素周期表中的位置是第四周期、第 ⅥA 族。查看更多