2021新高考化学二轮总复习学案:专题八 水溶液中的离子平衡 Word版含解析
专题八 水溶液中的离子平衡
考情分析备考定向
备考要点说明 核心价值引领
1.了解电解质的概念。
了解强电解质和弱电
解质的概念。
2.理解电解质在水中
的电离以及电解质溶
液的导电性。
3.了解水的电离、离子
积常数。
4.了解溶液 pH 的含
义及其测定方法,能进
行 pH 的简单计算。
5.理解弱电解质在水
中的电离平衡,能利用
电离平衡常数进行相
关计算。
6.了解盐类水解的原
理、影响盐类水解程
度的主要因素、盐类
水解的应用。
7.了解难溶电解质的
沉淀溶解平衡。理解
溶度积(Ksp)的含义,能
进行相关的计算。
酸碱平衡是指在正常生理状态下,血液的酸碱度(pH)通常维持在一个范围内,即
动脉血 pH 稳定在 7.35~7.45(平均 7.40)之间的稳定状态。体内酸、碱产生过多或不足,
引起血液 pH 改变,此状态称为酸碱失衡。水溶液中也存在很多平衡,如何判断溶液的
酸碱性?泡沫灭火器中装的什么物质?原理是什么?这一节我们就来探讨这方面的问
题。
高频考点能力突破
考点一 溶液酸碱性及 pH
真题示例
1.(2019 全国Ⅲ)设 NA 为阿伏加德罗常数值。关于常温下 pH=2 的 H3PO4 溶液,下列说法正确的
是( )
A.每升溶液中的 H+数目为 0.02NA
B.c(H+)=c(H2PO-4)+2c(HPO2-
4 )+3c(PO3-
4 )+c(OH-)
C.加水稀释使电离度增大,溶液 pH 减小
D.加入 NaH2PO4 固体,溶液酸性增强
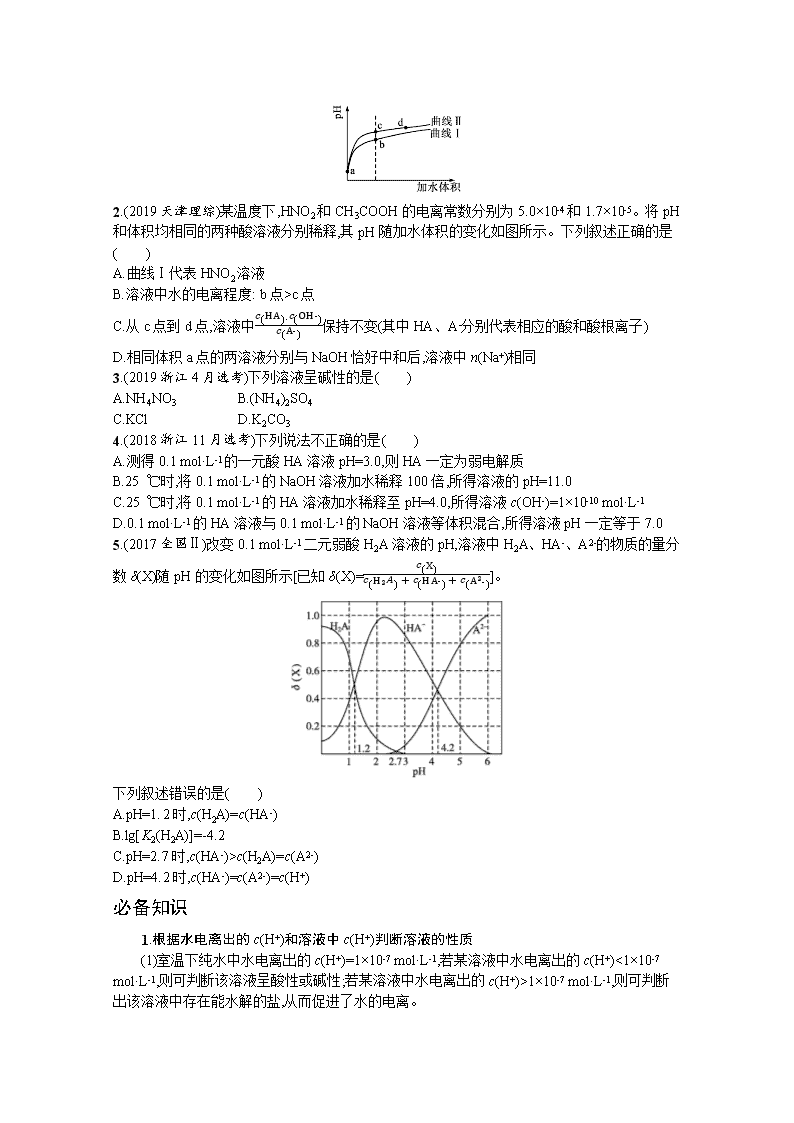
2.(2019 天津理综)某温度下,HNO2 和 CH3COOH 的电离常数分别为 5.0×10-4 和 1.7×10-5。将 pH
和体积均相同的两种酸溶液分别稀释,其 pH 随加水体积的变化如图所示。下列叙述正确的是
( )
A.曲线Ⅰ代表 HNO2 溶液
B.溶液中水的电离程度: b 点>c 点
C.从 c 点到 d 点,溶液中푐(HA)·푐(OH-)
푐(A-)
保持不变(其中 HA、A-分别代表相应的酸和酸根离子)
D.相同体积 a 点的两溶液分别与 NaOH 恰好中和后,溶液中 n(Na+)相同
3.(2019 浙江 4 月选考)下列溶液呈碱性的是( )
A.NH4NO3 B.(NH4)2SO4
C.KCl D.K2CO3
4.(2018 浙江 11 月选考)下列说法不正确的是( )
A.测得 0.1 mol·L-1 的一元酸 HA 溶液 pH=3.0,则 HA 一定为弱电解质
B.25 ℃时,将 0.1 mol·L-1 的 NaOH 溶液加水稀释 100 倍,所得溶液的 pH=11.0
C.25 ℃时,将 0.1 mol·L-1 的 HA 溶液加水稀释至 pH=4.0,所得溶液 c(OH-)=1×10-10 mol·L-1
D.0.1 mol·L-1 的 HA 溶液与 0.1 mol·L-1 的 NaOH 溶液等体积混合,所得溶液 pH 一定等于 7.0
5.(2017 全国Ⅱ)改变 0.1 mol·L-1 二元弱酸 H2A 溶液的 pH,溶液中 H2A、HA-、A2-的物质的量分
数 δ(X)随 pH 的变化如图所示[已知 δ(X)= 푐(X)
푐(H2퐴) + 푐(HA-) + 푐(A2-)]。
下列叙述错误的是( )
A.pH=1.2 时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7 时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2 时,c(HA-)=c(A2-)=c(H+)
必备知识
1.根据水电离出的 c(H+)和溶液中 c(H+)判断溶液的性质
(1)室温下纯水中水电离出的 c(H+)=1×10-7 mol·L-1,若某溶液中水电离出的 c(H+)<1×10-7
mol·L-1,则可判断该溶液呈酸性或碱性;若某溶液中水电离出的 c(H+)>1×10-7 mol·L-1,则可判断
出该溶液中存在能水解的盐,从而促进了水的电离。
(2)室温下,溶液中的 c(H+)>1×10-7 mol·L-1,说明该溶液是酸溶液或酸式盐溶液或水解呈酸
性的盐溶液;溶液中的 c(H+)<1×10-7 mol·L-1,说明该溶液是碱溶液或水解呈碱性的盐溶液等。
2.突破溶液酸、碱性判断的四条规律
(1)正盐溶液。
强酸强碱盐溶液显中性,强酸弱碱盐(如 NH4Cl)溶液显酸性,强碱弱酸盐(如 CH3COONa)溶
液显碱性。
(2)酸式盐溶液。
NaHSO4(NaHSO4 Na++H++SO2-
4 )、NaHSO3、NaHC2O4、NaH2PO4 水溶液显酸性(后三者
酸式酸根离子的电离程度大于水解程度),NaHCO3、NaHS、Na2HPO4 水溶液显碱性(酸式酸根离
子的水解程度大于电离程度)。
注意:因为浓度相同的 CH3COO-与 NH+4 的水解程度相同,所以 CH3COONH4 溶液显中性,
而 NH4HCO3 溶液略显碱性。
(3)弱酸(或弱碱)及其盐 1∶1 混合的溶液。
①CH3COOH 和 CH3COONa 混合液呈酸性(等浓度的 CH3COOH 与 CH3COO-,CH3COOH
的电离程度大于 CH3COO-的水解程度)。
②NH3·H2O 和 NH4Cl 混合溶液呈碱性。
(4)pH 之和等于 14 的酸、碱溶液等体积混合的溶液。
pH 之和等于 14 的意义:酸溶液中的氢离子浓度等于碱溶液中的氢氧根离子的浓度。
已知酸、碱溶液的 pH 之和为 14,则等体积混合时:
强酸、强碱,混合后溶液 pH=7,
强酸、弱碱,混合后溶液 pH>7,
弱酸、强碱,混合后溶液 pH<7。
应考训练
考向 1 水的电离与溶液的酸碱性
1.(2019 山东济南外国语学校高三模拟)下列说法不正确的是( )
A.将 pH 均为 a 的氢氧化钠溶液和氨水分别加水稀释到体积为原来的 100 倍,pH 变为 b 和 c,
则 a、b、c 的大小关系是:a>c>b
B.常温下,浓度均为 0.1 mol·L-1①醋酸、②盐酸、③醋酸钠溶液中,水的电离程度的顺序为③>①
>②
C.常温下,将相同体积 pH=3 的硫酸溶液和 pH=11 的一元碱 BOH 溶液混合,所得溶液可能为中
性也可能为酸性
D.物质的量浓度相同的①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH 的顺序为③>①>②
考向 2 电离平衡常数的计算及应用
2.常温下,将 10 mL 0.1 mol·L-1 NaA 溶液逐滴加入 10 mL 0.1 mol·L-1 HA 溶液中,已知 HA 的电
离平衡常数 Ka=1.8×10-4。下列说法正确的是( )
A.滴加过程中,混合溶液中 푐(A-)
푐(HA)的值始终变小
B.滴加过程中,混合溶液呈酸性
C.充分混合后,溶液中 A-的水解程度比原 NaA 溶液中 A-的水解程度大
D.充分混合后,溶液中 c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
考向 3 电离平衡及有关图像分析
3.(双选)(2020 山东日照一模)25 ℃时,分别稀释 pH=11 的 Ba(OH)2 溶液和氨水,溶液 pH 的变化
如下图所示。
已知:Kb(NH3·H2O)=1.8×10-5。下列说法正确的是( )
A.若 35 ℃时分别稀释上述两种溶液,则图中Ⅰ、Ⅱ曲线将比原来靠近
B.保持 25 ℃不变,取 A、B 两点对应的溶液等体积混合后,pH=9
C.由水电离产生的 c(H+):A 点>B 点
D.曲线Ⅰ上任意点对应的溶液中,
푐(H+)·푐(NH+
4 ) + 푐2(푁H+
4 )
푐(NH3·H2푂) =1.8×10-5 mol·L-1
考向 4 pH 的有关计算
4.已知水在 25 ℃和 95 ℃时,其电离平衡曲线如图所示:
(1)则 25 ℃时水的电离平衡曲线应为 (填“A”或“B”),请说明理由: 。
(2)95 ℃时,若 100 体积 pH1=a 的某强酸溶液与 1 体积 pH2=b 的某强碱溶液混合后溶液呈中性,
则混合前,该强酸溶液的 pH1 与强碱溶液的 pH2 之间应满足的关系是 。
(3)95 ℃时,向 Ba(OH)2 溶液中逐滴加入 pH=a 的盐酸,测得混合溶液的部分 pH 如下表所示。
实
验
序
号
Ba(OH)2 溶
液
的体积/mL
盐酸的
体积
/mL
溶液的
pH
① 22.00 0.00 8
② 22.00 18.00 7
③ 22.00 22.00 6
假设溶液混合前后的体积不变,则 a= ,实验②所得溶液中由水电离产生的 c(OH-)=
mol·L-1。
考点二 溶液中的“三大平衡”与“四大常数”
真题示例
1.(2020 山东化学)25 ℃时,某混合溶液中 c(CH3COOH)+c(CH3COO-)=0.1
mol·L-1,lgc(CH3COOH)、lgc(CH3COO-)、lgc(H+)和 lgc(OH-)随 pH 变化的关系如图所示。Ka 为
CH3COOH 的电离常数,下列说法正确的是( )
A.O 点时,c(CH3COOH)=c(CH3COO-)
B.N 点时,pH=-lgKa
C.该体系中,c(CH3COOH)= 0.1푐(H+)
퐾a + 푐(H+) mol·L-1
D.pH 由 7 到 14 的变化过程中,CH3COO-的水解程度始终增大
2.(2020 天津化学)常温下,下列有关电解质溶液的说法错误的是( )
A.相同浓度的 HCOONa 和 NaF 两溶液,前者的 pH 较大,则 Ka(HCOOH)>Ka(HF)
B.相同浓度的 CH3COOH 和 CH3COONa 两溶液等体积混合后 pH 约为 4.7,则溶液中
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.FeS 溶于稀硫酸,而 CuS 不溶于稀硫酸,则 Ksp(FeS)>Ksp(CuS)
D.在 1 mol·L-1 Na2S 溶液中,c(S2-)+c(HS-)+c(H2S)=1 mol·L-1
3.(2019 北京理综)实验测得 0.5 mol·L-1 CH3COONa 溶液、0.5 mol·L-1 CuSO4 溶液以及 H2O 的
pH 随温度变化的曲线如图所示。下列说法正确的是( )
A.随温度升高,纯水中 c(H+)>c(OH-)
B.随温度升高,CH3COONa 溶液的 c(OH-)减小
C.随温度升高,CuSO4 溶液的 pH 变化是 KW 改变与水解平衡移动共同作用的结果
D.随水温升高,CH3COONa 溶液和 CuSO4 溶液的 pH 均降低,是因为 CH3COO-、Cu2+水解平衡移
动方向不同
4.(2019 全国Ⅱ)绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是
一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A.图中 a 和 b 分别为 T1、T2 温度下 CdS 在水中的溶解度
B.图中各点对应的 Ksp 的关系为:Ksp(m)=Ksp(n)
Ksp(CuS)
C.根据表中数据可推知,向硫酸钡沉淀中加入饱和碳酸钠溶液,不可能有碳酸钡生成
D.常温下,CaSO4 在 0.05 mol·L-1 CaCl2 溶液中比在 0.01 mol·L-1 Na2SO4 溶液中的溶解度小
考向 4 四大平衡常数的应用
4.常温下,某酸 HA 的电离常数 K=1×10-5,下列说法正确的是( )
A.HA 溶液中加入 NaA 固体后,푐(HA)·푐(OH-)
푐(A-)
减小
B.常温下,0.1 mol·L-1 HA 溶液中水电离的 c(H+)为 10-13 mol·L-1
C.NaA 溶液中加入 HCl 溶液至恰好完全反应,存在关系:2c(Na+)=c(A-)+c(Cl-)
D.常温下,0.1 mol·L-1 NaA 溶液中 A-的水解常数为 10-9
考点三 溶液中粒子浓度大小比较
真题示例
1.(2019 浙江 4 月选考)室温下,取 20 mL 0.1 mol·L-1 某二元酸 H2A,滴加 0.2 mol·L-1NaOH 溶液。
已知:H2A H++HA-,HA- H++A2-。下列说法不正确的是( )
A.0.1 mol·L-1H2A 溶液中有 c(H+)-c(OH-)-c(A2-)=0.1 mol·L-1
B.当滴加至中性时,溶液中 c(Na+)=c(HA-)+2c(A2-),用去 NaOH 溶液的体积小于 10 mL
C.当用去 NaOH 溶液体积 10 mL 时,溶液的 pH<7,此时溶液中有 c(A2-)=c(H+)-c(OH-)
D.当用去 NaOH 溶液体积 20 mL 时,此时溶液中有 c(Na+)=2c(HA-)+2c(A2-)
2.(2018 江苏化学)H2C2O4 为二元弱酸,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,设 H2C2O4 溶
液中 c(总)=c(H2C2O4)+c(HC2O-4)+c(C2O2-
4 )。室温下用 NaOH 溶液滴定 25.00 mL 0.100 0 mol·L-1
H2C2O4 溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.0.100 0 mol·L-1 H2C2O4 溶液:c(H+)=0.100 0 mol·L-1+c(C2O2-
4 )+c(OH-)-c(H2C2O4)
B.c(Na+)=c(总)的溶液:c(Na+)>c(H2C2O4)>c(C2O2-
4 )>c(H+)
C.pH=7 的溶液:c(Na+)=0.100 0 mol·L-1+c(C2O2-
4 )-c(H2C2O4)
D.c(Na+)=2c(总)的溶液:c(OH-)-c(H+)=2c(H2C2O4)+c(HC2O-4)
3.(2017 全国Ⅰ)常温下,将 NaOH 溶液滴加到己二酸(H2X)溶液中,混合溶液的 pH 与离子浓度变
化的关系如图所示。下列叙述错误的是( )
A.Ka2(H2X)的数量级为 10-6
B.曲线 N 表示 pH 与 lg푐(HX-)
푐(H2푋)的变化关系
C.NaHX 溶液中 c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
4.(2015 山东理综)室温下向 10 mL 0.1 mol·L-1 NaOH 溶液中加入 0.1 mol·L-1 的一元酸 HA,溶液
pH 的变化曲线如图所示。下列说法正确的是( )
A.a 点所示溶液中 c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b 两点所示溶液中水的电离程度相同
C.pH=7 时,c(Na+)=c(A-)+c(HA)
D.b 点所示溶液中 c(A-)>c(HA)
必备知识
1.依据“三大守恒”突破离子浓度的关系
(1)电荷守恒。电解质溶液中所有阳离子所带的正电荷总数与所有阴离子所带的负电荷总
数相等。如在 Na2CO3 溶液中存在着 Na+、CO2-
3 、H+、OH-、HCO-3,它们存在如下关
系:c(Na+)+c(H+)=2c(CO2-
3 )+c(HCO-3)+c(OH-)。
(2)物料守恒。电解质溶液中,由于某些离子能水解或电离,会使离子种类增多,但某些关键性
的原子总是守恒的。如在 Na2CO3 溶液中:
(3)质子守恒。在电离或水解过程中,会发生质子(H+)转移,但在质子转移过程中其数量保持
不变,如在 Na2CO3 溶液中:c(OH-)=c(HCO-3)+2c(H2CO3)+c(H+)。
2.分析溶液中微粒浓度关系的思维流程
3.盐溶液蒸干灼烧时所得产物的判断规律
(1)盐溶液水解生成难挥发性酸时,蒸干后一般得原物质,如 CuSO4(aq) CuSO4(s);盐溶液
水解生成易挥发性酸时,蒸干灼烧后一般得对应的氧化物,如 AlCl3(aq) Al(OH)3 Al2O3。
(2)酸根阴离子易水解的强碱盐,如 Na2CO3 溶液等蒸干后可得到原物质。
(3)考虑盐受热时是否分解。如 Ca(HCO3)2、NaHCO3、KMnO4、NH4Cl 等固体受热易分解,
因此蒸干灼烧后分别为 Ca(HCO3)2 CaCO3(CaO),NaHCO3 Na2CO3,KMnO4
K2MnO4+MnO2,NH4Cl NH3↑+HCl↑。
(4)还原性盐在蒸干时会被 O2 氧化。例如:Na2SO3(aq) Na2SO4(s)。
应考训练
考向 1 溶液中离子浓度大小比较
1.(双选)(2020 山东济宁三模)PT(KHC2O4·H2C2O4·2H2O,名称:四草酸钾)是一种分析试剂。室温
时,H2C2O4 的 pKa1、pKa2 分别为 1.23、4.19(pKa=-lg Ka)。下列说法不正确的是( )
A.0.1 mol·L-1 PT 溶液中:c(HC2O-4)>c(K+)>c(H2C2O4)
B.向 0.1 mol·L-1 PT 溶液中滴加 NaOH 溶液至溶液 pH=4.19:c(C2O2-
4 )=c(HC2O-4)
C.向 0.1 mol·L-1 PT 溶液中滴加 NaOH 溶液至溶液呈中性:c(K+)>c(Na+)>c(HC2O-4)>c(C2O2-
4 )
D.0.1 mol·L-1 PT 溶液与 0.1 mol·L-1 KOH 溶液等体积混合,溶液中水的电离程度比纯水的大
考向 2 结合酸碱滴定曲线进行考查
2.(2020 山东一模)25 ℃时,向 10 mL 0.10 mol·L-1 的一元弱酸 HA(Ka=1.0×10-3)溶液中逐滴加入
0.10 mol·L-1 NaOH 溶液,溶液 pH 随加入 NaOH 溶液体积的变化关系如图所示。下列说法正确
的是( )
A.a 点时,c(HA)+c(OH-)=c(Na+)+c(H+)
B.溶液在 a 点和 b 点时水的电离程度不相同
C.b 点时,c(Na+)=c(HA)+c(A-)+c(OH-)
D.V=10 时,c(Na+)>c(A-)>c(H+)>c(HA)
方法技巧抓五点突破中和滴定图像
(1)抓反应的“起始点”:判断酸、碱的相对强弱。
(2)抓反应“一半点”:判断是哪些溶质的等量混合。
(3)抓“恰好反应点”:判断生成的溶质成分及溶液的酸碱性。
(4)抓溶液的“中性点”:判断溶液中溶质的成分及哪种物质过量或不足。
(5)抓反应的“过量点”:判断溶液中的溶质,判断哪种物质过量。
例如:室温下,向 20mL0.1mol·L-1HA 溶液中逐滴加入 0.1mol·L-1NaOH 溶液,溶液 pH 的变化
如图所示:
起始点 A,0.1mol·L-1HA 溶液的 pH>1,故 HA 为弱酸。
一半点 B,溶质为 NaA 和 HA,且푛(NaA)
푛(HA) =1,pH<7,溶液中:c(A-)>c(Na+)>c(H+)>c(OH-)。
中性点 C,溶质为 NaA 和 HA(稍过量),pH=7,溶液中:c(Na+)=c(A-)>c(H+)=c(OH-)。
恰好反应点 D,溶质为 NaA,pH>7,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)。
过量点 E,溶质为 NaA、NaOH,pH>7,溶液中:c(Na+)>c(OH-)>c(A-)>c(H+)。
考向 3 结合 pH 与微粒浓度、微粒物质的量分数的关系图像考查
3.(双选)(2020 山东滨州二模)柠檬酸(用 H3R 表示)是一种高效除垢剂。常温时,用一定浓度的柠
檬酸溶液去除水垢,溶液中 H3R、H2R-、HR2-、R3-的物质的量百分数随 pH 的变化如图所示。
下列说法正确的是( )
A.由 a 点判断 H3R 的第一步电离常数 Ka1(H3R)的数量级为 10-3
B.若 b 点溶液中金属阳离子只有 Na+,则有 c(Na+)=c(R3-)+c(HR2-)+c(H2R-)+c(H3R)
C.pH=6 时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
D.反应 2H2R- H3R+HR2-在该温度下的平衡常数 K=10x-y
考点四 酸碱中和滴定及迁移应用
真题示例
1.(2020 全国Ⅰ)以酚酞为指示剂,用 0.100 0 mol·L-1 的 NaOH 溶液滴定 20.00 mL 未知浓度的二
元酸 H2A 溶液。溶液中,pH、分布系数 δ 随滴加 NaOH 溶液体积 V(NaOH 溶液)的变化关系如
下图所示。
[比如 A2-的分布系数:δ(A2-)= 푐(A2-)
푐(H2퐴) + 푐(HA-) + 푐(A2-)]
下列叙述正确的是( )
A.曲线①代表 δ(H2A),曲线②代表 δ(HA-)
B.H2A 溶液的浓度为 0.200 0 mol·L-1
C.HA-的电离常数 Ka=1.0×10-2
D.滴定终点时,溶液中 c(Na+)<2c(A2-)+c(HA-)
2.(2019 全国Ⅰ)NaOH 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸 H2A 的 Ka1=1.1×10-3,Ka2=3.9×10-6)
溶液,混合溶液的相对导电能力变化曲线如图所示,其中 b 点为反应终点。下列叙述错误的是
( )
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与 A2-的导电能力之和大于 HA-的
C.b 点的混合溶液 pH=7
D.c 点的混合溶液中,c(Na+)>c(K+)>c(OH-)
3.(2018 全国Ⅲ)用 0.100 mol·L-1 AgNO3 溶液滴定 50.0 mL 0.050 0 mol·L-1 Cl-溶液的滴定曲线
如图所示。下列有关描述错误的是( )
A.根据曲线数据计算可知 Ksp(AgCl)的数量级为 10-10
B.曲线上各点的溶液满足关系式 c(Ag+)·c(Cl-)=Ksp(AgCl)
C.相同实验条件下,若改为 0.040 0 mol·L-1 Cl-,反应终点 c 移到 a
D.相同实验条件下,若改为 0.050 0 mol·L-1 Br-,反应终点 c 向 b 方向移动
4.(2018 全国Ⅲ)硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)可用作定影剂、还原剂。回答下
列问题:
(1)已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaS2O3)=4.1×10-5。市售硫代硫酸钠中常含有硫酸根杂质,选用
下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀硫酸、BaCl2 溶液、Na2CO3 溶液、H2O2 溶液
实验步骤 现象
①取少量样品,加入除氧
蒸馏水
②固体完全溶解得无色澄清溶
液
③
④ ,有刺激性气体
产生
⑤静置, ⑥
(2)利用 K2Cr2O7 标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取 1.200 0 g 某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在 中
溶解,完全溶解后,全部转移至 100 mL 的 中,加蒸馏水至 。
②滴定:取 0.009 50 mol·L-1 的 K2Cr2O7 标准溶液 20.00 mL,硫酸酸化后加入过量 KI,发生反
应:Cr2O2-
7 +6I-+14H+ 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反
应:I2+2S2O2-
3 S4O2-
6 +2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液 ,即为终点。平行
滴定 3 次,样品溶液的平均用量为 24.80 mL,则样品纯度为 %(保留 1 位小数)。
必备知识
中和滴定考点归纳
(1)“考”实验仪器。
酸式滴定管、碱式滴定管、滴定管夹(带铁架台)、锥形瓶。其中常考的是滴定管,如正确选
择滴定管(包括量程),滴定管的检漏、洗涤和润洗,滴定管的正确读数方法等。
(2)“考”操作步骤。
①滴定前的准备:检漏、洗涤、润洗、充液(赶气泡)、调液面、读数。
②滴定:移液、滴加指示剂、滴定至终点、读数。
③计算。
(3)“考”指示剂的选择。
①强酸强碱相互滴定,可选用甲基橙或酚酞。
②若反应生成强酸弱碱盐,溶液呈酸性,则选用酸性变色范围的指示剂(甲基橙),若反应生成
强碱弱酸盐,溶液呈碱性,则选用碱性变色范围的指示剂(酚酞)。
③石蕊溶液因颜色变化不明显,且变色范围过宽,一般不用作指示剂。
(4)“考”误差分析。
写出计算式,分析操作对 V 标的影响,由计算式得出对最终测定结果的影响,切忌死记硬背
结论。此外对读数时视线(俯视、仰视)问题的判断要学会画图分析。
(5)“考”数据处理。
正确“取舍”数据,计算“平均”体积,根据反应式确定标准液与待测液浓度和体积的关系,从而
列出公式进行计算。
应考训练
考向 1 酸碱中和滴定曲线的理解和应用
1.(2020 河南九师联盟五月联考)等体积两种一元酸“酸 1”和“酸 2”分别用等浓度的 KOH 溶液滴
定,滴定曲线如图所示。下列说法错误的是( )
A.“酸 1”比“酸 2”的酸性强
B.“酸 2”的浓度为 0.01 mol·L-1
C.“酸 2”的 Ka 的数量级约为 10-5
D.滴定“酸 1”和“酸 2”均可用酚酞作指示剂
考向 2 沉淀滴定
2.(双选)(2020 山东潍坊二模)常温下,用 AgNO3 溶液分别滴定浓度均为 0.01 mol·L-1 的 KSCN、
K2CrO4 溶液,所得的沉淀溶解平衡图像如图所示。下列叙述错误的是( )
A.Ksp(Ag2CrO4)的数值为 10-9.92
B.a 点表示的是 Ag2CrO4 的不饱和溶液
C.沉淀废液中的 Ag+用 K2CrO4 溶液比等浓度的 KSCN 溶液效果好
D.反应 Ag2CrO4(s)+2SCN-(aq) 2AgSCN(s)+CrO2-
4 (aq)的平衡常数为 1012.08
考向 3 氧化还原滴定
3.2014 年德美科学家因开发超分辨荧光显微镜获得了诺贝尔化学奖,他们开创性的成就使光学
显微镜分辨率步入了纳米时代。
Ⅰ.制纳米碳酸钙:在浓 CaCl2 溶液中通入 NH3 和 CO2 可以制得纳米级碳酸钙。下图所示 A~E
为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
(1)实验室中若用浓氨水和生石灰制取并收集干燥的 NH3,请选择装置并按气流方向连接各仪器
接口 (填装置接口顺序);若在实验室要制取并收集干燥的 CO2,则需选用上述仪
器装置中的 (填装置序号)。
(2)向浓 CaCl2 溶液中通入 NH3 和 CO2 气体制纳米级碳酸钙时,应先通入的气体是 ,
试写出制纳米级碳酸钙的离子方程式:
。
Ⅱ.纳米 TiO2 在涂料、光催化、化妆品等领域有着极其广泛的应用。
(3)制备纳米 TiO2:可将 TiCl4 水解产物经加热脱水制得纳米级 TiO2。已知 25 ℃
时,Ksp[Ti(OH)4]=7.94×10-54,该温度下测得 TiCl4 溶液的 pH=3,则此时溶液中
c(Ti4+)= 。
(4)用氧化还原滴定法测定 TiO2 的质量分数。一定条件下,将 TiO2 溶解并还原为 Ti3+,再以
KSCN 溶液作指示剂,用 NH4Fe(SO4)2 标准溶液滴定 Ti3+至全部生成 Ti4+。配制 NH4Fe(SO4)2 标
准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的
(填字母代号)。
(5)滴定终点的现象是
。
(6)滴定分析时,称取 TiO2 试样 1.80 g,消耗 0.400 mol·L-1 NH4Fe(SO4)2 标准溶液 45.00 mL,则试
样中 TiO2 的质量分数为 。
专题八 水溶液中的离子平衡
考点一
真题示例 1.B 解析常温下,pH=2 的 H3PO4 溶液中 c(H+)=1×10-2mol·L-1,则 1L 溶液
中 H+的数目为 0.01NA,A 项错误;磷酸溶液中的阳离子有 H+,阴离子有 H2PO-4、HP
O2-
4 、PO3-
4 及 OH-,根据电荷守恒可得 c(H+)=c(H2PO-4)+2c(HPO2-
4 )+3c(PO3-
4 )+c(OH-),B
项正确;磷酸为弱电解质,加水稀释促进电离,但 c(H+)减小,pH 增大,C 项错误;磷酸的
第一步电离方程式为 H3PO4 H2PO-4+H+,向磷酸溶液中加入 NaH2PO4 固体,根据同
离子效应可知,磷酸电离平衡向逆向移动,溶液酸性减弱,D 项错误。
2.C 解析 A 项,根据两种酸的电离常数可知,酸性:HNO2>CH3COOH,pH 相同的两
种酸稀释相同倍数,pH 变化大的是相对较强的酸,即曲线Ⅱ表示 HNO2 溶液的稀释,
错误;B 项,pH 越小酸性越强,对水电离的抑制程度越大,因此溶液中水的电离程度:b
点c(H2A)=c(A2-),C 正确;D 项,根据 pH=4.2 时,c(HA-)=c(A2-),且物质的量分
数约为 0.48,而 c(H+)=10-4.2mol·L-1,可知 c(HA-)=c(A2-)>c(H+),D 错误。
应考训练 1.C 解析将 pH 均为 a 的氢氧化钠溶液和氨水分别加水稀释到体积为原
来的 100 倍,对于 NaOH 溶液来说,只有稀释作用,但氨水中电离平衡正向移动,使溶
液中 c(OH-)减小的程度比 NaOH 小,所以稀释后氨水中的 c(OH-)大,则 a、b、c 的大
小关系是 a>c>b,A 正确;醋酸是弱酸,电离产生的 H+的浓度小于等浓度的盐酸,所以
抑制作用盐酸大于醋酸;而醋酸钠是强碱弱酸盐,CH3COO-水解促进水的电离,使水
的电离平衡正向移动,所以常温下,浓度均为 0.1mol·L-1 的①醋酸、②盐酸、③醋酸
钠溶液中,水的电离程度的顺序为③>①>②,B 正确;硫酸溶液 pH=3,则
c(H+)=10-3mol·L-1,碱溶液 pH=11,则 c(OH-)=10-3mol·L-1,如果 BOH 是一元强碱,则二
者等体积混合后,H+与 OH-恰好完全反应,反应后溶液显中性,若 BOH 是弱碱,由于
在溶液中含有未电离的 BOH,使溶液显碱性,C 错误;硫酸铵电离产生的铵根离子浓
度大于氯化铵,所以溶液的酸性硫酸铵强,碳酸氢铵是弱酸弱碱盐,阳离子、阴离子都
发生水解反应,水解相互促进,由于铵根水解程度小于碳酸氢根离子,所以溶液显碱
性,故等物质的量浓度的①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH 的顺
序为③>①>②,D 正确。
2.B 解析 Ka=푐(A-)·푐(H+)
푐(HA) =1.8×10-4,滴加过程中,氢离子浓度减小,则混合溶液中 푐(A-)
푐(HA)
的值始终变大,故 A 错误;Ka=1.8×10-4,则 HA 的电离程度大于 A-的水解程度,滴加过
程中,混合溶液呈酸性,故 B 正确;充分混合后,溶液为 NaA 和 HA 的混合溶液,HA
溶液抑制 A-的水解,故 C 错误;充分混合后,溶液为 NaA 和 HA 的混合液,且 HA 的
电离大于 A-水解,则溶液中 c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-),故 D 错误。
3.BD 解析 25℃时,Ba(OH)2 溶液和氨水的 pH 相同,由于 Ba(OH)2 是强电解质,在
溶液中完全电离,稀释到体积为原来的 100 倍时,Ba(OH)2 溶液的 pH 从 11 变为 9,
而 NH3·H2O 是弱电解质,在溶液中部分电离,稀释到体积为原来的 100 倍时,稀释过
程中氨水会继续电离出 OH-,导致溶液中 OH-的浓度大于 Ba(OH)2 溶液中的 OH-,溶
液的 pH>9,因此曲线Ⅰ代表氨水稀释时溶液 pH 随稀释倍数的变化,曲线Ⅱ代表
Ba(OH)2 溶液稀释时溶液 pH 随稀释倍数的变化。温度升高,KW 变大,则在 35℃时分
别稀释上述两种溶液,则图中Ⅰ、Ⅱ曲线将比原来疏远,A 项错误;25℃时,A、B 两点
对应的溶液的 pH 均为 9,保持 25℃不变,则 KW 不变,两者等体积混合后,溶液中 H+
浓度不变,故 pH 仍不变,B 项正确;A、B 两点溶液 pH 相等,即 A、B 两点溶液中 c(H+)
相等,由于溶液中的 H+只来自水的电离,所以 A、B 两点水电离产生的 c(H+)相等,C
项错误;曲线Ⅰ上任意点对应的溶液中存在电荷守恒:c(OH-)=c(H+)+c(NH+4 ),则有
푐(H+)·푐(NH+
4 ) + 푐2(푁H+
4 )
푐(NH3·H2푂) =
[푐(H+) + 푐(NH+
4 )]푐(NH+
4 )
푐(NH3·H2푂) =
푐(OH-)·푐(NH+
4 )
푐(NH3·H2푂)
=Kb(NH3·H2O)=1.8×10-5mol·L-1,D 项正确。
4.答案(1)A 水的电离是吸热过程,温度较低时,电离程度较小,c(H+)、c(OH-)均较小
(2)a+b=14(或 pH1+pH2=14) (3)4 1.0×10-7
解析(1)温度升高时促进水的电离,水的离子积增大,水中氢离子浓度、氢氧根离子浓
度都增大,水的 pH 减小,但溶液仍然呈中性。因此结合图像中 A、B 曲线变化情况
及氢离子浓度、氢氧根离子浓度可以判断,25℃时水的电离平衡曲线应为 A。
(2)要注意 95℃时,水的离子积为 1×10-12,即 c(H+)·c(OH-)=1×10-12,则等体积强酸、
强碱溶液反应至中性时,有 pH(酸)+pH(碱)=12。根据 95℃时混合后溶液呈中
性,pH2=b 的某强碱溶液中 c(OH-)=10b-12mol·L-1;根据溶液呈中性可得
100V×10-amol·L-1=V×10b-12mol·L-1,可得 10-푎+2=10b-12,即 a+b=14 或 pH1+pH2=14。
(3)此条件下,pH=6 时溶液呈中性,根据表中实验①数据可得 Ba(OH)2 溶液中
c(OH-)=1.0×10-4mol·L-1,根据表中实验③的数据可以判断,盐酸中的 c(H+)与
Ba(OH)2 溶液中 c(OH-)相等,所以 a=4,即盐酸的 pH=4;实验②溶液呈碱性,其
c(OH-)=22.00 × 10-4 - 18.00 × 10-4
22.00 + 18.00 mol·L-1=1.0×10-5mol·L-1,则由水电离出的
c(OH-)=1.0×10-7mol·L-1。
考点二
真题示例 1.BC 解析在 CH3COO-、CH3COOH 的混合溶液中,随着 pH 的增
大,lgc(CH3COOH)减小,lgc(CH3COO-)增大。当 pH=0 时,c(H+)=1mol·L-1,又由于
c(CH3COOH)+c(CH3COO-)=0.1mol·L-1,所以 c(H+)>c(CH3COOH)>c(CH3COO-)。N 点
时 c(CH3COOH)=c(CH3COO-),Ka=
푐(H+)푐(CH3퐶푂O-)
푐(CH3퐶푂푂퐻) =c(H+),pH=-lgc(H+)=-lgKa,B 项正确;O
点时 c(H+)=c(OH-),c(CH3COO-)>c(CH3COOH),该体系
中,c(CH3COO-)=0.1mol·L-1-c(CH3COOH),因为 Ka=
푐(H+)푐(CH3퐶푂O-)
푐(CH3퐶푂푂퐻) =
푐(H+)·[0.1 - 푐(CH3퐶푂푂퐻)]
푐(CH3퐶푂푂퐻) ,整理可得,c(CH3COOH)= 0.1푐(H+)
퐾a + 푐(H+)mol·L-1,故 A 项错误,C 项正
确;pH 从 7 到 14 的过程中,存在随 c(OH-)增大,CH3COO-+H2O CH3COOH+OH-水
解平衡逆向移动的过程,D 项错误。
2.A 解析根据“越弱越水解”,相同浓度的 HCOONa 和 NaF 的溶液,pH 大的水解程
度大,对应的酸的 Ka 小,A 项错误;相同浓度的 CH3COOH 和 CH3COONa 两溶液等
体积混合后,pH 约为 4.7,溶液中主要存在两个平衡:CH3COOH CH3COO-+H+、
CH3COO-+H2O CH3COOH+OH-,因为溶液显酸性,所以以 CH3COOH 的电离为主,
故离子浓度:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),B 项正确;FeS 加入稀硫酸中,H+使
FeS 沉淀溶解平衡右移,FeS 逐渐溶解,而 CuS 不能发生此现象,说明
Ksp(FeS)>Ksp(CuS),C 项正确;1mol·L-1Na2S 溶液中存在 S2-+H2O HS-+OH-、
HS-+H2O H2S+OH-,根据物料守恒可得 c(S2-)+c(HS-)+c(H2S)=1mol·L-1,D 项正确。
3.C 解析随温度升高,KW 增大,但纯水中的 c(H+)仍然等于 c(OH-),A 错误;随温度升
高,CH3COONa 水解平衡和水的电离平衡均会正向移动,c(OH-)增大,图中 pH 略有
减小,应是水的电离平衡正向移动所致,B 错误;随温度升高,CuSO4 水解程度增
大,c(H+)增大,pH 减小,而且升温也会导致水的电离平衡正向移动,KW 增大,C 正确;D
项,随水温升高,CH3COO-、Cu2+水解平衡均正向移动,D 错误。
4.B 解析 CdS 在水中存在沉淀溶解平衡:CdS(s) Cd2+(aq)+S2-(aq),电离出 S2-的浓
度与 Cd2+的浓度相同,A 项正确;沉淀溶解平衡常数只与温度有关,温度相同,Ksp 相
同,所以 m、p、n 三点的 Ksp 相同,B 项错误;在 T1 温度下,向 m 点的溶液中加入少量
Na2S 固体,S2-浓度增大,但由于 Ksp 不变,所以 Cd2+浓度必然减小,因此溶液组成由
m 沿 mpn 线向 p 方向移动,C 项正确;温度降低,CdS 的 Ksp 减小,但 S2-浓度与 Cd2+浓
度仍然相等,所以 q 点饱和溶液的组成由 q 沿 qp 线向 p 方向移动,D 项正确。
5.C 解析由①④时刻溶液加入盐酸酸化的氯化钡溶液,④产生白色沉淀较多,说明
升温过程中亚硫酸钠被空气中氧气氧化为硫酸钠,导致亚硫酸根浓度减小。A 项,亚
硫酸钠为强碱弱酸盐,在溶液中水解使溶液显碱性,A 正确;B 项,④与①的 pH 不同
是因为亚硫酸钠被空气中的氧气氧化为硫酸钠,导致亚硫酸根浓度减小,溶液 pH 减
小,正确;C 项,升高温度,水解平衡右移,减小亚硫酸根浓度,平衡左移,错误;D 项,①与
④的温度相同,则水的离子积常数 KW 相同,正确。
6.D 解析 LiH2PO4 溶液中存在 H2PO-4、HPO2-
4 两种粒子的电离平衡和水解平衡,还
有水的电离平衡、H3PO4 的电离平衡,A 项错误;含磷元素的粒子有 H3PO4、H2PO-4、
HPO2-
4 、PO3-
4 ,B 项错误;根据图 1 可知,随 c 初始(H2PO-4)增大,溶液的 pH 并没有明显减
小,C 项错误;根据图 2 可知 pH 达到 4.66 时,H3PO4 几乎全部转化为 H2PO-4或
LiH2PO4,D 项正确。
应考训练 1.B 解析升温促进电离,则升温至 30℃时,溶液中푐(HX)
푐(X-)
< 99
1 ,A 错误;平衡
时溶液中 c(H+)≈c(X-)=0.2× 1
99 + 1mol·L-1=2×10-3mol·L-1,c(HX)=0.2× 99
99 + 1
mol·L-1≈0.2mol·L-1,由此求出 K(HX)≈2×10-5,B 正确;加入的 NaX 电离出 X-,使 HX 的
电离平衡逆向移动,由于加入的 X-只有部分转化为 HX,即最终溶液中 c(X-)增大,C
错误;由 c(H+)·c(OH-)=KW 可知,稀释过程中 c(OH-)增大,D 错误。
2.B 解析加入 100mL0.1mol·L-1 盐酸,由于铵根离子部分水解,则 2c(NH+4 )Ksp(BaSO4),但两者相差不大,当 c(Ba2+)·c(CO2-
3 )>Ksp(BaCO3)时,硫酸
钡可能转化为碳酸钡,C 项错误;根据同离子效应可知,CaSO4 在 0.05mol·L-1CaCl2 溶
液中比在 0.01mol·L-1Na2SO4 溶液中的溶解度小,D 项正确。
4.D 解析푐(HA)·푐(OH-)
푐(A-)
是 A-的水解平衡常数表达式,加入 NaA 固体后,由于温度不变,
则水解平衡常数不变,A 项错误;由于 HA 为弱酸,则常温下 0.1mol·L-1HA 溶液中氢
离子浓度小于 0.1mol·L-1,水电离的 c(H+)一定大于1 × 10-14
0.1 mol·L-1=10-13mol·L-1,B 项
错误;NaA 溶液中加入 HCl 溶液至恰好完全反应,NaA 和 HCl 的物质的量相等,根据
物料守恒可得 2c(Na+)=c(A-)+c(Cl-)+c(HA),C 项错误;NaA 溶液中 A-的水解平衡常
数 Kh=푐(HA)·푐(OH-)
푐(A-)
=
퐾W
퐾(HA) = 1 × 10-14
1 × 10-5 =10-9,故 D 项正确。
考点三
真题示例 1.B 解析 A 项,由电荷守恒可知,c(H+)=2c(A2-)+c(HA-)+c(OH-),即
c(HA-)=c(H+)-2c(A2-)-c(OH-),由原子个数守恒可知,c(A-)+c(HA-)=0.1mol·L-1,将
c(HA-)=c(H+)-2c(A2-)-c(OH-)代入原子个数守恒式,即得
c(H+)-c(A2-)-c(OH-)=0.1mol·L-1,所以正确,不符合题意;B 项,根据电荷守恒可
知,c(H+)+c(Na+)=2c(A2-)+c(HA-)+c(OH-),因溶液呈中性,即得 c(Na+)=2c(A2-)+c(HA-),
如果 c(Na+)=c(HA-),说明加入 NaOH 溶液的体积等于 10mL,当
c(Na+)=2c(A2-)+c(HA-)时,说明加入 NaOH 的体积大于 10mL,所以错误,符合题意;C
项,如果加入 10mL 氢氧化钠溶液时,溶液中溶质为 NaHA,根据质子守恒可
知,c(H+)=c(A2-)+c(OH-),即 c(A2-)=c(H+)-c(OH-),所以正确,不符合题意;D 项,如果加
入 20mL 氢氧化钠溶液时,溶液中溶质为 Na2A,因为 H2A 的第一步完全电离,因此溶
液中含 A 元素的微粒只有 A2-和 HA-,根据原子个数守恒可
知,c(Na+)=2c(A2-)+2c(HA-),所以正确,不符合题意。
2.AD 解析根据电荷守恒可得:c(H+)=c(OH-)+2c(C2O2-
4 )+c(HC2O-4),根据物料守恒
得:0.1000mol·L-1=c(H2C2O4)+c(C2O2-
4 )+c(HC2O-4),两者相减
得:c(H+)-0.1000mol·L-1=c(C2O2-
4 )+c(OH-)-c(H2C2O4),A 项正确;c(Na+)=c(总),说明
NaOH 与 H2C2O4 按物质的量之比 1∶1 反应,完全生成 NaHC2O4 溶液,根据电离常
数,HC2O-4电离程度大于水解程度,则 c(C2O2-
4 )>c(H2C2O4),B 项错误;根据电荷守恒
得:c(Na+)+c(H+)=c(HC2O-4)+2c(C2O2-
4 )+c(OH-),由于 c(H+)=c(OH-),则有 c(Na+)=c(HC2
O-4)+2c(C2O2-
4 ),而 c(HC2O-4)+c(C2O2-
4 )+c(H2C2O4)=c(总),所以
c(Na+)=c(总)-c(H2C2O4)+c(C2O2-
4 ),反应过程中溶液稀释,c(总)小于 0.1000mol·L-1,C
项错误;根据电荷守恒可得:c(H+)+c(Na+)=c(OH-)+2c(C2O2-
4 )+c(HC2O-4),根据物料守
恒得:c(Na+)=2[c(H2C2O4)+c(C2O2-
4 )+c(HC2O-4)],两者相减
得:c(H+)=c(OH-)-2c(H2C2O4)-c(HC2O-4),D 正确。
3.D 解析在横坐标为 0.0 时,由曲线 M 对应的 pH 大于曲线 N 对应的 pH,可知曲
线 M 表示 pH 与 lg푐(X2-)
푐(HX-)
的变化关系,曲线 N 表示 pH 与 lg푐(HX-)
푐(H2푋)的变化关系,故 B 项
正确;Ka2(H2X)=푐(X2-)
푐(HX-)
·c(H+),取曲线 M 上横、纵坐标清晰的一点代入可得 Ka2 的数量
级为 10-6,A 项正确;由曲线 M、N 上横坐标为 0.0 的点对应的 pH 均小于 7,可知 HX-
的电离程度大于其水解程度,则 C 项正确;由图像可知,当 pH 等于 7 时,lg푐(X2-)
푐(HX-)
应大
于 0,即 c(X2-)>c(HX-),D 项错误。
4.D 解析 a 点表示 HA 与 NaOH 恰好完全反应,得到 NaA 溶液并且溶液 pH=8.7,
说明 HA 为弱酸,A-发生水解反应:A-+H2O HA+OH-,则 a 点所示溶液中
c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+),A 项错误;a 点为 NaA 溶液,由于 A-发生水解,促
进水的电离,而 b 点是 HA 和 NaA 的混合溶液,HA 抑制水的电离,水的电离程度比
a 点时的小,B 项错误;根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c(A-),pH=7
时,c(H+)=c(OH-),则 c(Na+)=c(A-),C 项错误;b 点所示溶液为等物质的量浓度的 HA
和 NaA 的混合溶液,由于溶液的 pH=4.7,说明 HA 的电离程度大于 A-的水解程度,
故 c(A-)>c(HA),D 项正确。
应考训练 1.CD 解析 H2C2O4 的第一步电离程度大于第二步电离程度,钾离子不电
离也不水解,且 Ka1=10-p퐾a1=10-1.23,则 HC2O-4水解平衡常数 Kh= 10-14
10-1.23=10-12.77c(K+)>c(H2C2O4),故 A
正确;Ka2=
푐(C2O2-
4 )·푐(H+)
푐(HC2O-
4)
=10-4.19,向 0.1mol·L-1PT 溶液中滴加 NaOH 溶液至溶液
pH=4.19,则 c(HC2O-4)=c(C2O2-
4 ),故 B 正确;HC2O-4水解平衡常数 Kh= 10-14
10-1.23
=10-12.77c(H+),即 c(HA)>c(H+),故 D 错误。
3.CD 解析柠檬酸的电离方程式为 H3R H2R-+H+、H2R- HR2-+H+、HR2-
R3-+H+,在 a 点时,c(H2R-)=c(H3R),第一步电离常数 Ka1(H3R)=
푐(H+)·푐(H2R-)
푐(H3푅) =c(H+)<10-3,
结合图像可知其数量级为 10-4,A 错误;b 点时,c(NaH2R)=c(Na2HR),根据物料守恒可
得 2c(Na+)=3[c(R3-)+c(HR2-)+c(H2R-)+c(H3R)],B 错误;根据图示,随着 pH 的增大,氢
离子浓度会减小,柠檬酸的电离平衡向右移动,所以 H3R 含量会减少。pH=6
时,c(R3-)=c(HR2-),溶液显酸性,c(H+)>c(OH-),盐电离产生的离子浓度大于弱电解质
电离产生的离子浓度,即 c(HR2-)>c(H+),故 c(R3-)=c(HR2-)>c(H+)>c(OH-),C 正确;H3R
H2R-+H+的电离平衡常数 Ka1(H3R)=
푐(H+)·푐(H2R-)
푐(H3푅) =10-x;H2R- HR2-+H+的电离平衡
常数 Ka2(H3R)=푐(H+)·푐(HR2-)
푐(H2R-)
=10-y,反应 2H2R- H3R+HR2-在该温度下的平衡常数 K=
푐(H3푅)·푐(HR2-)
푐2(H2R-)
=
푐(H3푅)·푐(HR2-)
푐(H2R-)·푐(H2R-)
= 푐(H+)·푐(HR2-)
푐(H2R-)
×
푐(H3푅)
푐(H+)·푐(H2R-)
=
퐾a2
퐾a1
= 10-푦
10-푥=10x-y,D 正确。
考点四
真题示例 1.C 解析由图示滴定曲线中只有一个明显的滴定终点且终点时消耗氢
氧化钠溶液的体积为 40mL,以及起点时溶液 pH=1,可确定酸 H2A 第一步是完全电
离的,其浓度是 0.1000mol·L-1,所以曲线①代表 δ(HA-)、曲线②代表 δ(A2-),A、B 两
项错误。C 项,曲线①、②交点时 δ(HA-)=δ(A2-),此时 V(NaOH 溶液)=25mL,再根据
曲线③可知此时溶液 pH=2,由 Ka=푐(H+) ·푐(A2-)
푐(HA-)
,得 Ka=1.0×10-2,C 项正确。利用电荷守
恒,因为是强碱滴定弱酸,滴定终点时溶液呈碱性,c(H+)2c(A2-)+c(HA-),D 项错误。
2.C 解析随着 NaOH 溶液的加入,混合溶液中离子浓度和种类发生变化,因此混合
溶液的导电能力与离子浓度和种类有关,A 项正确;a 点的溶液中能导电的离子主要
为 HA-和 K+,b 点为反应终点,因此 b 点的溶液中能导电的离子主要为 A2-、K+、
Na+,由图示可知 b 点导电能力比 a 点强,故 Na+与 A2-的导电能力之和大于 HA-,B 项
正确;由 H2A 的电离常数可知 A2-可发生水解,b 点的溶液中含有的 A2-能发生水解
反应而使溶液呈碱性,C 项错误;b 点为反应终点,因此 b 点的混合溶液中
c(Na+)=c(K+)>c(OH-),继续加入氢氧化钠溶液后,根据图示中 b、c 点对应的 NaOH 溶
液的体积可知,c 点的溶液中 c(Na+)>c(K+)>c(OH-),D 项正确。
3.C 解析相同实验条件下,若改为 0.0400mol·L-1Cl-,恰好反应
时,0.0400mol·L-1×50.0mL=0.100mol·L-1×V,V=20mL,故反应终点横坐标应为 20,C 项
描述错误;相同实验条件下,若改为 0.0500mol·L-1Br-,反应终点横坐标不变,由于
Ksp(AgCl)>Ksp(AgBr),故反应终点纵坐标变大,故 D 项描述正确。
4.答案(1)③加入过量稀盐酸 ④出现乳黄色浑浊 ⑤(吸)取上层清液,滴入 BaCl2
溶液 ⑥产生白色沉淀
(2)①烧杯 容量瓶 刻度 ②蓝色褪去 95.0
解析(1)先加过量盐酸排除 S2O2-
3 干扰:S2O2-
3 +2H+ S↓+SO2↑+H2O,然后在酸性条件
下加 BaCl2 溶液,通过产生 BaSO4 沉淀证明 SO2-
4 存在。
(2)①溶液配制应在烧杯中溶解,在容量瓶中定容。②滴定过程中 I2→I-,达到滴
定终点时无 I2,故溶液蓝色褪去,即为终点;根据反应的离子方程式,可得到如下定量
关系:
Cr2O2-
7 ~ 3I2 ~ 6Na2S2O3·5H2O
1mol 248×6g
0.00950mol·L-1×0.02L m(Na2S2O3·5H2O)
m(Na2S2O3·5H2O)=0.28272g
则样品纯度为 0.28272g
24.80mL
100mL × 1.2g
×100%=95.0%。
应考训练 1.B 解析由图中可以看出,滴定达终点时,酸 2 消耗 KOH 溶液的体积大,
则表明 c(酸 2)>c(酸 1),而起始时 pH(酸 2)>pH(酸 1),所以“酸 1”比“酸 2”的酸性强,A
正确;“酸 2”为弱酸,起始时溶液中 c(H+)=0.01mol·L-1,则酸 2 的起始浓度比
0.01mol·L-1 大得多,B 错误;“酸 2”滴定一半时,c(酸 2)=c(酸 2 的酸根离子),此时溶液
pH 介于 4~5 之间,所以 Ka 的数量级约为 10-5,C 正确;滴定终点时,“酸 1”和“酸 2”对应
溶液的 pH 与酚酞的变色范围接近或重叠,所以滴定两种酸溶液均可用酚酞作指示
剂,D 正确。
2.AC 解析温度不变时,溶度积为常数,Ksp(AgSCN)=c(SCN-)·c(Ag+),c(Ag+)增大,则
c(SCN-)减小,二者浓度变化倍数相同;Ksp(Ag2CrO4)=c(CrO2-
4 )·c2(Ag+),c(Ag+)增大,则
c(CrO2-
4 )减小,但二者浓度的变化倍数不同,结合曲线分析,当 c(Ag+)由 10-6mol·L-1 增
大到 10-2mol·L-1,c(Xn-)由 10-6mol·L-1 减小到 10-10mol·L-1,由此可知二者变化倍数相
同,则下面的曲线为 AgSCN 的溶解平衡曲线,上方的曲线为 Ag2CrO4 的溶解平衡曲
线。则 Ksp(Ag2CrO4)=c(CrO2-
4 )·c2(Ag+)=10-3.92×(10-4)2=10-11.92,故 A 错误;a 点的 c(Ag+)
小于 Ag2CrO4 达溶解平衡时的 c(Ag+),则 a 点为 Ag2CrO4 的不饱和溶液,故 B 正确;
溶度积越小,溶液中离子浓度越小,沉淀越完
全,Ksp(Ag2CrO4)=c(CrO2-
4 )·c2(Ag+)=10-3.92×(10-4)2=10-11.92,Ksp(AgSCN)=c(SCN-)·c(Ag+)=
10-6×10-6=10-12,通过计算分析可知,沉淀废液中的 Ag+用 KSCN 溶液比等浓度的
K2CrO4 溶液效果好,故 C 错误;Ag2CrO4(s)+2SCN-(aq) 2AgSCN(s)+CrO2-
4 (aq)的平
衡常数 K=
푐(CrO2-
4 )
푐2(SCN-)
=
푐(CrO2-
4 )·푐2(퐴g+)
[푐(SCN-)·푐(Ag+)]2 =
퐾sp(Ag2CrO4)
[퐾sp(AgSCN)]2 = 10-11.92
(10-12)2=1012.08,故 D 正确。
3.答案(1)aefg ACE
(2)NH3 Ca2++CO2+2NH3+H2O CaCO3↓+2NH+4
(3)7.94×10-10 mol·L-1
(4)ac (5)溶液变为红色,且半分钟内不褪色
(6)80%
解析(1)实验室制备纯净、干燥气体的装置依次为发生装置、净化和干燥装置、收
集装置。实验室制取氨气用浓氨水和生石灰反应,不需加热,应选 A 为发生装置;生
成物中含有水蒸气,氨气溶于水显碱性,应选择碱石灰等固体干燥剂来吸收水蒸气,
固体干燥剂一般盛放在干燥管中,故选 D 干燥;氨气极易溶于水,且密度比空气小,应
采用向下排空气法收集,故选 E 装置收集,注意短进长出;同时要注意干燥管的使用
原则是大口进小口出,所以按气流方向连接各仪器接口顺序是 aefg;若要制取并收
集干燥的 CO2,装置依次为发生装置、净化和干燥装置、收集装置。实验室制取二
氧化碳采用碳酸钙与盐酸反应,应选用装置 A;干燥二氧化碳用浓硫酸,应选用装置
C;收集二氧化碳用向上排空气法,选用装置 E。
(2)氨气极易溶于水,二氧化碳在水中溶解度较小,氨气溶于水生成氨水,溶液呈
碱性,有利于吸收更多的二氧化碳,提高纳米级碳酸钙的产量,所以应先通入氨气;二
氧化碳能和氨水反应生成碳酸铵,碳酸铵和氯化钙发生复分解反应生成碳酸钙和氯
化铵,所以反应的离子方程式为 Ca2++CO2+2NH3+H2O CaCO3↓+2NH+4 。
(3)TiCl4 溶液的 pH=3,则 c(OH-)=10-11mol·L-1,Ksp[Ti(OH)4]=7.94×10-54,则
c(Ti4+)×c4(OH-)=c(Ti4+)×(10-11)4=7.94×10-54,可得 c(Ti4+)=7.94×10-10mol·L-1。
(4)配制 NH4Fe(SO4)2 标准溶液时,使用的仪器有天平、药匙、玻璃棒、烧杯、
量筒、容量瓶、胶头滴管等,还需要 ac。
(5)达到滴定终点时,Fe3+不再被还原为 Fe2+,所以滴定终点的现象是溶液变为红
色,且半分钟内不褪色。
(6)设 TiO2 的质量分数为 a,根据题意可得如下关系:
TiO2 ~ NH4Fe(SO4)2
80g 1mol
1.8g×a 0.4mol·L-1×0.045L
80g
1.8g × 푎 = 1mol
0.4mol·L-1 × 0.045L,解得 a=0.8=80%。