- 2021-05-25 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学北京卷试题及答案
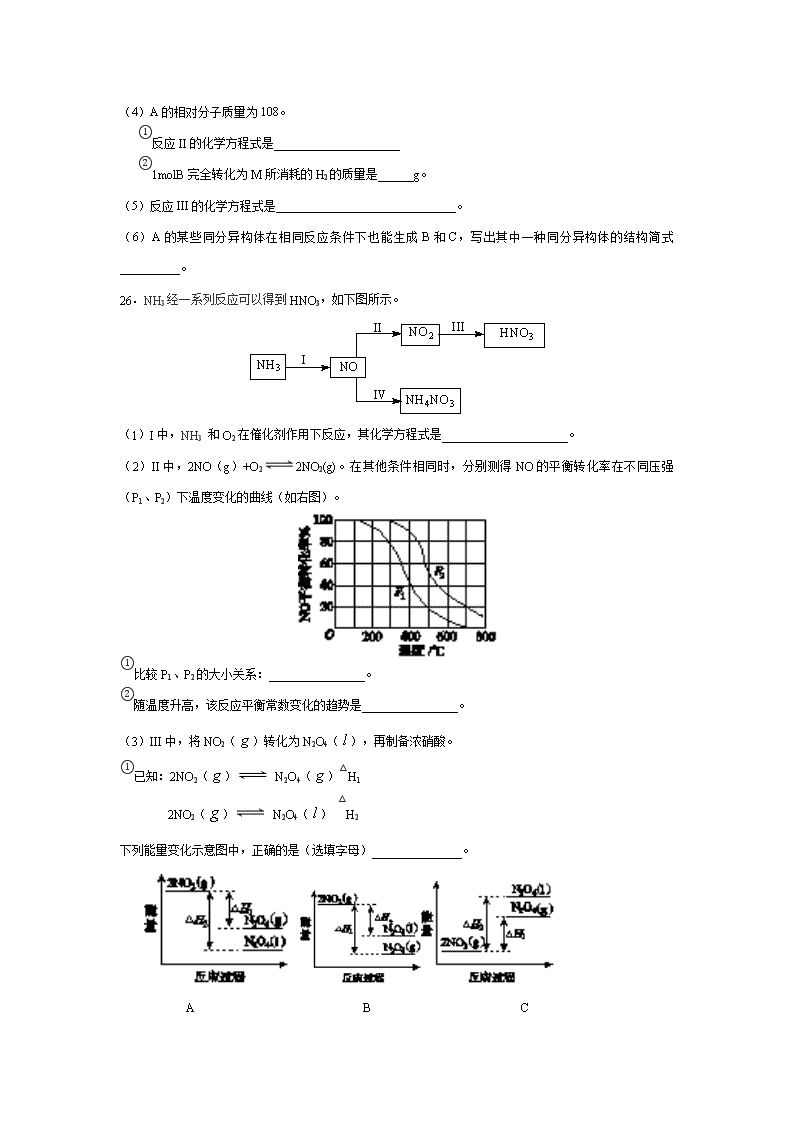
2014年北京高考理综化学试题 6.下列试剂中,标签上应标注和的是( ) A.C2H5OH B.HNO3 C.NaOH D.HCl 7.下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是( ) A.K B.Na C.Fe D.Al 8.下列电池工作时,O2在正极放电的是( ) A.锌锰电池 B.氢燃料电池 C.铅蓄电池 D.镍镉电池 9.下列解释事实的方程式不正确的是( ) A.测0.1mol/L氨水的pH为11:NH3·H2ONH4++OH- B.将Na块放入水中,放出气体:2Na+2H2O=2NaOH+H2↑ C.用CuCl2溶液做导电实验,灯泡发光:CuCl2 Cu2++2Cl- D.Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑ 10.下列说法正确的是( ) A.室温下,在水中的溶解度:丙三醇>苯酚>1—氯丁烷 B.用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 C.用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 D.油脂在酸性或碱性条件下均能发生水解反应,且产物相同 11.右图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( ) ①中实验 ②中现象 A 铁粉与水蒸气加热 肥皂水冒泡 B 加热NH4Cl和Ca(OH)2混合物 酚酞溶液变红 C NaHCO3 澄清石灰水变浑浊 D 石蜡油在碎瓷片上受热分解 Br2的CCl4溶液褪色 12.在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。 t/min 0 2 4 6 8 10 V(O2)/mL 0.0 9.9 17.2 22.4 26.5 29.9 下列叙述不正确的是(溶液体积变化忽略不计) A.0~6 min的平衡反应速率:v(H2O2)≈3.3×10-2 mol/(L·min) B.6~10 min的平衡反应速率:v(H2O2)<3.3×10-2 mol/(L·min) C.反应到6 min时,c(H2O2)=0.30mol/L D.反应到6 min时,H2O2分解了50% 25.(17分)顺丁橡胶、制备醇酸树脂的原料M以及杀菌剂N的合成路线如下: 已知: (1)CH2=CH-CH=CH2的名称是_______; (2)反应I的反应类型是_______; a.加聚反应 b.缩聚反应 (3)顺式聚合物P的结构式是(选填字母)_______; (4)A的相对分子质量为108。 ①反应II的化学方程式是_____________________ ②1molB完全转化为M所消耗的H2的质量是______g。 (5)反应III的化学方程式是______________________________。 (6)A的某些同分异构体在相同反应条件下也能生成B和C,写出其中一种同分异构体的结构简式__________。 26.NH3经一系列反应可以得到HNO3,如下图所示。 (1)I中,NH3 和O2在催化剂作用下反应,其化学方程式是_____________________。 (2)II中,2NO(g)+O22NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如右图)。 ①比较P1、P2的大小关系:________________。 ②随温度升高,该反应平衡常数变化的趋势是________________。 (3)III中,将NO2()转化为N2O4(),再制备浓硝酸。 ①已知:2NO2() N2O4()△H1 2NO2() N2O4() △H2 下列能量变化示意图中,正确的是(选填字母)_______________。 A B C ②N2O4与O2、H2O化合的化学方程式是_________________。 (4)IV中,电解NO制备 NH4NO3,其工作原理如右图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____________,说明理由:________________。 27.(12分)碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。 (1)采用装置A,在高温下x克钢样中碳、硫转化为CO2、SO2。 ①气体a的成分是________________。 ②若钢样中硫以FeS的形式存在,A中反应:3FeS+5O2 1_____ +3________。 (2)将气体a通入测硫酸装置中(如右图),采用滴定法测定硫的含量。 ①H2O2氧化SO2的化学方程式________________________________。 ②用NaOH溶液滴定生成的H2SO4,消耗z mLNaOH溶液,若消耗 1 mLNaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数为__________。 (3)将气体a通入测碳装置中(如下图),采用重量法测定碳的质量。 ①气体a通过B和C的目的______________________________。 ②计算钢样中碳的质量分数,应测量的数据是_______________________。 28.(15分)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L的FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压数值): 序号 电压/V 阳极现象 检验阳极产物 I x≥a 电极附近出现黄色,有气泡产生 有Fe3+、有Cl2 II a>x≥b 电极附近出现黄色,无气泡产生 有Fe3+、无Cl2 III b>x>0 无明显变化 无Fe3+、无Cl2 (1)用KSCN检验出Fe3+的现象是_______________________。 (2)I中,Fe3+产生的原因可能是Cl—在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应: ____________________________________________________。 (3)由II推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有_________性。 (4)II中虽未检验出Cl2,但Cl—在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下: 序号 电压/V 阳极现象 检验阳极产物 IV a>x≥c 无明显变化 有Cl2 V c>x≥b 无明显变化 无Cl2 ①NaCl的浓度是_________mol/L ②IV中检测Cl2的实验方法______________________________________________。 ③与II对比,得出的结论(写出两点):_____________________________________________。 BDBCAAC 【答案】(1)1,3—丁二烯 (2)a (3)b (4)①2 CH2=CH-CH=CH2+ ②6g (5)+HCHO +H2O (6) 【答案】(14分) (1)4NH3+5O2 4NO+6H2O (2)①p1查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档