- 2021-05-24 发布 |
- 37.5 KB |
- 68页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
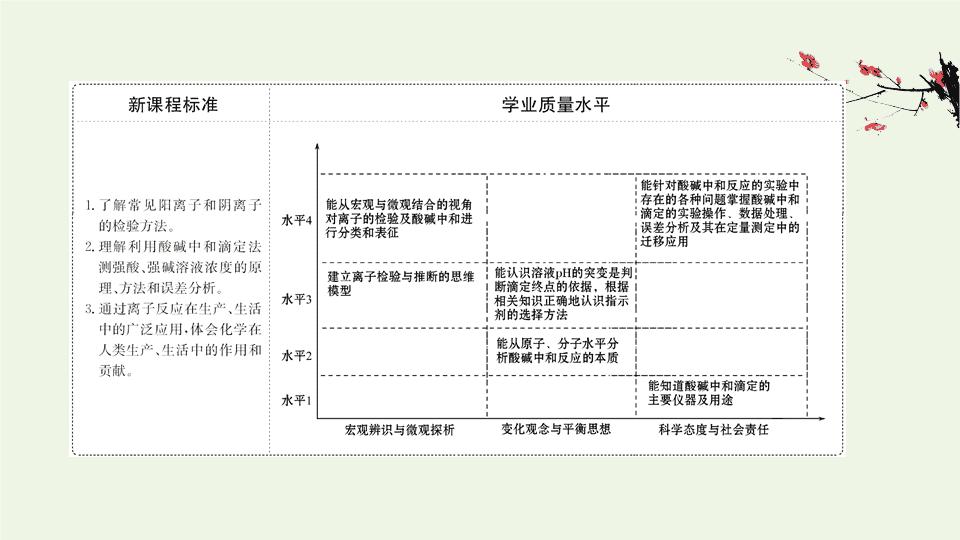
2020_2021学年新教材高中化学第3章物质在水溶液中的行为第4节离子反应2离子反应的应用课件鲁科版选择性必修1
第 2 课时 离子反应的应用 一、物质检验与含量测定 1. 离子检验 利用离子的特征反应来检验一些常见离子。 如利用 Fe 3+ 与 SCN - 反应生成红色溶液检验 Fe 3+ , 离子方程式为 ______________ ________( 红色 ); 利用 I - 与 Ag + 反应生成黄色沉淀检验 I - , 离子方程式为 __________________ ____ 。 必备知识 · 素养奠基 Fe 3+ +3SCN - ==== Fe(SCN) 3 Ag + +I - ====AgI↓( 黄 色 ) 2. 测定溶液中离子的浓度 (1) 沉淀法 : 如溶液中 的浓度 , 用 ____ 将其转化为 BaSO 4 沉淀 , 再 _________ _____ 求得。 (2) 酸碱中和滴定法 : 强酸溶液中 H + 的浓度可以用已知准确浓度的 _____ 溶液滴 定的方法获得。 (3) 氧化还原滴定法 : 如溶液中 的浓度可以用已知准确浓度的 ____ 溶液 滴定获得。 Ba 2+ 称量沉淀 质量 强碱 Fe 2+ 【 巧判断 】 (1) 能使石灰水变浑浊的无色无味气体一定是 CO 2 。 ( ) 提示 : √ 。 CO 2 是无色无味可使澄清石灰水变浑浊的气体。 (2) 中和滴定时为了节省时间 , 不需要重复 2 ~ 3 次实验。 ( ) 提示 : × 。为了减少滴定误差 , 需进行 2 ~ 3 次实验。 (3) 用石灰水鉴别 NaHCO 3 和 Na 2 CO 3 。 ( ) 提示 : × 。 NaHCO 3 、 Na 2 CO 3 与石灰水反应均产生 CaCO 3 沉淀。 二、物质制备与纯化 1. 物质的制备 : 离子反应可以用于制备一些 ___ 、 ___ 、 ___ 、 _____ 等。 (1) 氯碱工业生产烧碱和氯气的离子方程式 : ______________________________ 。 (2) 实验室制取 CO 2 的离子方程式 : __________________________ 。 酸 碱 盐 气体 2Cl - +2H 2 O 2OH - +Cl 2 ↑+H 2 ↑ CaCO 3 +2H + ====Ca 2+ +CO 2 ↑+H 2 O 通电 ==== 2. 物质的纯化 (1) 制高纯度的氯化钠 : 除去其中少量的 、 Mg 2+ 、 Ca 2+ , 需要引入的试剂离 子分别为 _______________ 。 (2) 除去污水中的重金属离子 : 将其转化为 _____ 而除去。 (3) 从海水中提取二氧化碳 : Ba 2+ 、 OH - 、 沉淀 ①a 室为 _____ 室 , 发生反应为 ____________________; ②c 室为 _____ 室 , 发生反应为 _______________; ③a 室产生的 __ 透过离子交换膜进入 b 室 , 与 b 室中的 ______ 发生反应 , 反应方程 式为 ______________________ 。 阳极 4OH - -4e - ====2H 2 O+O 2 ↑ 阴极 2H + +2e - ====H 2 ↑ +H + ====H 2 O+CO 2 ↑ H + 【 巧判断 】 (1) 用足量稀硝酸除去铁粉中的 Cu 。 ( ) 提示 : × 。 Fe 、 Cu 均溶于足量的稀硝酸。 (2) 将混有 HCl 的 CO 2 通入饱和 NaHCO 3 溶液中除去 HCl 。 ( ) 提示 : √ 。 HCl 与 NaHCO 3 反应产生 CO 2 从而除去 HCl 。 (3) 可以用铁粉除去 FeCl 3 中的 FeCl 2 。 ( ) 提示 : × 。 Fe+2FeCl 3 ====3FeCl 2 , 无法除去 FeCl 2 。 三、生活中的离子反应 1. 胃酸过多的治疗 服用胃舒平 [ 主要成分是 Al(OH) 3 ], 离子反应为 _______________________ 。 2. 硬水及其软化 (1) 硬水的含义 : 自然界里含 _________ 较多的水。 (2) 一般硬水 ( 暂时硬水 ) 的形成 : 水中的二氧化碳与岩石中的 CaCO 3 和 MgCO 3 发 生反应生成可溶性碳酸氢盐而使 Ca 2+ 、 Mg 2+ 进入水中形成 , 离子方程式为 ____________________________,____________________________ 。 Al(OH) 3 +3H + ====Al 3+ +3H 2 O Ca 2+ 、 Mg 2+ CaCO 3 +CO 2 +H 2 O====Ca 2+ + MgCO 3 +CO 2 +H 2 O====Mg 2+ + (3) 硬水的软化方法 ①加热法 : 加热可使 分解 , 生成的 与 Ca 2+ 、 Mg 2+ 结合成沉淀 , 发生 反应如下 : ________________________________, _________________________________ 。 ②加沉淀剂法 : 在硬水中加入 ______ 等沉淀剂也可以降低水中 Ca 2+ 、 Mg 2+ 的浓 度 , 发生反应如下 : _____________________,_____________________ 。 Ca 2+ + ====CaCO 3 ↓+CO 2 ↑+H 2 O Mg 2+ + ====MgCO 3 ↓+CO 2 ↑+H 2 O Na 2 CO 3 Ca 2+ + ====CaCO 3 ↓ Mg 2+ + ====MgCO 3 ↓ 【 情境 · 思考 】 矿泉水是从地下深处自然涌出的或者是经人工发掘的、未受污染的地下矿水 , 含有一定量的矿物盐、微量元素锂、锶、锌、硒等。因矿泉水一般含钙、镁较多 , 常温下钙、镁呈离子状态 , 极易被人体所吸收 , 起到很好的补钙作用。若煮沸时 , 钙、镁易与碳酸根生成水垢析出 , 这样既丢失了钙、镁 , 还造成了感官上的不适 , 所以矿泉水最佳饮用方法是在常温下饮用。 【 思考 】 (1) 怎样测定矿泉水中的微量元素呢 ? (2) 为什么矿泉水煮沸时易形成水垢 ? 提示 : 测定矿泉水中的微量元素可以用滴定法。矿泉水煮沸时碳酸氢钙、碳酸氢镁均易分解形成碳酸盐沉淀。 关键能力 · 素养形成 知识点一 酸碱中和滴定 【 重点释疑 】 酸碱中和滴定的实验操作与误差分析 (1) 原理 : ① 定量分析 : 化学上把测定物质各组成成分含量的过程 , 称为定量分析过程。中和滴定是定量分析的一种方法。 ②中和滴定 : 用已知物质的量浓度的酸 ( 或碱 ) 来测定未知物质的量浓度的碱 ( 或酸 ) 的方法就叫酸碱中和滴定。 实质 :H + +OH - ====H 2 O 即酸中的 H + 和碱中的 OH - 物质的量相等。 (2) 实验用品 : ① 用到的仪器 : 酸式滴定管 , 碱式滴定管 , 移液管 , 滴定管夹 , 锥形瓶 , 烧杯 , 铁架台。 ②滴定管的结构和使用。 a. 刻度 ( 以 50 mL 规格为例 ) 滴定管上标有温度 (20 ℃) 和刻度 , 刻度共 50 大格 , 每大格为 1 mL, 每大格分为 10 小格 , 每小格为 0.1 mL, 因此能读至 0.01 mL( 估读 1 位 ) 。“ 0” 刻度在上 ,“50” 刻度在下 , 在“ 0” 以上至管口和“ 50” 以下至尖嘴均无刻度。 b. 滴定管盛装试剂要求 ——“ 二不能” 酸式滴定管不能装碱性溶液、水解呈碱性的盐溶液及氢氟酸。碱式滴定管不能装酸性溶液或高锰酸钾等强氧化性物质的溶液 ( 橡胶易被腐蚀 ) 。 (3) 试剂 : ① 标准液、待测液。 ②指示剂 ( 加 2 ~ 3 滴 ) 。 (4) 操作 ( 以标准盐酸滴定待测氢氧化钠溶液为例 ): ① 滴定前的准备 : a. 查漏 : 检查滴定管的活塞是否灵活、滴定管是否漏水。 b. 洗涤 : 酸式、碱式滴定管、锥形瓶依次用自来水、蒸馏水洗涤干净。 c. 润洗 : 用待盛溶液将酸式、碱式滴定管润洗 2 ~ 3 次 , 以保证装入溶液时不改变溶液的浓度。 d. 装液 : 溶液装入酸式、碱式滴定管中 , 所装溶液调至“ 0” 刻度上方 2 ~ 3 cm 处。 e. 排气 : 调节活塞 ( 或挤压玻璃球 ), 赶走气泡使滴定管尖嘴部分充满溶液。 f. 调液面 : 使液面处于“ 0” 刻度或“ 0” 刻度以下某一刻度处。 g. 读数 : 读数时视线应与溶液凹液面最低处相平 , 记录刻度 ( 保留两位小数 ) 。 ② 滴定 : a. 用碱式滴定管 ( 或移液管 ) 取一定体积的待测液于锥形瓶中 , 并滴入 2 ~ 3 滴酚酞试剂。把锥形瓶放在垫有一张白纸的酸式滴定管下面。 b. 用左手控制活塞 , 右手不断旋转振荡锥形瓶 , 眼睛注视锥形瓶内溶液颜色变化及滴定流速 , 当溶液变至无色且半分钟内不再恢复红色 , 停止 , 记下刻度。 ③终点判断。 等到滴入最后一滴标准液 , 指示剂变色 , 且半分钟内不恢复原色 , 视为滴定终点并记录消耗标准液的体积。 (5) 数据处理 : 重复上述操作 2 ~ 3 次 , 求出用去标准盐酸体积的平均值 , 根据 c(NaOH)= 计算。 (6) 误差分析 : ① 依据 c( 待 )= 对错误操作引起的误差进行分析。 ②常见错误操作及对应误差 :( 以酸滴定碱为例 ) 错误操作 c( 待 ) 的误差 仪器 洗涤 酸式滴定管水洗后未用标准液润洗 偏大 碱式滴定管水洗后未用待测液润洗 偏小 锥形瓶水洗后用待测液润洗 偏大 量器 读数 滴定前俯视酸式滴定管 , 滴定后平视 偏大 滴定前仰视酸式滴定管 , 滴定后俯视 偏小 滴定 操作 滴定前酸式滴定管尖嘴部分有气泡 , 滴定结束后 气泡消失 偏大 滴定结束 , 滴定管尖端挂一滴液体未滴下 偏大 错误操作 c( 待 ) 的误差 滴定 操作 锥形瓶水洗后留有少量蒸馏水 无影响 滴定过程中 , 振荡锥形瓶时 , 不小心将溶液溅出 偏小 用甲基橙作指示剂 , 滴至橙色 , 半分钟内又恢复成 黄色 , 不处理就计算 偏小 【 思考 · 讨论 】 (1) 用盐酸滴定氨水 , 选什么作指示剂 ? 怎样描述滴定终点 ? 提示 : 可选择甲基橙作指示剂 , 滴定终点时溶液由黄色变为橙色且半分钟内不再变化。 (2) 酸碱恰好完全反应的点与滴定终点是否相同 ? 提示 : 不相同。酸碱恰好完全反应是指酸与碱按照物质系数恰好完全反应 , 酸和碱都不剩余 , 此时溶液可能为中性 , 也可能为酸性或碱性 ; 而滴定终点是指指示剂颜色恰好变化的点 , 二者不相同。酸碱恰好完全反应与滴定终点特别接近 , 在一般科学研究中不会造成大的误差。 【 拓展深化 】 中和滴定拓展应用 中和滴定操作不仅适用于酸 碱中和反应 , 也可以迁移应用于 氧化还原反应。 氧化还原滴定法 (1) 原理 : 以氧化剂 ( 或还原剂 ) 为滴定剂 , 直接滴定一些具有还原性 ( 或氧化性 ) 的物质。 (2) 实例 : ① 酸性 KMnO 4 溶液滴定 H 2 C 2 O 4 溶液 ②Na 2 S 2 O 3 溶液滴定碘液 原理 2Na 2 S 2 O 3 +I 2 ====Na 2 S 4 O 6 +2NaI 指示剂 用淀粉作指示剂 终点判断 当滴入最后一滴 Na 2 S 2 O 3 溶液后 , 溶液的蓝色褪去 , 且 半分钟内不恢复原来的颜色 , 说明到达滴定终点 【 案例示范 】 【 典例 】 (2020· 淄博高二检测 ) 用中和滴定法测定烧碱的纯度 , 若烧碱中含有与酸不反应的杂质 , 试根据实验回答 : (1) 将准确称取的 4.3 g 烧碱样品配成 250 mL 待测液 , 需要的主要仪器除量筒、烧杯、玻璃棒外 , 还必须用到的仪器有 _____________________________ 。 (2) 取 10.00 mL 待测液 , 用 式滴定管量取。 (3) 用 0.200 0 mol·L -1 标准盐酸滴定待测烧碱溶液 , 滴定时左手旋转酸式滴定管的玻璃活塞 , 右手不停地摇动锥形瓶 , 两眼注视 , 直到滴定终点。 (4) 根据下列数据 , 烧碱的纯度为 ________ 。 滴定次数 待测体积 (mL) 标准盐酸体积 (mL) 滴定前读数 (mL) 滴定后读数 (mL) 第一次 10.00 0.50 20.40 第二次 10.00 4.00 24.10 (5) 以标准的盐酸滴定未知浓度的氢氧化钠溶液为例 , 判断下列操作引起的误差 ( 填“偏大”“偏小”“无影响”或“无法判断” ) 。 ①读数 : 滴定前平视 , 滴定后俯视 ________; ② 用待测液润洗锥形瓶 ________; ③ 滴定接近终点时 , 用少量蒸馏水冲洗锥形瓶内壁 ________ 。 【 解题指南 】 解答本题应注意以下三点 : (1) 一定要注意 , 滴定管的“ 0” 刻度在上 , 它不同于量筒等仪器。 (2) 分清酸式滴定管与碱式滴定管的构造及使用注意事项。 (3) 分析误差时 , 注意归纳到标准液体积的大小上来推断。 【 解析 】 (1) 配一定物质的量浓度的溶液需要用一定规格的容量瓶、胶头滴管 等。 (2) 待测液为碱液 , 用碱式滴定管量取。 (4) 第一次 V 1 ( 盐酸 )=19.90 mL, 第二次 V 2 ( 盐酸 )=20.10 mL, 两次平均 V( 盐酸 ) =20.00 mL 。设烧碱的纯度为 x, ×10.00 mL=20.00×10 -3 L× 0.200 0 mol · L -1 ,x=0.930 2, 即其纯度为 93.02 % 。 (5)① 滴定后俯视 , 会造成读数偏小 , 造成结果偏小。 ②用待测液润洗锥形瓶 , 相当于多取了待测液 , 会造成结果偏大。 答案 : (1)250 mL 容量瓶、胶头滴管 (2) 碱 (3) 锥形瓶内溶液颜色变化 (4)93.02% (5)① 偏小 ②偏大 ③无影响 【 母题追问 】 (1) 若用乙酸滴定此烧碱溶液 , 则选择什么指示剂较为合适 , 为什么 ? 提示 : 因为二者恰好完全反应时生成醋酸钠 , 醋酸钠水解溶液显示碱性 , 故选择酚酞作指示剂。 (2) 若 (5) 中②改成“滴定前酸式滴定管内有气泡 , 滴定后气泡消失” , 则测定值会如何变化 ? 提示 : 偏大。因为气泡的体积也计算在了需要的盐酸的量中 , 所以测定值会偏高。 【 迁移 · 应用 】 1.(2020· 南京高二检测 ) 下列实验操作不会引起误差的是 ( ) A. 酸碱中和滴定时 , 用待测液润洗锥形瓶 B. 酸碱中和滴定时 , 用冲洗干净的滴定管盛装标准溶液 C. 用 NaOH 标准溶液测定未知浓度的盐酸溶液时 , 选用酚酞作指示剂 , 实验时不小心多加了几滴 D. 用标准盐酸溶液测定未知浓度的 NaOH 溶液 , 实验结束时 , 酸式滴定管尖嘴部分有气泡 , 开始实验时无气泡 【 解析 】 选 C 。 A 项 , 锥形瓶一定不要用待测液润洗 , 否则会使待测液的量偏大 , 消耗标准液的体积偏大 , 从而使所测浓度偏大 ;B 项 , 冲洗干净的滴定管无论是盛装标准溶液 , 还是待测溶液 , 都必须用待装溶液润洗 2 ~ 3 次 , 否则会使标准溶液或待测溶液比原来溶液的浓度偏小 , 影响结果 ;C 项 , 在滴定过程中 , 指示剂略多加了几滴 , 一般不影响实验结果 , 因为指示剂不会改变反应过程中酸和碱的物质的量 ;D 项 , 实验开始时酸式滴定管中无气泡 , 实验结束时有气泡 , 会导致所读取的 V(HCl) 偏小 , 依据 V(HCl)·c(HCl)=V(NaOH)·c(NaOH) 得所测得的 c(NaOH) 偏小。 2.(2020· 厦门高二检测 ) 准确移取 20.00 mL 某待测 HCl 溶液于锥形瓶中 , 用 0.100 0 mol·L -1 NaOH 溶液滴定。下列说法正确的是 ( ) A. 滴定管用蒸馏水洗涤后 , 装入 NaOH 溶液进行滴定 B. 随着 NaOH 溶液滴入 , 锥形瓶中溶液 pH 由小变大 C. 用酚酞作指示剂 , 当锥形瓶中溶液由红色变为无色时停止滴定 D. 滴定达终点时 , 发现滴定管尖嘴部分有悬滴 , 则测定结果偏小 【 解析 】 选 B 。 A 项 , 滴定管用蒸馏水洗涤后 , 还要用待装 NaOH 溶液润洗 , 否则将要引起误差 , 错误 ;B 项 , 在用 NaOH 溶液滴定盐酸的过程中 , 锥形瓶内溶液由酸性逐渐变为中性 , 溶液的 pH 由小变大 , 正确 ;C 项 , 用酚酞作指示剂 , 锥形瓶中溶液应由无色变为粉红色 , 且半分钟内不恢复原色时才能停止滴定 , 错误 ;D 项 , 滴定达终点时 , 发现滴定管尖嘴部分有悬滴 , 则碱液的体积偏大 , 测定结果偏大 , 错误。 知识点二 离子反应的应用 —— 离子的检验与推断 【 重点释疑 】 1. 常见离子的检验 (1) 常见阴离子的检验 离子 鉴定方法 产生现象 OH - ① 在试管中取少量试液滴加紫色石 蕊 ( 或无色酚酞 ) 试液 ;② 用玻璃棒 蘸取试液于红色石蕊试纸 ① 紫色石蕊试液变蓝 ( 或酚酞 变红 ); ② 红色石蕊试纸变蓝 Cl - 在试管中取少量试液 , 滴加 AgNO 3 溶 液 , 再加稀硝酸 生成白色沉淀 , 不溶于稀硝酸 离子 鉴定方法 产生现象 Br - 在试管中取少量试液 , 滴加 AgNO 3 溶 液 , 再加稀硝酸 生成浅黄色沉淀 , 不溶于稀 硝酸 I - 在试管中取少量试液 , 滴加 AgNO 3 溶 液 , 再加稀硝酸 生成黄色沉淀 , 不溶于稀硝 酸 在试管中取少量试液 , 先加 BaCl 2 产 生白色沉淀 , 另取少量溶液于试管 中加入稀盐酸或稀硝酸 , 将生成的 气体通入澄清的石灰水 产生无色、无味的气体 , 此 气体能使澄清的石灰水变浑 浊 在试管中 , 取少量试液 , 滴加盐酸 无明显现象 , 再加 BaCl 2 生成白色沉淀 离子 鉴定方法 产生现象 在试管中 , 取少量试液 , 先加 BaCl 2 产 生白色沉淀 , 另取少量溶液加盐酸生 成气体 , 把气体通入品红溶液 生成无色有刺激性气味的 气体 , 品红溶液褪色 (2) 常见阳离子的检验 离子 鉴定方法 产生现象 在试管中 , 取少量试液 , 加浓 NaOH 微热 , 用润湿的红色石蕊试纸靠近管口 有刺激性气味 , 使润湿的 红色石蕊试纸变蓝 Al 3+ ① 在试管中取少量试液加适量 NaOH 溶 液 ;② 加过量 NaOH 溶液 ① 有白色絮状沉淀 ; ② 上述沉淀消失 Fe 3+ ① 在试管中取少量试液 , 加 KSCN 溶液 ; ② 在试管中取少量试液 , 加入 NaOH 溶液 ① 溶液呈红色 ; ② 产生红褐色沉淀 Fe 2+ 在试管中取少量试液加入 NaOH 溶液 生成白色沉淀 , 迅速变为 灰绿色 , 最后变为红褐色 2. 离子推断的四个原则 【 思考 · 讨论 】 下面是对溶液中有无 检验的实验方案 , 请评价各方案是否严密 ? 分别说 明理由。 提示 : 不严密。如果试液中含有 Ag + ( 或 Pb 2+ 、 Hg 2+ ) 而不含 , 当加入 BaCl 2 时 同样产生白色沉淀 , 并且加入稀硝酸后沉淀不溶解 , 故方案甲不严密 (Ag + 等干 扰 ) 。 提示 : 严密。只有含 的无色透明溶液才会出现此方案的现象 , 故方案乙严 密。 提示 : 不严密。如果试液中含有 而不含 , 当加入足量稀硝酸溶液后 , 被氧化成 , 再加入 Ba(NO 3 ) 2 试液后出现不溶于稀硝酸的白色沉淀 , 故 方案丙不严密 ( 干扰 ) 。 【 规律方法 】 模型认知 —— 无色溶液中离子推断的解题模板 【 案例示范 】 【 典例 】 (2020· 三明高二检测 ) 铁红是一种广泛使用的红色颜料 , 其主要成分是 Fe 2 O 3 。其可以用于油漆、油墨、橡胶等工业中 , 可作为催化剂 , 玻璃、宝石、金属的抛光剂 , 可用作炼铁原料。如图是某学生设计的探究铁及其化合物的某些化学性质的流程图。下列有关叙述正确的是 ( ) A. 反应①的离子方程式为 Fe 2 O 3 +6H + ====2Fe 3+ +3H 2 O B. 检验乙溶液中的金属阳离子可用 KSCN 溶液 C. 反应③可制得一种红褐色的胶体 D. 物质丙在空气中能稳定存在 【 解题指南 】 解答本题注意以下两点 : (1) 熟悉常见的离子的检验方法并能依据现象判断离子的存在。 (2) 注意运用“离子能否共存判断离子是否存在。 【 解析 】 选 A 。 A 项 , 甲、乙、丙分别为 FeCl 3 、 FeCl 2 和 Fe(OH) 2 ,Fe 2 O 3 溶于酸生成 Fe 3+ ,A 项正确。 B 项 ,KSCN 溶液可检验 Fe 3+ , 不能检验 Fe 2+ ,B 项错误。 C 项 , Fe(OH) 2 为白色沉淀 ,C 项错误。 D 项 ,Fe(OH) 2 不稳定 , 在空气中易被氧化为 Fe(OH) 3 ,D 项错误。 【 规律方法 】 离子检验中的干扰问题 (1) 进行离子检验时 , 需排除干扰离子的影响。 如检验 时 , 不能直接或间接引入 , 防止 的干扰 , 为排除 、 、 Ag + 等的干扰 , 正确的操作是先向溶液中加稀盐酸没有气泡或 白色沉淀生成 , 再加 BaCl 2 溶液有白色沉淀 , 证明溶液中一定含有 。 (2) 对含多种离子的溶液分别进行离子检验时需要选择合适的顺序。 【 迁移 · 应用 】 (2020· 三明高二检测 ) 一杯澄清透明的溶液中 , 已知各离子的浓度均为 0.1 mol·L -1 , 体积为 1 L 。可能含有的离子 : 阳离子为 K + 、 Fe 2+ 、 Ba 2+ 、 , 阴离子为 Cl - 、 、 、 。向该混合液中加足量稀盐酸 , 有无色气 体生成 , 且阴离子的种类不变。下列对该溶液的叙述错误的是 ( ) A. 该溶液一定含有 Fe 2+ 、 、 Cl - B. 该溶液一定不含 K + 、 C. 该溶液一定不含 、 Ba 2+ D. 该溶液可能含有 【 解析 】 选 B 。加入足量稀盐酸 , 阴离子的种类不变 , 说明原溶液中肯定含有 Cl - , 且无 ( 如有 , 加入足量稀盐酸 , 反应完全 , 种类改变 ), 该气体只 能为 Fe 2+ 与 在酸性条件下发生的氧化还原反应生成的 NO, 故肯定有 Fe 2+ 、 、 Cl - , 肯定没有 。根据电荷守恒若溶液中有 , 就肯定含有 K + 、 , 故 B 项错误 ,D 项正确。若含 Ba 2+ , 则根据电荷守恒 , 阴离子除含 Cl - 、 外 , 还得含 , 而 Ba 2+ 与 不共存 , 故 C 项正确。 【 补偿训练 】 下列关于物质或离子检验的叙述正确的是 ( ) A. 在溶液中加 KSCN, 溶液显红色 , 证明原溶液中有 Fe 3+ , 无 Fe 2+ B. 气体通过无水硫酸铜 , 粉末变蓝 , 证明原气体中含有水蒸气 C. 灼烧白色粉末 , 火焰呈黄色 , 证明原粉末中有 Na + , 无 K + D. 将气体通入澄清石灰水 , 溶液变浑浊 , 证明原气体是 CO 2 【 解析 】 选 B 。 Fe 3+ 遇 KSCN 会使溶液呈现红色 ,Fe 2+ 遇 KSCN 不反应无现象 , 如果该溶液既含 Fe 3+ , 又含 Fe 2+ , 滴加 KSCN 溶液 , 溶液呈红色 , 则证明存在 Fe 3+ , 但并不能证明无 Fe 2+ ,A 项错误 ; 气体通过无水硫酸铜 , 粉末变蓝 , 则发生反应 :CuSO 4 +5H 2 O ====CuSO 4 ·5H 2 O,CuSO 4 ·5H 2 O 为蓝色 , 故可证明原气体中含有水蒸气 ,B 项正确 ; 灼烧白色粉末 , 火焰呈黄色 , 证明原粉末中有 Na + ,Na + 焰色反应为黄色 , 但并不能证明无 K + , 因为 Na + 的黄色对 K + 的焰色反应具有干扰作用 , 故需透过蓝色的钴玻璃观察 K + 的焰色反应 ,C 项错误 ; 能使澄清石灰水变浑浊的气体有 CO 2 、 SO 2 等 , 故将气体通入澄清石灰水 , 溶液变浑浊 , 则原气体不一定是 CO 2 ,D 项错误。 【 课堂回眸 】 课堂检测 · 素养达标 1.(2020· 武汉高二检测 ) 已知 , 环境中有很多金属离子可以与硫酸根离子结合 形成硫酸盐。大气中硫酸盐形成的气溶胶对材料有腐蚀破坏作用 , 危害动植物 健康 , 而且可以起催化作用 , 加重硫酸雾毒性 ; 随降水到达地面以后 , 破坏土壤 结构 , 降低土壤肥力 , 对水系统也有不利影响。已知含有 Cu 2+ 、 Fe 3+ 、 Al 3+ 、 Mg 2+ 、 、 Na + 、 Fe 2+ 等离子的七种硫酸盐是常见的硫酸盐 , 下面的几种试剂 可以将以上七种硫酸盐溶液一次鉴别开来的是 ( ) A.NaOH 溶液 B.KSCN 溶液 C.NaHCO 3 溶液 D.NH 3 ·H 2 O 溶液 【 解析 】 选 A 。加入 NaOH 溶液后分别会看到蓝色沉淀、红褐色沉淀、先有白色 沉淀后溶解、白色沉淀、气体、无明显现象、先有白色沉淀后迅速变为灰绿 色最后变为红褐色。 NH 3 ·H 2 O 不能区分 Al 3+ 和 Mg 2+ 以及 和 Na + 。 2.(2020· 温州高二检测 ) 用 0.102 6 mol·L -1 的盐酸滴定 25.00 mL 未知浓度的 氢氧化钠溶液 , 滴定达终点时 , 滴定管中的液面如图所示 , 正确的读数为 ( ) A.22.30 mL B.22.35 mL C.23.65 mL D.23.70 mL 【 解析 】 选 B 。滴定管是一种精确度较高的仪器 , 每一小格为 0.10 mL, 零刻度在上 , 刻度自上而下逐渐增大。读数时视线要与凹液面的最低点相切 , 故读数为 22.35 mL 。 3. 下列有关实验中 , 用所选试剂 ( 括号内物质 ) 不能使实验达到目的的是 ( ) A. 证明 FeCl 2 溶液被氧化 (KSCN 溶液 ) B. 除去 C 2 H 6 中的 H 2 S 气体 (CuSO 4 溶液 ) C. 鉴别 SO 2 和 CO 2 两种气体 ( 溴水 ) D. 检验 Na 2 SO 4 溶液中是否混有 NaCl(AgNO 3 ) 溶液 【 解析 】 选 D 。 A 项中 Fe 2+ 被氧化生成 Fe 3+ , 遇 KSCN 溶液显红色 , 故 A 正确 ;B 项中的 H 2 S 气体与 CuSO 4 溶液反应能生成黑色的 CuS 沉淀 , 故 B 正确 ;C 项中的 SO 2 能使溴水褪色 , 而 CO 2 不能 , 故 C 正确 ;D 项中的 Na 2 SO 4 溶液也能与 AgNO 3 溶液反应生成白色沉淀 , 故 D 错误。 4.(2020· 金华高二检测 ) 如图曲线 a 和 b 是盐酸与氢氧化钠溶液相互滴定的滴定曲线 , 下列叙述正确的是 ( ) 世纪金榜导学号 A. 盐酸的物质的量浓度为 1 mol·L -1 B.P 点时恰好完全反应 , 溶液呈中性 C. 曲线 a 是盐酸滴定氢氧化钠溶液的滴定曲线 D. 酚酞不能用作本实验的指示剂 【 解析 】 选 B 。由滴定起始时 pH=1 可知盐酸的浓度为 0.1 mol · L -1 ; 曲线 a 起始时溶液 pH=1, 可知是 NaOH 溶液滴定盐酸的曲线 ; 酸碱中和滴定操作中可选用酚酞或甲基橙作为指示剂。 5.(2020· 日照高二检测 ) 水体中的含氮化合物是引起富营养化的主要污染物 , 分析检测水体中的硝酸 ( 盐 ) 和亚硝酸 ( 盐 ) 含量 , 控制水体中的含氮污染物 , 对水资源的循环利用意义重大。 (1) 亚硝酸 (HNO 2 ) 是一种弱酸 , 其电离平衡常数的表达式为 _________________________________________________ 。 (2) 水体中亚硝酸的含量可以利用 KI 溶液进行分析测定。该测定反应中 , 含氮的生成物可以是 NO 、 N 2 O 、 NH 2 OH 、 NH 3 等。 ① NH 2 OH 中 , 氮元素的化合价为 ________________ 。 ② 某水样中含有亚硝酸盐 , 加入少量稀硫酸酸化后 , 用 KI 溶液测定 , 且选用淀粉溶液作指示剂 , 反应中含 N 的生成物为 NO, 反应的离子方程式为 ____________ ________________________, 其中氧化产物为 ________( 写化学式 ) 。 ③取 20 mL 含 NaNO 2 的水样 , 酸化后用 0.001 mol·L -1 的 KI 标准溶液滴定 ( 反应中含 N 的生成物为 NO), 滴定前和滴定后的滴定管内液面高度如图所示 , 由此可知水样中 NaNO 2 的浓度为 ________ mg·L -1 。 【 解析 】 (1) 亚硝酸的电离方程式为 HNO 2 +H + , 因此其电离平衡常数 K a = (2)① 根据化合物中所有元素的化合价代数和为 0 可知 , NH 2 OH 中氮元素的化合价为 -1 。②亚硝酸具有氧化性 , 被 I - 还原 , 生成 NO,I - 被氧 化为 I 2 。③由滴定前后的滴定管读数可知消耗的 KI 标准溶液为 2.00 mL, 反应的 关系式为 NaNO 2 ~ HNO 2 ~ I - , 故 n(NaNO 2 )=n(I - )=2.00×10 -3 L×0.001 mol·L -1 =2×10 -6 mol, 则水样中 NaNO 2 的浓度为 2×10 -6 mol×69 g·mol -1 ÷0.02 L =6.9×10 -3 g·L -1 =6.9 mg·L -1 。 答案 : (1) (2)①-1 ② 2HNO 2 +2I - +2H + ====I 2 +2NO↑+2H 2 O( 或 2 +2I - +4H + ====2NO↑+I 2 +2H 2 O) I 2 ③ 6.9查看更多