2020届高考化学二轮复习专题二十四实验仪器和基本操作含解析
专题二十四 实验仪器和基本操作
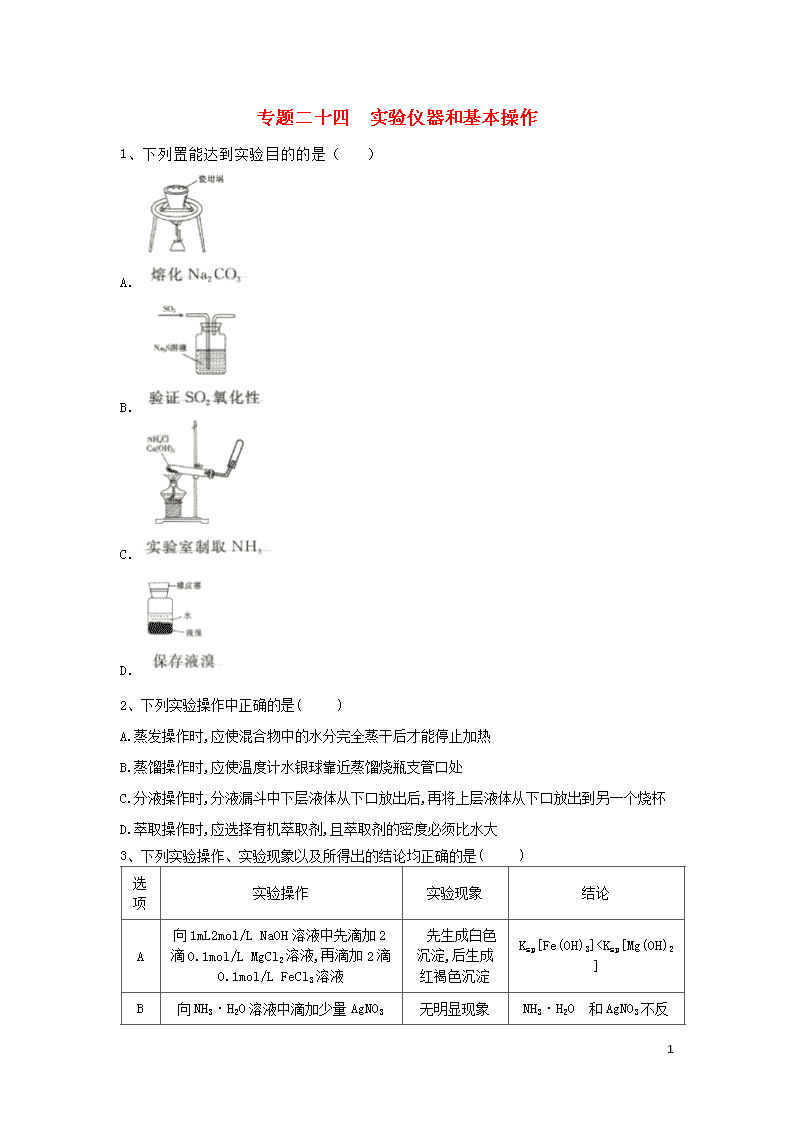
1、下列置能达到实验目的的是( )
A.
B.
C.
D.
2、下列实验操作中正确的是( )
A.蒸发操作时,应使混合物中的水分完全蒸干后才能停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处
C.分液操作时,分液漏斗中下层液体从下口放出后,再将上层液体从下口放出到另一个烧杯
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
3、下列实验操作、实验现象以及所得出的结论均正确的是( )
选项
实验操作
实验现象
结论
A
向1mL2mol/L NaOH溶液中先滴加2滴0.1mol/L MgCl2溶液,再滴加2滴0.1mol/L FeCl3溶液
先生成白色沉淀,后生成红褐色沉淀
Ksp[Fe(OH)3]
Fe2+
B
白铁皮(镀锌铁皮)出现刮痕后浸泡在饱和食盐水中,一段时间后滴入几滴K3[Fe(CN)6]溶液
无明显现象
该过程未发生原电池反应
C
向FeCl2溶液中加入足量Na2O2粉末
出现红褐色沉淀和无色气体
FeCl2溶液部分变质
D
SO2通入BaCl2溶液,然后滴入稀硝酸
出现白色沉淀,白色沉淀不溶于稀硝酸
所得沉淀为BaSO3,后转化为BaSO4
A.A B.B C.C D.D
15
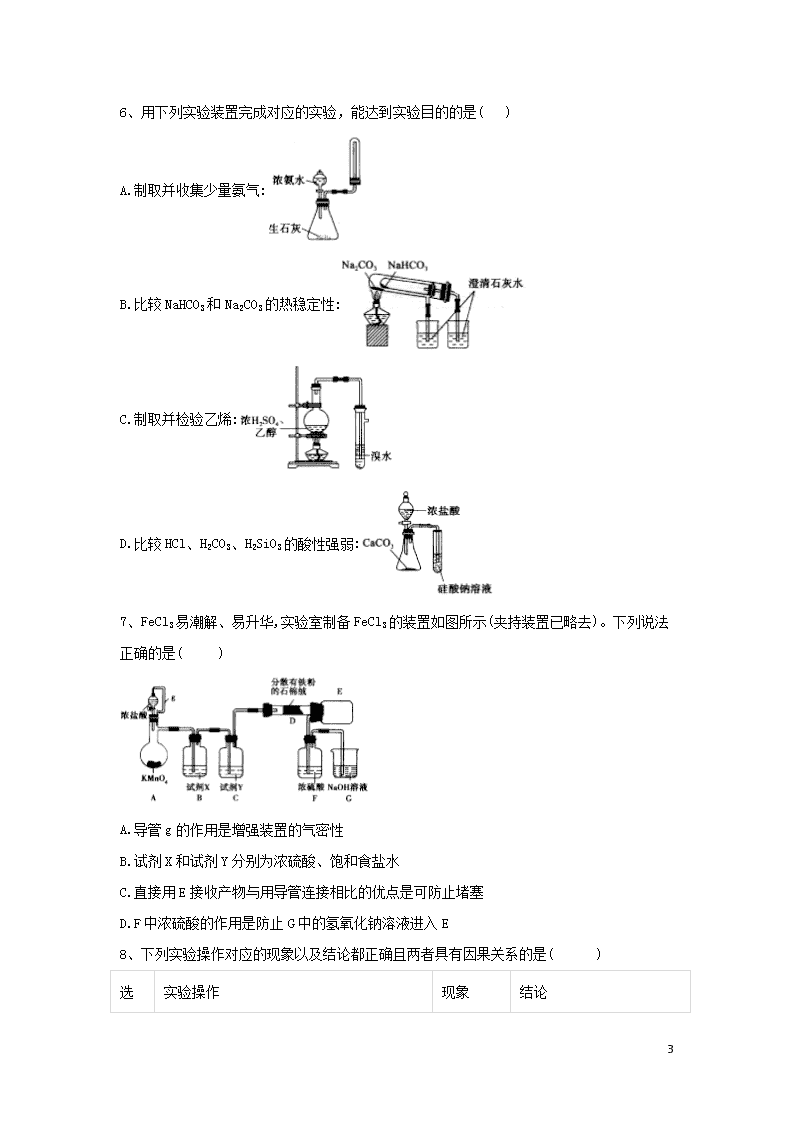
6、用下列实验装置完成对应的实验,能达到实验目的的是( )
A.制取并收集少量氨气:
B.比较NaHCO3和Na2CO3的热稳定性:
C.制取并检验乙烯:
D.比较HCl、H2CO3、H2SiO3的酸性强弱:
7、FeCl3易潮解、易升华,实验室制备FeCl3的装置如图所示(夹持装置已略去)。下列说法正确的是( )
A.导管g的作用是增强装置的气密性
B.试剂X和试剂Y分别为浓硫酸、饱和食盐水
C.直接用E接收产物与用导管连接相比的优点是可防止堵塞
D.F中浓硫酸的作用是防止G中的氢氧化钠溶液进入E
8、下列实验操作对应的现象以及结论都正确且两者具有因果关系的是( )
实验操作
现象
结论
15
选项
A
向2mL2% CuSO4溶液中加入几滴1% NaOH溶液,振荡后加入几滴有机物X溶液,加热
未出现砖红色沉淀
X不可能是葡萄糖
B
把铁片投入浓硫酸中
无明显变化
常温下铁不与
浓硫酸反应
C
向FeCl3和BaCl2混合溶液中通入足量SO2
溶液变为浅绿色
且有白色沉淀生成
沉淀为BaSO3
D
2mL 0.1mol·L-1 MgCl2溶液中滴加2滴1mol·L-1 NaOH溶液,再滴加2滴0.1mol·L-1 FeCl3溶液
先生成白色沉淀,
后生成红褐色沉淀
Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
A.A B.B C.C D.D
9、下列相关实验操作、现象和结论存在错误的是( )
选项
实验操作和现象
实验结论
A
在草酸溶液中滴加酸性高锰酸钾溶液,振荡,酸性高锰酸钾溶液褪色
草酸具有还原性
B
在密封的试管中加热氯化铵固体,固体减少,有气体生成,冷却后,试管壁上有白色晶体
氯化铵固体可升华
C
向沸水中滴加氯化铁饱和溶液,继续煮沸到溶液呈红褐色,停止加热,用激光笔照射该液体,有光亮的通路
Fe3+水解生成了Fe(OH)3胶体
D
将乙烯通入溴的四氯化碳溶液中,溶液由红棕色变为无色透明
乙烯和Br2发生加成反应无色物质
A.A B.B C.C D.D
15
10、完成下列实验所选择的装置或仪器正确的是( )
A
B
C
D
实验
中和热的测定
用铜和浓硫酸制备SO2
验证NaHCO3和Na2CO3的热稳定性
检验氧化产物
装置或仪器
A.A B.B C.C D.D
11、下列实验操作与温度计的使用方法均正确的是( )(加热装置略)
A.
B.
C.
15
D.
12、根据下列实验操作和现象所得出的结论正确的是( )
选项
实验操作和现象
结论
A
向NaCl和NaBr的混合溶液中滴入少量AgNO3溶液,产生淡黄色沉淀(AgBr)
Ksp(AgBr)H2S,所以在水溶液中SO2可与Na2S反应生成H2S,SO2可氧 化H2S生成S单质,所以能验证SO2的氧化性,B正确;C.收集氨气的试管口要放适量的棉花,以防止氨气与空气产生对流现象,同时导管伸入试管底部, C错误;D. Br2可与橡胶发生反应而腐蚀橡胶,所以 盛放液溴的试剂瓶要用玻璃寒,D错误。
2答案及解析:
答案:B
解析:
3答案及解析:
答案:D
解析:氢氧化钠溶液过最,加入的FeCLl3溶液与氢 氧化钠溶液反应生成红褐色沉淀,不能比较 Ksp[Fe(OH)3]和 KSP[Mg(OH)2]大小,A 错误;NH3•H2O溶液中滴加少量 AgNO3溶液,生成银氨溶液,二者发生了反应;B错误;将木炭和浓硫酸共热生成的气体有二氧化碳和一氧化硫,通入澄清石灰水中.都能反应生成碳酸钙沉淀和亚硝酸钙沉淀,结论错误,C错误;如果溶液中含有,加入盐酸酸化的BaCl2溶液,有白色沉淀产生;如果溶液中含有银离子.也具有此现象发生,所以不能确定该溶液中一定含有;D正确s
15
4答案及解析:
答案:D
解析:A.淀粉水解时加入硫酸做催化剂,所以水 解液中含有硫酸.应先加入氢氧化钠中和酸,再检验水解产物,故错误;B.苯和四氯化碳互溶,不能出现分层现象,故错误;C向FeSO4溶液中滴加 K3[Fe(CN)s]溶液,振荡,产生蓝色沉淀,故错误;D 鸡蛋白溶液为胶体,有丁达尔效应,故正确。
5答案及解析:
答案:A
解析:向足量含淀粉的FeI2溶液中滴加2滴氯水,溶液变蓝,说明碘离子被Cl2氧化为碘单质,Cl2先氧化碘离子,说明还原性I->Fe2+,A正确;锌的活泼性大于铁,因此锌作负极,而铁被保护,发生了原电池反应,但溶液中无亚铁离子,所以一段时间后滴入几滴K3[Fe(CN)6]溶液无明显现象,B错误;向FeCl2溶液中加入足量Na2O2粉末,过氧化钠具有强氧化性,能够把亚铁离子全部氧化为铁离子,不能证明FeCl2溶液是否变质,C错误;硝酸具有强氧化性,能够把二氧化硫氧化为硫酸根离子,所以反应发生后直接生成硫酸钡沉淀,没有亚硫酸钡沉淀,D错误。
6答案及解析:
答案:B
解析:制取并收集少量氨气,原理可行,但收集装置不对,只有进气管没有出气管,不安全,A不正确;比较NaHCO3和Na2CO3的热稳定性,虽然两者受热温度不同,但是碳酸氢钠在较低的温度下分解而碳酸钠在较高的温度下不分解,可以说明碳酸钠比碳酸氢钠稳定,B正确;制取乙烯时要使用温度计控制加热温度为170℃,缺少温度计,C不正确;比较HCl、H2CO3、H2SiO3的酸性强弱,由于浓盐酸有挥发性,生成的二氧化碳中有氯化氢杂质,氯化氢通入硅酸钠溶液中与其反应生成硅酸沉淀,无法证明碳酸与硅酸的酸性强弱,D不正确。
7答案及解析:
答案:C
解析:导管g的作用是平衡气压,A项错误;试剂X和试剂Y分别为饱和食盐水、浓硫酸,作用分別是除去Cl2中的HCl、干燥Cl2,B项错误;直接用E接收产物与用导管连接相比的优点是可防止堵塞,C项正确;F中浓硫酸的作用是防止G中氢氧化钠溶液中的水蒸气进入E,防止氯化铁潮解,D项错误。
15
8答案及解析:
答案:D
解析:向2mL2% CuSO4溶液中加入几滴1%NaOH溶液,显然NaOH量不足,而检验-CHO应在碱性条件下进行,因此该实验未出现砖红色沉淀,不能说明X不是葡萄糖,A项错误;常温下Fe遇浓硫酸发生钝化,生成致密的氧化膜阻止反应进一步发生,钝化属于化学反应,B项错误;Fe3+具有氧化性,在溶液中可将SO2氧化为,再与Ba2+反应生成BaSO4沉淀,C项错误;NaOH少量,根据现象可知,发生沉淀的转化,即Mg(OH)2转化为Fe(OH)3,则Ksp[Mg(OH)2]>Ksp[Fe(OH)3],D项正确。
9答案及解析:
答案:B
解析:草酸又名乙二酸(HOOC-COOH),是一种还原性二元弱酸,可与酸性高猛酸钾溶液发生氧化还原反应,使高锰酸钾溶液褪色,故A正确;氯化铵固体受热分解为氨气和氯化氢气体,遇冷后又重新化合生成氯化铵,这个过程不是升华,而是发生了典型的分解反应和化合反应,故B错误;胶体可产生丁达尔效应,氢氧化铁胶体的制备原理为FeCl3+3H2OFe(OH)3(胶体)+3HCl,加热可促进FeCl3水解,故C正确;而溴的四氯化碳溶液中通入乙烯发生加成反应,得到的BrCH2CH2Br是无色油状液体,故D正确。
10答案及解析:
答案:C
解析:A.图中缺少环形玻璃搅拌棒.故A错误;B.Cu与浓硫酸常温下不反应,不能制备气体,故B错 误;C.碳酸氣钠加热易分解,小试管中为碳酸氢钠, 可对比,故C正确;D. C与浓硫酸反应生成二氧化 碳、二氧化硫,均使石灰水变浑浊,不能检验氧化产 物.故D错误。
11答案及解析:
答案:A
解析:A.苯与浓硝酸均易挥发,反应温度应控制在50〜60,控制水浴温度, A正确;
B.混合液反应温度应迅速升温至170,故温度计水银球应没入溶液中,B错误;
C.中和热测定应填充保温隔热材 料,并使用环形玻璃搅拌棒,C错误;
D.乙醇和水无 法通过蒸馏分离,蒸馏操作时温度计水银球应与支管口平齐,D错误。
15
12答案及解析:
答案:D
解析:A. NaCl和NaBr的浓度大小未知,产生的淡黄色沉淀也可能是溴离子浓度较大所导致.因此该实验现象不能说明KSP(AgBr)
查看更多