- 2021-05-13 发布 |
- 37.5 KB |
- 22页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习常考题型大通关15工艺流程实验题含解析
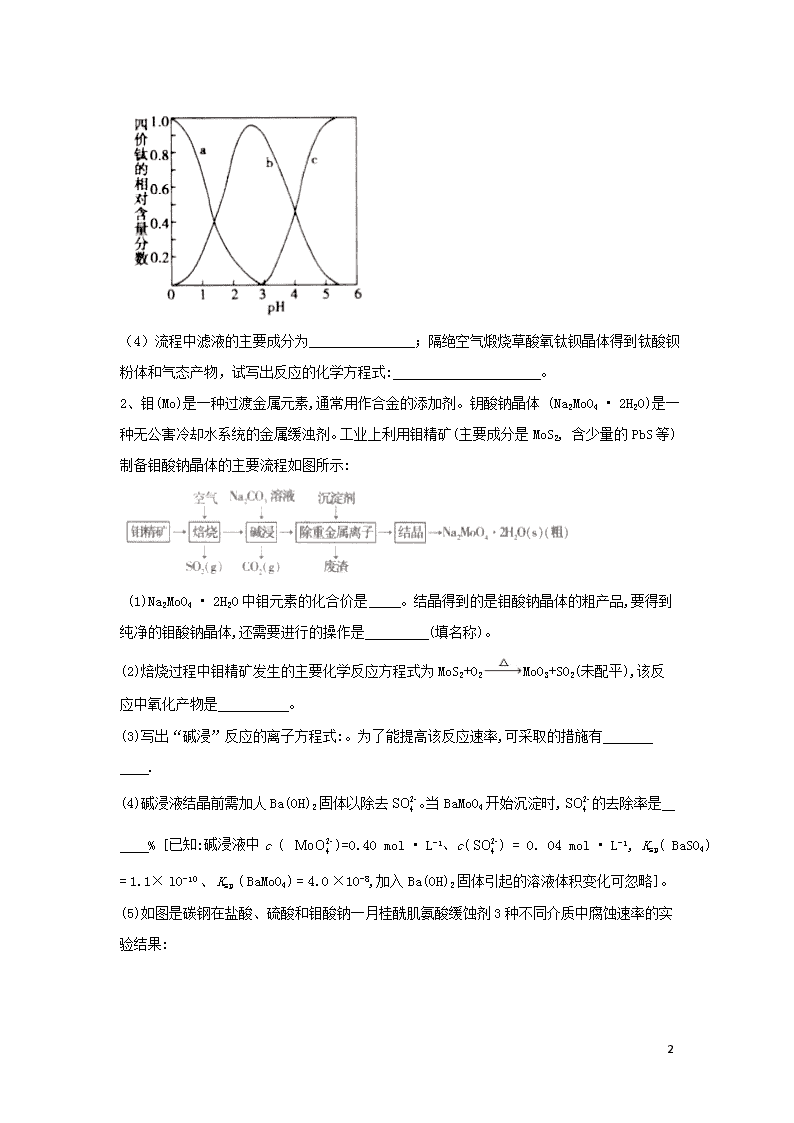
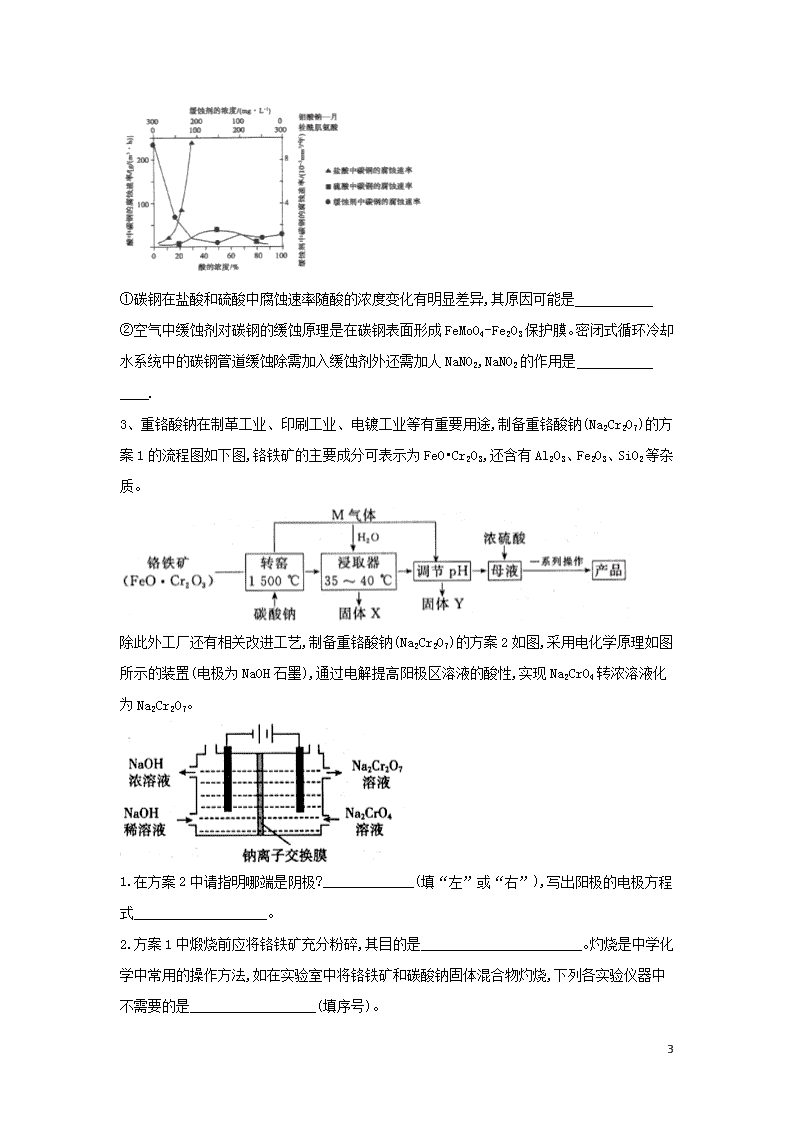
工艺流程实验题 1、某工厂以重晶石(主要含)为原料,生产电子陶瓷工业支柱—钛酸钡()的工艺流程如下: 回答下列问题: (1)为提高的酸浸速率,可采取的措施为 (写出一条即可);常温下,为液体且易水解,配制一定浓度的溶液的方法是 。 (2)用饱和溶液浸泡重晶石(假设杂质不与反应),能将转化为,此反应的平衡常数K= (填写计算结果);若不考虑的水解,要使2.33 恰好完全转化为,则至少需要浓度为溶液 mL[已知:] (3)混合形成的溶液中钛元素在不同pH时主要以、、三种形式存在(变化曲线如下图所示)。实际制备工艺中,先用氨水调节溶液的pH于2.8左右,再进行沉淀,其反应的离子方程式为 ;图中曲线c对应钛元素的存在形式 (填粒子符号)。 22 (4)流程中滤液的主要成分为 ;隔绝空气煅烧草酸氧钛钡晶体得到钛酸钡粉体和气态产物,试写出反应的化学方程式: 。 2、钼(Mo)是一种过渡金属元素,通常用作合金的添加剂。钥酸钠晶体 (Na2MoO4 • 2H2O)是一种无公害冷却水系统的金属缓浊剂。工业上利用钼精矿(主要成分是MoS2, 含少量的PbS等)制备钼酸钠晶体的主要流程如图所示: (1)Na2MoO4 • 2H2O中钼元素的化合价是 。结晶得到的是钼酸钠晶体的粗产品,要得到纯净的钼酸钠晶体,还需要进行的操作是 (填名称)。 (2)焙烧过程中钼精矿发生的主要化学反应方程式为MoS2+O2MoO3+SO2(未配平),该反应中氧化产物是 。 (3)写出“碱浸”反应的离子方程式:。为了能提高该反应速率,可采取的措施有 . (4)碱浸液结晶前需加人Ba(OH)2固体以除去。当BaMoO4开始沉淀时,的去除率是 % [已知:碱浸液中c ( )=0.40 mol • L-1、c() = 0. 04 mol • L-1, Ksp( BaSO4) = 1.1× l0-10 、 Ksp ( BaMoO4) = 4.0 ×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略]。 (5)如图是碳钢在盐酸、硫酸和钼酸钠一月桂酰肌氨酸缓蚀剂3种不同介质中腐蚀速率的实验结果: 22 ①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是 ②空气中缓蚀剂对碳钢的缓蚀原理是在碳钢表面形成FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀除需加入缓蚀剂外还需加人NaNO2,NaNO2的作用是 . 3、重铬酸钠在制革工业、印刷工业、电镀工业等有重要用途,制备重铬酸钠(Na2Cr2O7)的方案1的流程图如下图,铬铁矿的主要成分可表示为FeO•Cr2O3,还含有Al2O3、Fe2O3、SiO2等杂质。 除此外工厂还有相关改进工艺,制备重铬酸钠(Na2Cr2O7)的方案2如图,采用电化学原理如图所示的装置(电极为NaOH石墨),通过电解提高阳极区溶液的酸性,实现Na2CrO4转浓溶液化为Na2Cr2O7。 1.在方案2中请指明哪端是阴极?_____________(填“左”或“右”),写出阳极的电极方程式___________________。 2.方案1中煅烧前应将铬铁矿充分粉碎,其目的是_______________________。灼烧是中学化学中常用的操作方法,如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,下列各实验仪器中不需要的是__________________(填序号)。 22 a.陶瓷坩埚 b.铁 c.三脚架 d.泥三角 转窑中发生的主要反应除了下面的两个反应外,还有其他反应。 ①Na2CO3+Al2O32NaAlO2+CO2↑; ②________FeO•Cr2O3+ __________Na2CO3+ ________O2 _______Na2CrO4+_______Fe2O3+_________。 请配平反应②的化学方程式。 请写出其他主要反应方程式:______________、_____________。 3.固体Y的化学式为____________、____________。 4.向母液中加入浓硫酸,把铬酸钠转化为重铬酸钠,经两次蒸发,主要是除去__________(填化学式),冷却至30-40 ℃得到产品晶体。洗涤该晶体的容剂最好是____________(填序号)。 a.蒸馏水 b无水乙醇 c.75%乙醇溶液 5.为了测定实验制得的产品中Na2Cr2O7的含量,称取样品0.140 g置于锥形瓶中,加50 mL水;再加入2 g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10 min;然后加入150 mL蒸馏水并加入3 mL 0.5%淀粉溶液;用0.100 0 mol/L.Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00 mL。(假定杂质不参加反应,已知:+6I- +14H+=2Cr3+ +3I2+7H2O,I2+2=2I-+ ①终点实验现象是______________。 ②该产品中Na2Cr2O7的纯度为________________。(以质量分数表示) ③若滴定管在滴定前俯视读数,滴定结束后视读数,测得样品的纯度将_________(填“偏高"或“偏低”或“无影响") 4、废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁, 利用电解法回收WC和制备的工艺流程图如下: 已知:在上述流程中,各种金属离子形成氢氧化物沉淀的pH范围如下: 22 金属离子 开始沉淀的pH 1. 9 7.0 6. 5 沉淀完全的pH 3. 2 9. 0 9.4 回答下列问题: (1)以废旧刀具作阳极,不锈钢作阴极,盐酸为电解质溶液。电解时阳极的电极反应有: 和 。 (2)通入氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择的pH的范围是 。 (3)生成的离子方程式是 . (4)实验测得溶液显碱性。制备时,不能将滤液加入溶液中,原因是 . (5)已知:,。若仅从沉淀转化角度考虑, 在0.01 mol/L,溶液中加入固体能否转化为沉淀?通过计算说明: . (6)洗涤不充分对最终产品纯度并无影响,但在焙烧时会造成环境污染,主要原因时 。 (7) 生成的化学方程式是 。 5、聚合硫酸铁(简称PFS或聚铁)是水处理中重要的絮凝剂。以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取聚合硫酸铁([]m)的工艺流程如下: 1.酸浸时最合适的酸是______________(写化学式)。 2.酸浸后溶液中主要的阳离子有______________。 3.加入KClO3的目的是_______________(结合离子方程式说明)。 4. 22 过程a中生成聚合硫酸铁的过程是先水解再聚合。将下列水解反应原理的化学方程式补充完整。 _______Fe2(SO4)3+___________H2O=________+____________ 5.过程a中水解要严控pH的范围。pH偏小或偏大聚合硫酸铁的产率都会降低,请解释原因_________________。 6.盐基度B是衡量絮凝剂絮凝效果的重要指标,通常盐基度越高,絮凝效果越好。盐基度B的表达式:×100%(n为物质的量)。为测量聚合硫酸铁的盐基度,进行如下实验操作: ⅰ.取聚合硫酸铁样品m g,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+,使Fe3+不与OH-反应。然后以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V mL。 ⅱ.做空白对照实验,取与步骤ⅰ等体积等浓度的盐酸,以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0 mL。 ①该聚合硫酸铁样品中n(OH-)=_____________mol。 ②已知该样品中Fe的质量分数ω,则盐基度B=______________。 6、ZrO2为高品质耐火材料。以锆英石(氧化物形式:mZrO2 ▪nSiO2为原料可制得宝石级ZrO2,工艺流程如下: 已知:固体A主要含有普通玻璃的成分之一。 (1)固溶体的成分除ZrO2、CaO外,还有一种物质为 . (2)ZrOCl2在氨水中发生反应II,生成难溶于水的Zr(OH)4,其化学方程式为 ;制备Zr(OH)4的过程中温度不能过高的原因是 (3)选用下列部分操作,能够实现流程中“一系列实验操作”的合理顺序为 。(选用字母序号表示) a.溶解 b.干燥 c.过滤d.灼烧e.洗涤 (4)反应I产生的CO2在一定条件下与N2反应可产生具有麻醉作用的笑气( N2O):CO2(g)+N2(g) =CO(g) + N2O(g) 22 在T1、100 kPa 时,研究表明反应速率v(CO2) = 3×l0-3×p(CO2)(kPa • min-1),该条件下现将1.5 mol N2和1.0 mol CO2充入某刚性容器中在催化剂作用下充分反应,62 min时达到平衡,测得p(CO) = 32 kPa,则此时v(CO2)= kPa • min-1,反应的平衡常数Kp = (Kp为以分压表示的平衡常数)。若升温至T2重新达到平衡后,CO2的转化率增大,则该反应的 0(填“>”、“=”或“<”)。 7、CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下: 已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等; ②酸性条件下,不会氧化Co2+,转化为Cl-; ③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L) 沉淀物 开始沉淀 2.7 7.6 7.6 4.0 7.7 完全沉淀 3.7 9.6 9.2 5.2 9.8 ④CoCl2·6H2O熔点为86℃,加热至110-120℃时,失去结晶生成无水氯化钴。 请回答: 1.写出浸出过程中Co2O3发生反应的离子方程式___________。 2.向浸出液中加入 NaClO3发生主要反应的离子方程式___________。 3.“加Na2CO3调pH至5.2”,过滤所得到的沉淀Ⅹ成分为___________。 4.萃取剂对金属离子的萃取率与pH的关系如图所示,萃取剂使用的适宜pH范围是___________。(填选项序号字母) 22 A 1.0-2.0 B 2.5-3.5 C 4.0-5.0 5.制得的CoCl2·6H2O在烘干时需减压烘干的原因是___________。 6.为测定粗产品中CoCl2·6H2O含量,称取2g的粗产品溶于水,配成100mL溶液,取出20mL置于锥形瓶,加入K2CrO4做指示剂( Ag2CrO4为砖红色沉淀),用0.2mol/L的AgNO3溶液滴定至终点,重复2-3次,平均消耗AgNO3标准溶液10.00mL。该粗产品中CoCl2·6H2O的质量分数为___________。用K2CrO4做指示剂时,需要控制溶液pH值为6.5-10.5,试分析原因______________________。 8、锗是重要的稀缺战略资源,广泛应用于众多国防军工及民用领域,属于我国战略收储金属。某科研课题采用的提取锗技术路线为:低品位锗精矿-(次亚磷酸钠热还原-真空挥发富集)-挥发产物高品位还原锗精矿-碱氧化预处理-盐酸蒸馏提纯-高纯四氯化锗-高纯二氧化锗。 22 1.在周期表中金属与非金属的分界处,可以找到半导体材料,如Si、 ___等,半导体器件的研制正是开始于___,后来发展到研制与它同族的___。三种元素依次是__________(填标号)。 a.Ge Si Ge b.Ge Ge Si c.C Si Ge 2.请配平次亚磷酸钠热还原反应的化学方程式并在括号内注明反应条件:__________NaH2PO2·H2O+__________GeO2 (__________)__________Na4P2O7+__________H2O+__________GeO↑+__________H3PO4,__________ 3. 高品位还原锗精矿碱氧化预处理过程的产物是锗酸钠,请写出该过程的化学反应方程式:__________ 4. 高纯二氧化锗含量采用碘酸钾滴定法进行分析。称取3.600g高纯二氧化锗样品,采用氢氧化钠在电炉上溶样,次亚磷酸钠加热还原,然后以淀粉为指示剂,用碘酸钾标准溶液(0.6000mol/L)滴定,消耗的碘酸钾体积为19.00mL。[20℃以下,次亚磷酸钠不会被碘酸钾和碘氧化] ①滴定终点的现象是__________。 ②此样品中二氧化锗含量是__________。(保留四位有效数字) 5. 用氢气还原GeO2可制得金属锗。其反应如下: GeO2+ H2= GeO+ H2O ① GeO+ H2= Ge+ H2O ② GeO2+ 2H2= Ge+ 2H2O ③ 反应式③ΔH=+13750 kJ/mol ,ΔS=+15600J/(K·mol),则还原反应的温度一般控制在__________℃范围内。[已知GeO在700℃会升华,T(K)=t(℃)+273] 6.锗在硝酸中的溶解速度受硝酸浓度、搅拌速度、温度等因素影响。如图,锗溶解速度有一最大值,硝酸的浓度小于此值时,随浓度增加溶解速度增加,反之降低,这是由于硝酸浓度高时__________加剧所致。 9、铅精矿可用于冶炼金属铅,其主要成分为PbS。 22 I.火法炼铅将铅精矿在空气中焙烧,生成PbO和。 (1)用铅精矿火法炼铅的反应的化学方程式为___________________________________。 (2)火法炼铅的废气中含低浓度,可将废气通入过量氨水中进行处理,反应的离子方程式为_______________________________________。 II.湿法炼铅在制备金属铅的同时,还可制得硫黄,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下: 已知:i.不同温度下的溶解度如下表所示。 温度(℃) 20 40 60 80 100 溶解度(g) 1.00 1.42 1.94 2.88 3.20 ii.为能溶于水的弱电解质,在浓度较大的溶液中,存在平衡:。 (3)浸取液中的作用是__________________________________。 (4)操作a为加适量水稀释并冷却,该操作有利于滤液1中的析出,分析可能的原因是_______________________________________。 (5)将溶液3和滤液2分別置于下图所示电解装置的两个极室中,可制取金属铅并使浸取液中的再生。 ①溶液3应置于_____________(填“阴极室”或“阳极室”)中。 22 ②简述滤液2电解后再生为的原理:____________________________________________。 ③若铅精矿的质量为a g,铅浸出率为b,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数的计算式为_______________________。 10、以黄铁矿为原料制硫酸会产生大量的废渣,合理利用废渣可以减少环境污染,变废为宝。工业上利用废渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下: 1.在废渣溶解操作时,应选用__________溶解(填字母)。 A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸 2.为了提高废渣的浸取率,可采用的措施有哪些?__________(至少写出两点)。 3.物质A是一种氧化剂,工业上最好选用__________(供选择使用的有:空气、Cl2、MnO2),其理由是__________氧化过程中发生反应的离子方程式为__________。 4.根据如图有关数据,你认为工业上氧化操作时应控制的条件(从温度、pH和氧化时间三方面说明)是__________。 5.铵黄铁矾中可能混有的杂质有Fe(OH)3、________。 6.铵黄铁矾的化学式可表示为(NH4)xFey(SO4)z(OH)w,其化学式可通过下列实验测定: ①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。 22 ②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32g。 ③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体448mL,同时有红褐色沉淀生成。 ④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80g。 通过计算,可确定铵黄铁矾的化学式为___________________________。(已知铵黄铁矾的摩尔质量为960g·mol-1,计算过程中不考虑固体损失和气体溶解。 答案以及解析 1答案及解析: 答案:(1)将研成粉末或适当增大盐酸浓度或适当加热或搅拌等 将溶于浓盐酸,再加适量水稀释至所需浓度 (2)0.02;510 (3); (4) ; 解析: (1)易发生水解反应:,使溶液变浑浊,为了得到澄清的溶液,同时不引入杂质离子,通常是将溶于浓盐酸中,然后再加适量水稀释至所需浓度。 (2)在溶液中存在沉淀溶解平衡,当向溶液中加入饱和溶液时,发生沉淀转化生成:,反应的平衡常数,2.33g的物质的量为0.01mol,则完全转化为需要0.01 mol,同时溶液中产生0.01 mol,则溶液中:,故需要加入的为,溶液的体积为. 22 (3)调节溶液pH在2.8左右生成草酸氧钛钡晶体,反应的离子方程式为;随着氨水的不断加入,溶液的pH不断增大,曲线c对应钛元素的存在形式为。 (4)、、溶液和氨水混合得到草酸氧钛钡晶体,根据原子守恒,滤液中主要成分为。草酸氧钛钡晶体隔绝空气煅烧得到,同时得到CO、及水蒸气,化学方程式为. 2答案及解析: 答案:(1)+6;重结晶 (2)MoO3,SO2 (3)MoO3+=+CO2 ↑; 将焙烧产品粉碎或适当升高 温度 (4)97.25 (5)①Cl-促进碳钢的腐蚀,抑制碳钢的腐蚀;硫酸浓度增大,会使碳钢钝化 ②替代空气中氧气起氧化剂作用 解析:(1)要得到纯净的钼酸钠晶体,需要进行重结晶。 (2)反应中氧元素化合价从0价变为-2价,硫元素化合价升高到+4 价,钼元素化合价升高到+6价,元素化合价升高的物质被氧化,故氧 化产物是MoO3、SO2。 (3)Na2CO3溶液和MoO3反应生成二氧化碳和Na2MoO4,反应的离子 方程式为MoO3+=+CO2 ↑。能提高该反应速率的措 施:将焙烧产品粉碎,增大接触面积,适当增大碳酸钠溶液的浓度,适当升高温度。 (4)Ksp(BaMoO4)= 4.0×10-8碱浸液中 c()= 0.40 mol ▪ L-1, BaMoO4开始沉淀时,c(Ba2+)=, Ksp(BaSO4)= 1.1×10-10, c()=,硫酸根离子的去除率为 3答案及解析: 22 答案:1.左;2H2O-4e-=O2↑+4H+,2+2H+=+H2O 2.增大表面积,提高反应速率,使反应更充分;a;4、8、7、8、2、8CO2; Na2CO3+ SiO2Na2SiO3+CO2↑ 3.A1(OH)3;H2SiO3; 4.Na2SO4;с 5.①当滴入最后一滴标准液时,溶液由蓝色变为无色,且半分钟内不复原 ②93.57%;③偏高 解析:1.由图可知,与电源负极相连的左端为电解池的阴极,电极反应式为2H2O+2e-=H2↑+ 2OH-,右端为阳极,电极反应式为2H2O-4e-=O2+4H+,2+2H+=+H2O; 2.方案1中将铬铁矿充分粉碎,可以增大固体的表面积,增大表面积,提高反应速率,使反应更充分;如在实验室中将铬铁矿和碳酸钠固体混合物灼烧,因陶瓷中二氧化硅与碳酸钠固体高温反应,所以实验仪器为铁坩埚、三脚架、泥三角,不需要陶瓷增场;反应②中,FeO•Cr2O3中铬元素被氧气氧化生成Na2CrO4,配平的化学方程式为4FeO•Cr2O3+8Na2CO3+7O28Na2CrO4+2Fe2O3+8CO2;反应中二氧化硅杂质也与碳酸钠高温下反应生成硅酸钠和二氧化碳,反高温应的化学方程式为Na2CO3+ SiO2Na2SiO3+ CO2↑; 3.向含有溶于水的Na2CrO4、NaAlO2,Na2SiO3的滤液中通入反应生成的二氧化碳气体调节溶液pH,NaAlO2、Na2SiO3与二氧化碳溶液生成硅酸沉淀和氢氧化铝沉淀,过滤得到含有Na2CrO4的母液和含有硅酸沉淀和氢氧化铝沉淀的滤渣Y; 4.向母液中加入浓硫酸,Na2Cr2O7与浓硫酸反应生成重铬酸钠和硫酸钠,将混合溶液蒸发浓缩、冷却结晶除去硫酸钠得到Na2Cr2O7晶体;为除去晶体表面的可溶性杂质,洗涤该晶体的溶剂最好是75%乙醇溶液; 5.①向Na2Cr2O7溶液中加入过量KI溶液发生如下氧化还原反应,反应的离子方程式为+6I-+14H+=2Cr3++3I2+7H2O,向反应后的溶液中加入淀粉溶液,溶液变为蓝色,再加入Na2S2O3标准溶液,发生反应I2+2=2I-+,溶液蓝色褪去,所以终点实验现象为当滴入最后一滴标准液时,溶液由蓝色变为无色,且半分钟内不复原;②有反应方程式可得如下关系:-3I2-6,反应消耗n()为0.100 0 mol/L ×0.030 0 L=0.003 22 mol,则n()为0.003 mol/6=0.000 5 mol,则Na2Cr2O7的纯度为(0.000 5 mol×262 g/mol)/0.140 g× 100%≈93.57%;③若滴定管在滴定前俯视读数,滴定结束后仰视读数,消耗Na2S2O3标准溶液体积偏大,则所测结果偏高。 4答案及解析: 答案:(l) (2)3. 2查看更多