- 2021-05-11 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学一轮复习考点分类26硫和氮的氧化物
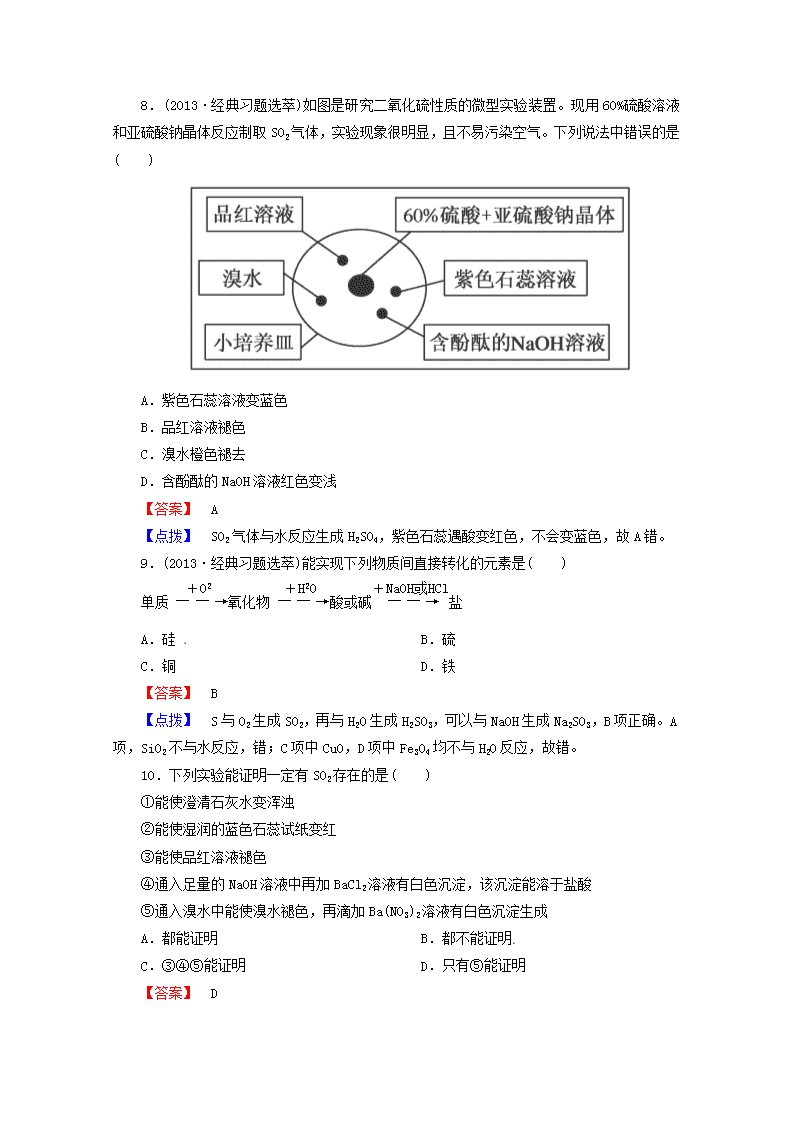
硫和氮的氧化物 一、选择题 1.(2013·试题调研)用某溶液浸湿滤纸后置于集气瓶口,以检验瓶中是否收集满SO2气体。则该溶液是( ) A. BaCl2溶液 B.酸性KMnO4溶液 C.KI淀粉溶液 D.澄清的石灰水 【答案】 B 【点拨】 SO2与BaCl2溶液、KI溶液都不发生反应,而与滤纸上的石灰水反应生成少量的白色CaSO3沉淀,现象也不明显,只有酸性KMnO4溶液氧化SO2后,紫色变淡或褪去,现象明显。 2.(2013·试题调研)关于SO2的叙述中,不正确的是( ) A.SO2在有的反应中显示氧化性,有的反应中显还原性 B.SO2是酸性氧化物,溶于水生成亚硫酸 C.SO2能使酸性KMnO4溶液褪色,说明SO2具有漂白性 D. SO2气体通入品红溶液中,溶液褪色 【答案】 C 【点拨】 A项,SO2中S元素化合价为+4价,处于硫元素的中间价态,因此既有氧化性,又有还原性;B项,SO2+H2OH2SO3;C项,体现了SO2的还原性;D项,SO2具有漂白性,能使品红溶液褪色。 3.(2013·经典习题选萃)向BaCl2溶液中通入SO2至饱和,此过程无明显实验现象。再向溶液中加入一种物质,溶液变浑浊。加入的这种物质不可能是( ) A.FeCl3溶液 B.AgNO3溶液 C.稀氨水 D.NH4Cl溶液 【答案】 D 【点拨】 A中的FeCl3溶液可以氧化SO2从而生成BaSO4沉淀;B中的AgNO3溶液可以与BaCl2溶液反应生成AgCl沉淀;C中的稀氨水先与亚硫酸反应生成亚硫酸铵,然后亚硫酸铵与BaCl2溶液反应生成BaSO3沉淀。 4.(2013·试题调研)为除去CO2中混有的SO2和O2,下列试剂使用顺序正确的是( ) ①饱和的Na2CO3溶液 ②饱和的NaHCO3溶液 ③浓硫酸 ④灼热的铜网 ⑤碱石灰 A.①③④ B.②③④ C.②④③ D.③④⑤ 【答案】 B 【点拨】 除杂时,所选试剂不能和被提纯物质反应,故①⑤不可以;②饱和的NaHCO3溶液除去SO2的同时放出CO2气体,且带出部分水蒸气,用③浓硫酸除去水蒸气后,再用④灼热的铜网除去O2从而得到纯净的CO2。 5.大约4 000年前,埃及人已经用硫燃烧所形成的二氧化硫漂白布匹。在古罗马著名诗人荷马的著作里也讲到硫燃烧有消毒和漂白作用。下列物质①潮湿的氯气;②二氧化硫;③活性炭;④过氧化钠都具有漂白性。其漂白原理相同的是( ) A.①③ B.②③ C.①④ D.②④ 【答案】 C 【点拨】 ①④都是强氧化型漂白;②是化合型漂白;③是吸附型漂白。 6.下列实验报告记录的实验现象正确的是( ) 实验 现 象 A 无色 无色 无现象 无色 B 红色 无色 白色沉淀 红棕色 C 红色 无色 溶液变无色,白色沉淀 无色 D 无色 无色 无色溶液 红棕色 【答案】 C 【点拨】 SO2通入石蕊试液中,石蕊试液会变红,但SO2不能漂白酸碱指示剂;SO2通入品红溶液中品红溶液褪色体现SO2的漂白性,SO2能被氯水和碘水氧化而使氯水和碘水褪色。 7.(2013·试题调研)将硫黄在氧气中燃烧生成气体A,把气体A溶于水得溶液B,向B中滴加溴水,溴水褪色而B变为C;在C中加入Na2S产生气体D,若将D通入B溶液,可得沉淀E;A、B、C、D、E中均含有硫元素。在下列各组中按A、B、C、D、E排列的是( ) A.SO2、H2SO4、H2SO3、H2S、S B.SO2、H2SO3、H2SO4、SO2、SO3 C.SO2、H2SO4、H2SO3、SO2、S D.SO2、H2SO3、H2SO4、H2S、S 【答案】 D 8.(2013·经典习题选萃)如图是研究二氧化硫性质的微型实验装置。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气。下列说法中错误的是( ) A.紫色石蕊溶液变蓝色 B.品红溶液褪色 C.溴水橙色褪去 D.含酚酞的NaOH溶液红色变浅 【答案】 A 【点拨】 SO2气体与水反应生成H2SO4,紫色石蕊遇酸变红色,不会变蓝色,故A错。 9.(2013·经典习题选萃)能实现下列物质间直接转化的元素是( ) 单质氧化物酸或碱盐 A.硅 B.硫 C.铜 D.铁 【答案】 B 【点拨】 S与O2生成SO2,再与H2O生成H2SO3,可以与NaOH生成Na2SO3,B项正确。A项,SiO2不与水反应,错;C项中CuO,D项中Fe3O4均不与H2O反应,故错。 10.下列实验能证明一定有SO2存在的是( ) ①能使澄清石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使品红溶液褪色 ④通入足量的NaOH溶液中再加BaCl2溶液有白色沉淀,该沉淀能溶于盐酸 ⑤通入溴水中能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀生成 A.都能证明 B.都不能证明 C.③④⑤能证明 D.只有⑤能证明 【答案】 D 【点拨】 符合①的有SO2、CO2;符合②的为酸性气体,符合③的有Cl2、O3、SO2;符合④的有SO2、CO2;⑤中能使溴水褪色的为还原性较强的气体,如H2S、SO2,再加Ba(NO3)2有白色沉淀的只有SO2。 二、非选择题 11.在某NaOH溶液里加入几滴酚酞试液,溶液显红色,向其中逐滴加入新制的饱和氯水,当滴到最后一滴时,红色突然褪去。回答下列问题: (1)产生该现象的原因可能有:①______________________; ②________________________________________________。 (2)简述怎样用实验证明红色褪去的原因是①或者是②。________________________________________________ ________________________________________________ ________________________________________________。 【答案】 (1)①氯水中H+(或Cl2)与OH-反应 ②氯水中HClO使酚酞褪色 (2)向褪色后的溶液中再滴加NaOH溶液,若红色再出现,则是原因①造成的;若红色不再出现,则是原因②造成的。 【点拨】 饱和氯水中存在着HCl和HClO,那么使溶液红色突然褪去的原因可能是①酸(HCl和HClO)中和了NaOH;②HClO的强氧化性使色素褪色。前者当溶液呈碱性时,红色复现,而后者则无变化,故应用NaOH溶液进行反滴。 12.某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。 【提出猜想】 猜想1:________________________________________________; 猜想2:________________________________________________; 猜想3:________________________________________________。 为了验证猜想,该小组设计实验加以探究。 【实验探究】 该小组同学按下图所示装置,将气体从a端通入,则: (1)B中应该装________试剂(填编号)。 A.NaCl溶液 B.KMnO4酸性溶液 C.盐酸 D.澄清石灰水 (2)A中品红溶液的作用是________________。 (3)D中澄清石灰水的作用是______________。 通过该实验,该小组同学观察到以下三个实验现象: ①A中品红溶液褪色 ②C中品红溶液不褪色 ③D中澄清石灰水变浑浊 【得出结论】 (4)由上述现象该小组同学确认该气体为________。 【答案】 气体为CO2 气体为SO2 气体为CO2和SO2的混合气体 (1)B (2)检验该气体中是否含有SO2 (3)检验该气体中是否含有CO2 (4)CO2和SO2的混合气体 【点拨】 SO2和CO2在某些性质方面较相似,如都能使澄清石灰水变浑浊,若通入的气体过量,则浑浊都可消失,但SO2具有还原性,能被强氧化剂氧化,且SO2可使品红溶液褪色,而CO2不具备这些性质,可引用差异性鉴别CO2的存在与否。 13.(2013·经典习题选萃)已知X、Y为有刺激性气味的气体,有以下转化关系,部分产物未标出。 试回答: (1)写出下列物质的化学式 X________、Y________、A________、B______、 C________。 (2)反应①的化学方程式为_______________________, 反应②的离子方程式为_________________________。 【答案】 (1)Cl2 SO2 HCl H2SO4 FeCl3 (2)Cl2+SO2+2H2O===2HCl+H2SO4 2Fe3++SO2+2H2O===2Fe2++SO+4H+ 【点拨】 A与HNO3酸化的AgNO3反应产生白色沉淀。A中含Cl-,B与盐酸酸化的BaCl2反应,产生白色沉淀,B中含SO,又根据X、Y均为有刺激性气味的气体,且X能与Fe反应,则X为Cl2,Y为SO2,A为HCl,B为H2SO4,C为FeCl3。 14.(2013·试题调研)一包重41.6 g的固体样品,其成分是硫和铁的化合物,将它充分煅烧后,硫和铁分别被氧化成SO2和Fe2O3,其中SO2在标准状况下为13.44 L。试求: (1)样品中硫元素与铁元素的物质的量之比。 (2)样品化合物的成分是什么? (3)样品中化合物的物质的量各为多少? 【答案】 (1)3:2 (2)FeS和FeS2 (3)FeS为0.2 mol FeS2为0.2 mol(说明:答案(2)也可以是Fe2S3) 【点拨】 (1)n(SO2)==0.6 mol,41.6 g样品中含铁的质量为 m(Fe)=41.6 g-0.6 mol×32 g·mol-1=22.4 g, n(Fe)==0.4 mol, n(S):n(Fe)=0.6 mol:0.4 mol=3:2。 (2)因1:1<3:2<2:1,故该样品为FeS和FeS2的混合物。 (3)设FeS、FeS2的物质的量分别为x、y,则有 SO2与碱反应的有关计算分析 SO2与强碱NaOH发生反应时,产物是Na2SO3还是NaHSO3 ,取决于二者的用量,遇到类似这样的问题,设SO2的物质的量为n(SO2),NaOH的物质的量为n(NaOH),数轴代表,如下列数轴所示: 若NaOH与SO2按1:1反应时,发生反应:NaOH+SO2===NaHSO3。 若NaOH与SO2按2:1反应时,发生反应:2NaOH+SO2===Na2SO3+H2O。 (1)若=2时,发生反应①,反应后的物质为Na2SO3。 (2)若≤1时,发生反应②,反应后的物质为NaHSO3。 (3)若1<<2,同时发生反应①、②,反应后的物质为Na2SO3与NaHSO3。 (4)若>2,发生反应①,反应后的物质为NaOH与Na2SO3。 【例】 向20 mL 1 mol/L的NaHCO3溶液中通入一定量的SO2,两种物质恰好完全反应,在生成的溶液中,Na+与溶液中化合态硫的物质的量之比为4:3,求通入的SO2的体积(标准状况)。 【解析】 SO2溶于水后生成亚硫酸,所以SO2与NaHCO3溶液的反应实质上是H2SO3与NaHCO3的反应,并且是较强的酸制较弱的酸的反应。由于H2SO3是二元中强酸,所以与NaHCO3反应可以生成两种盐。究竟能生成哪种盐,要根据SO2与NaHCO3的物质的量之比而定。因此,本题应首先判断生成两种盐(NaHSO3和Na2SO3)时应满足的条件,再根据题中已知条件作出合理的判断,进而求出通入SO2的体积。 【答案】 SO2通入到NaHCO3溶液中,可能发生的反应有:①SO2+2NaHCO3===Na2SO3+2CO2+H2O,②SO2+NaHCO3=== NaHSO3+CO2。若只发生反应①,在生成的溶液中,n(Na+):n(化合态S)=2:1;若只发生反应②,则n(Na+):n(化合态S)=1:1,题中的条件是n(Na+):n(化合态S)=4:3,由于1<<2,则①②两个反应均会发生,设生成Na2SO3物质的量为x,生成NaHSO3物质的量为y,依题意有:,解得。 n(SO2)=x+y=0.015mol, V(SO2)=0.015 mol×22.4 L/mol=0.336 L。查看更多