- 2021-04-25 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考重庆理综化学试题解析
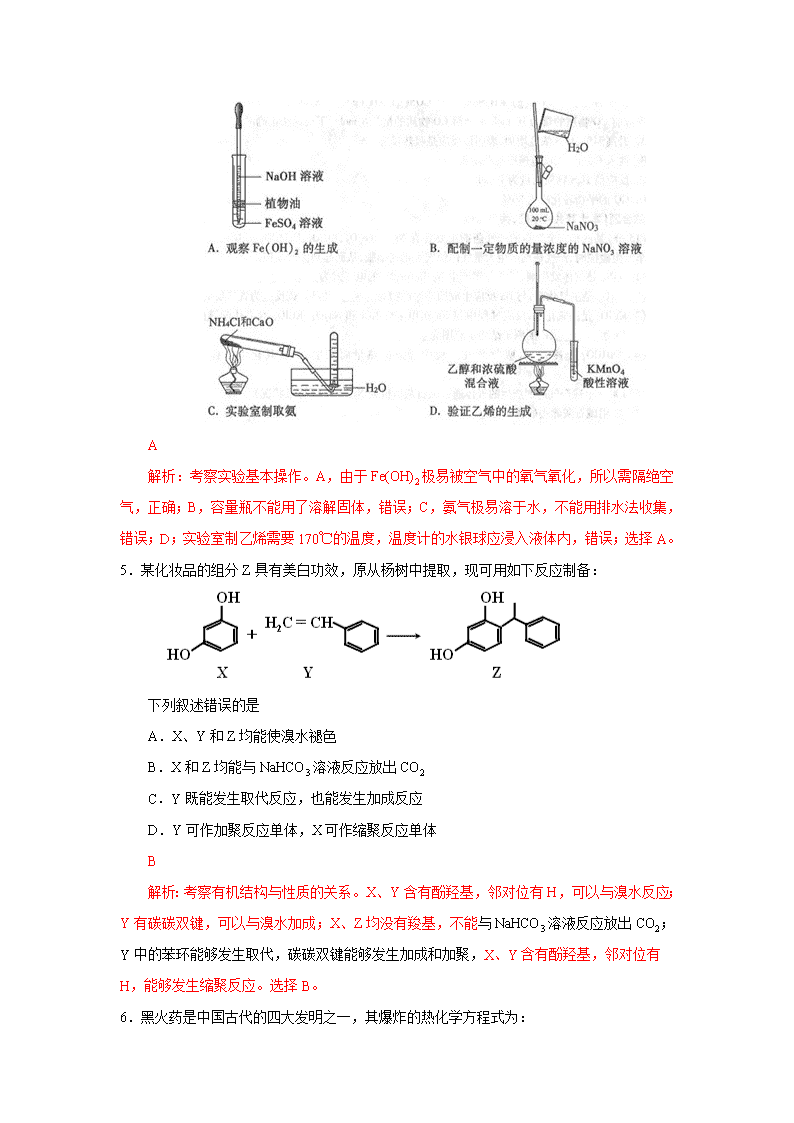
2015年高考重庆理综化学试题解析 1.中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是 A.用胆矾炼铜 B.用铁矿石炼铁 C.烧结粘土制陶瓷 D.打磨磁石制指南针 D 解析:考察化学变化与物理变化的概念。打磨磁石制指南针,没有新物质生成,是物理变化。选择D。 2.下列说法正确的是 A.I的原子半径大于Br,HI比HBr的热稳定性强 B.P的非金属性强于Si,H3PO4比H2SiO3的酸性强 C.Al2O3和MgO均可与NaOH溶液反应 D.SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 B 解析:考察元素周期律与元素及其化合物知识。A,稳定性:HBr>HI;B,P、Si同周期,酸性:H3PO4>H2SiO3;C,MgO不与NaOH溶液反应;D,考虑,硝酸氧化二氧化硫,只产生BaSO4沉淀。选择B。 3.下列说法正确的是 A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 B.25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 C.25℃时,0.1mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 D.0. 1mol AgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) C 解析:考察离子平衡。A,醋酸属于弱酸,加入少量醋酸钠抑制了醋酸的电离,错误;B,恰好反应生成硝酸铵,属于强酸弱碱盐,溶液PH<7,错误;C,硫化氢属于弱酸,硫化钠属于强电解质,等浓度的硫化氢溶液比等浓度的硫化钠溶液中离子浓度小,导电能力弱,正确;D,AgCl和AgI的Ksp不相等,c(Cl-)不等于c(I-),错误;选择C。 4.下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是 A 解析:考察实验基本操作。A,由于Fe(OH)2极易被空气中的氧气氧化,所以需隔绝空气,正确;B,容量瓶不能用了溶解固体,错误;C,氨气极易溶于水,不能用排水法收集,错误;D;实验室制乙烯需要170℃的温度,温度计的水银球应浸入液体内,错误;选择A。 5.某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备: 下列叙述错误的是 A.X、Y和Z均能使溴水褪色 B.X和Z均能与NaHCO3溶液反应放出CO2 C.Y既能发生取代反应,也能发生加成反应 D.Y可作加聚反应单体,X可作缩聚反应单体 B 解析:考察有机结构与性质的关系。X、Y含有酚羟基,邻对位有H,可以与溴水反应;Y有碳碳双键,可以与溴水加成;X、Z均没有羧基,不能与NaHCO3溶液反应放出CO2;Y中的苯环能够发生取代,碳碳双键能够发生加成和加聚,X、Y含有酚羟基,邻对位有H,能够发生缩聚反应。选择B。 6.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为: S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) ΔH= x kJ·mol-1 已知碳的燃烧热ΔH1= a kJ·mol-1 S(s)+2K(s)==K2S(s) ΔH2= b kJ·mol-1 2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH3= c kJ·mol-1 则x为 A.3a+b-c B.c +3a-b C.a+b-c D.c+a-b A 解析:考察盖斯定律。根据盖斯定律,利用原子守恒原理,ΔH=3ΔH1+ΔH2-ΔH3,可得x=3a+b-c,选择A。 7.羰基硫(COS)可作为一种××熏蒸剂,能防止某些昆虫、线虫和××的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g)COS(g)+H2(g) K=0.1。反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是 A.升高温度,H2S浓度增加,表明该反应是吸热反应 B.通入CO后,正反应速率逐渐增大 C.反应前H2S物质的量为7mol D.CO的平衡转化率为80% C 解析:考察化学平衡知识。A.,升高温度,H2S浓度增加,说明平衡逆向移动,则该反应是放热反应,错误;B,通入CO后,正反应速率瞬间增大,又逐渐减小,错误;C.,根据CO(g)+H2S(g)COS(g)+H2(g) ,CO的改变量为2,设H2S的起始量为X,K==0.1,X=7;D,α(CO)=×100%=20%.选择C。 8.(15分)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。 (1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为 (2)Fe2O3是氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应). (3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O,KClO4含有化学键的类型为 ,K的原子结构示意图为 。 (4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 。 (5)100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况)。 用碱石灰除去的物质为 ; ②该产气药剂中NaN3的质量分数为 。 解析:以汽车安全气囊涉及的物质为背景考察基本概念。氮气含有氮氮三键,电子式为 ;根据置换反应,Fe2O3是氧化剂,含还原产物是Fe;KClO4中含有K+与ClO4-的离子键,Cl与O的极性键;K原子的电子层结构为2、8、8、1;碳酸氢钠的分解反应为 2NaHCO3 Na2CO3 +CO2↑+H2O;碱石灰吸收的物质有CO2 、H2O;根据2NaN3~3N2,ω(NaN3)=×100%=65%。 参考答案: (1) 2 8 8 1 +19 (2)Fe (3)离子键和共价键 (4)2NaHCO3 Na2CO3 +CO2↑+H2O (5)①CO2 、H2O ② 65% 9.(15分)ClO2与Cl2的氧化性相近。在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过题9图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。 (1)仪器D的名称是 。安装F中导管时,应选用题9图2中的 。 (2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。 为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜 (填“快”或“慢”)。 (3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是 。 (4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2 ,该反应的离子方程式为 ,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 。 (5)已吸收ClO2气体的稳定剂Ⅰ和Ⅱ,加酸后释放ClO2的浓度随时间的变化如题9图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是,原因是 。 解析:考察实验方案设计。A、B是制备氯气和二氧化氯的;C是用于吸收氯气的;D是用于吸收二氧化氯的,E是用于重新释放二氧化氯的,F是用于验证二氧化氯的,F中的颜色不变,从而验证C的作用是吸收氯气。 (1)仪器D是锥形瓶;F装置应是Cl2和KI反应,所以应长管进气,短管出气,选b。 (2)为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度要慢。 (3)F装置中Cl2+2KI=2KCl+I2,碘遇淀粉变蓝,所以F中溶液的颜色不变,则装置C的作用是吸收Cl2。 (4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成. (5) 稳定剂Ⅱ可以缓慢释放ClO2 ,能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ好。 参考答案: (1)锥形瓶; b; (2)慢 (3)吸收Cl2 (4)4H++5ClO2-=Cl-+4ClO2↑+2H2O;验证是否有ClO2 生成; (5)稳定剂Ⅱ,稳定剂Ⅱ可以缓慢释放ClO2 ,能较长时间维持保鲜所需的浓度 10.(14分)某“化学鸡尾酒”通过模拟臭虫散发的聚集信息素可高效诱捕臭虫,其中一种组分T可通过下列反应路线合成(部分反应条件略)。 (1)A的化学名称是 ,A→B新生成的官能团是 ; (2)D的核磁共振氢谱显示峰的组数为 。 (3)D→E的化学方程式为 。 (4)G与新制的Cu(OH)2发生反应,所得有机物的结构简式为 。 (5)L可由B与H2发生加成反应而得,已知R1CH2Br+NaC≡CR2→R1CH2C≡CR2,则M得结构简式为 。 (6)已知R3C≡CR4,则T的结构简式为 。 解析:考察有机合成。(1)A为丙烯;在光照条件下,丙烯与Br2发生取代反应,—CH3→—CH2Br,新生成的官能团是—Br;(2)B→D,是碳碳双键与溴的加成反应,D分子中有两种不同环境的氢原子,核磁共振氢谱显示峰的组数为2;(3)D→E是卤代烃的消去反应,CH3BrCHBrCH2Br+2NaOHHC≡CCH2Br+2NaBr+2H2O。(4)E水解变成 HC≡CCH2OH,在一定条件下氧化变成HC≡CCHO,G是HC≡CCHO,与新制备氢氧化铜生成HC≡CCOONa。(5)G→J是HC≡CCOONa发生取代生成NaC≡CCOONa,根据M的分子式C6H8O,结合反应信息,L是CH3CH2CH2Br,M是CH3CH2CH2C≡CCHO;(6)再根据反应信息,T应该是反式CH3CH2CH2CH=CHCHO。 参考答案: (1)丙烯; —Br ; (2) 2 (3)CH3BrCHBrCH2Br+2NaOHHC≡CCH2Br+2NaBr+2H2O (4)HC≡CCOONa C=C H H CH3CH2CH2 CHO (5)CH3CH2CH2C≡CCHO (6) 11.(14分)我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义。 (1)原子序数为29的铜元素位于元素周期表中第 周期。 (2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子数目之比为 。 (3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是 。 A.降低了反应的活化能 B.增大了反应的速率 C.降低了反应的焓变 D.增大了反应的平衡常数 (4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为 。 (5)题11图为青铜器在潮湿环境中发生的电化学腐蚀的示意图。 ①腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”; ②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈Cu2(OH)3Cl,其离子方程式为 ; ③若生成4.29gCu2(OH)3Cl,则理论上耗氧体积为 L(标准状况)。 解析:以Cu及其化合物考察元素周期表、化学计算、平衡原理、反应原理和电化学腐蚀的知识。(1)Cu位于元素周期表第四周期;(2)根据Sn、Pb的相对原子质量,N(Sn):N(Pb)=:=10:1;(3)根据催化作用的本质,催化剂可以降低了反应的活化能,增大了反应的速率,△H不变,K不变,选择AB;(4)Ag2O与CuCl发生复分解反应: Ag2O +2CuCl=2AgCl+Cu2O; (5)在青铜的腐蚀中,青铜是负极,是c;负极反应式 Cu-2e-===Cu2+,负极产物是Cu2+;正极反应式:O2+2H2O+4e-===4OH-,正极产物是OH-,彼此反应2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;根据电子守恒原理:Cu2(OH)3Cl~O2, V(O2)=×22.4=0.448L。 参考答案: (1)四 (2)10:1 (3)A、B (4)Ag2O +2CuCl=2AgCl+Cu2O (5)① c ② 2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ ③0.448查看更多