- 2021-04-25 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021版化学名师讲练大一轮复习鲁科新高考地区专用版题组训练过关:第5章 考点3 5-4晶体结构与性质
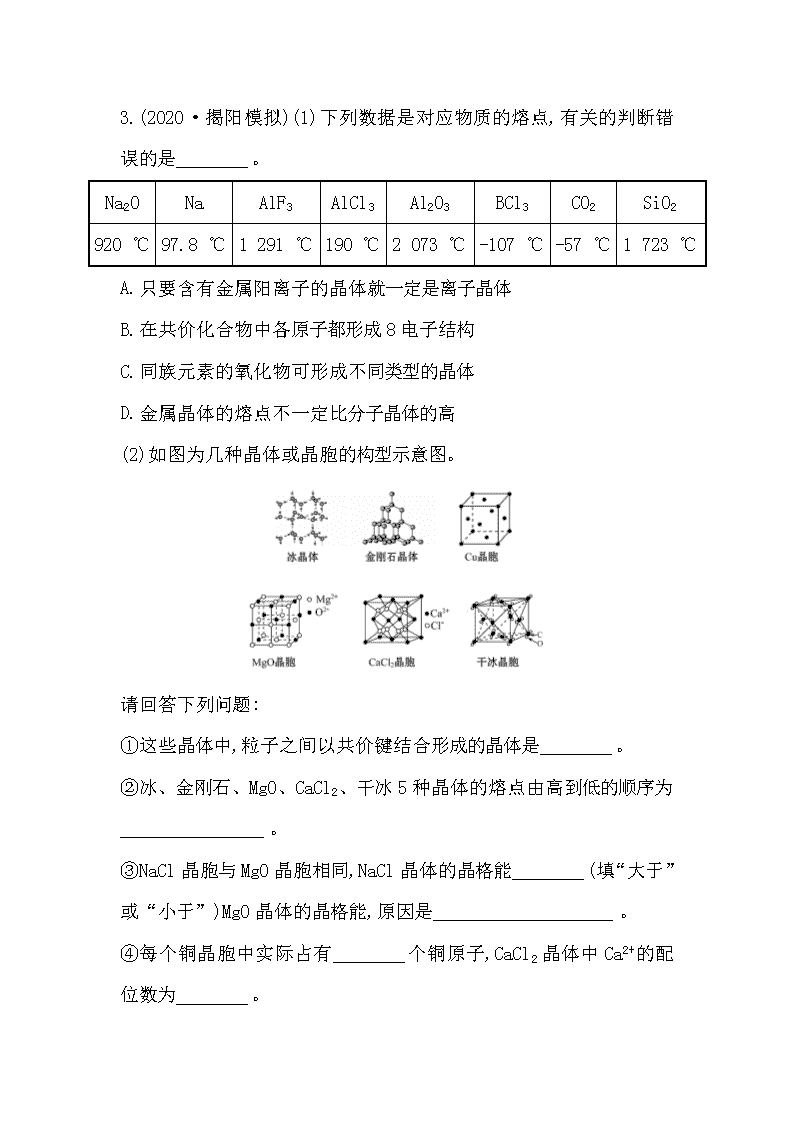
温馨提示: 此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。关闭Word文档返回原板块。 题组训练过关 常见的晶体结构 1.高温下,超氧化钾晶体结构与NaCl的相似,其晶体结构的一个基本重复单元如图所示,已知晶体中氧的化合价可看作部分为0,部分为-2。下列说法正确的是 ( ) A.晶体中每个K+周围有8个,每个周围有8个K+ B.超氧化钾的化学式为KO2,每个晶胞中含有4个K+和4个 C.晶体中与每个K+距离最近的K+有8个 D.晶体中,0价氧原子与-2价氧原子的数目比为2∶1 【解析】选B。由晶胞图可知1个K+周围有6个,同样1个周围有6个K+,A选项错误;根据切割法,每个晶胞中有8×+6×=4个K+、1+12×=4个,所以超氧化钾晶体中两种离子的个数比为1∶1,其化学式为KO2,B选项正确;根据晶胞结构可知,每个K+所在的3个相互垂直的面上各有4个K+与该K+距离最近且相等,即晶体中与每个 K+距离最近的K+有12个,C选项错误;中O的平均化合价为-0.5,所以若有1个-2价氧原子,则应有3个0价氧原子,故0价氧原子与-2价氧原子的数目比为3∶1,D选项错误。 2.(改编)(1)如图为固态CO2的晶体结构示意图,通过观察分析,可得出每个CO2分子周围有 ________________个等距离且最近的CO2分子。 (2)①SiO2 ②CO2 ③CS2晶体的熔点由高到低排列的顺序是________(填序号)。 (3)在一定温度下,用X-射线衍射法测得干冰晶胞的边长a=5.72×10-8 cm,则该温度下干冰的密度为__________________________________。 【解析】(1)观察固态CO2晶体结构示意图,以某个CO2分子为中心,在三维空间中找出与之等距离且最近的CO2分子。如以立方体的顶点为例,与之等距离且最近的CO2分子应为其所在平面面心的CO2分子,向三维空间延伸共有12个。(3)利用均摊法计算每个晶胞中平均拥有CO2分子的数目为8×+6×=4,根据密度的定义得ρ=≈1.56 g·cm-3。 答案:(1)12 (2)①>③>② (3)1.56 g·cm-3 3.(2020·揭阳模拟)(1)下列数据是对应物质的熔点,有关的判断错误的是________。 Na2O Na AlF3 AlCl3 Al2O3 BCl3 CO2 SiO2 920 ℃ 97.8 ℃ 1 291 ℃ 190 ℃ 2 073 ℃ -107 ℃ -57 ℃ 1 723 ℃ A.只要含有金属阳离子的晶体就一定是离子晶体 B.在共价化合物中各原子都形成8电子结构 C.同族元素的氧化物可形成不同类型的晶体 D.金属晶体的熔点不一定比分子晶体的高 (2)如图为几种晶体或晶胞的构型示意图。 请回答下列问题: ①这些晶体中,粒子之间以共价键结合形成的晶体是________。 ②冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为________________。 ③NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体的晶格能,原因是____________________。 ④每个铜晶胞中实际占有________个铜原子,CaCl2晶体中Ca2+的配位数为________。 ⑤冰的熔点远高于干冰,除因为H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是 ____________________________________________。 【解析】(1)A项含有金属阳离子的可能为金属晶体;B项共价化合物中各原子不一定都形成8电子结构,如BCl3。 (2)①分析各种物质的晶胞发现以共价键结合的晶体为金刚石晶体。②结合不同晶体的熔点特点及氢键的知识确定熔点高低顺序为金刚石、氧化镁、氯化钙、冰、干冰。④分析铜晶胞的特点,顶点的铜原子为8×1/8=1,位于面上的Cu为6×1/2=3,所以实际占有4个铜原子。 答案:(1)A、B (2)①金刚石晶体 ②金刚石、氧化镁、氯化钙、冰、干冰 ③小于 镁离子和氧离子电荷数大于钠离子和氯离子,并且离子半径氧比氯小,镁比钠小 ④4 8 ⑤冰在晶态时存在氢键,而干冰没有 【加固训练】 1.如图所示是从NaCl或CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是 ( ) A.(1)和(3) B.(2)和(3) C.(1)和(4) D.只有(4) 【解析】选C。NaCl晶胞是立方体结构,每个Na+周围有6个Cl-,每个Cl-周围有6个Na+;与每个Na+等距离的Cl-有6个,且构成正八面体,同理,与每个Cl-等距离的6个Na+也构成正八面体,由此可知图(1)和(4)属于从NaCl晶体中分割出来的,C项正确。 2.如图为冰晶体的结构模型,大球代表O,小球代表H。下列有关说法正确的是 ( ) A.冰晶体中每个水分子与另外4个水分子形成四面体 B.冰晶体具有空间网状结构,是原子晶体 C.水分子间通过H—O键形成冰晶体 D.冰融化后,水分子之间空隙增大 【解析】选A。冰晶体是分子晶体,冰晶体中的水分子是靠氢键结合在一起,氢键不是化学键,而是一种分子间作用力,B、C项错误。水分子形成氢键时沿O的4个sp3杂化轨道形成氢键,每个水分子可以与4个水分子形成氢键,从而形成空间四面体构型,A项正确。因为冰晶体中形成的氢键具有方向性和饱和性,故水分子靠氢键连接后,分子间空隙变大,因此冰融化成液态水后,体积减小,水分子之间空隙减小,D项错误。 3.AB型物质形成的晶体多种多样, 下列图示的几种结构中最有可能是分子晶体的是 ( ) A.①②③④ B.②③⑤⑥ C.②③ D.①④⑤⑥ 【解析】选C。①④⑤⑥构成的晶体为在一维、二维或三维空间结构,且在空间中微粒通过化学键连接,故它们不可能是分子晶体;而②③都不能再以化学键与其他原子结合,故为分子晶体。 4.金刚石、石墨、C60和石墨烯的结构示意图分别如图所示,下列说法不正确的是 ( ) A.金刚石和石墨烯中碳原子的杂化方式不同 B.金刚石、石墨、C60和石墨烯的关系:互为同素异形体 C.这四种物质完全燃烧后的产物都是CO2 D.石墨与C60的晶体类型相同 【解析】选D。金刚石中碳原子为sp3杂化,石墨烯中碳原子为sp2杂化,A项正确;金刚石、石墨、C60和石墨烯都是碳元素形成的不同单质,它们互为同素异形体,B项正确; 碳元素的同素异形体完全燃烧的产物都是CO2,C项正确;C60是分子晶体,石墨是混合晶体,D项错误。 关闭Word文档返回原板块查看更多