- 2021-04-19 发布 |
- 37.5 KB |
- 6页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学安徽卷答案及解析
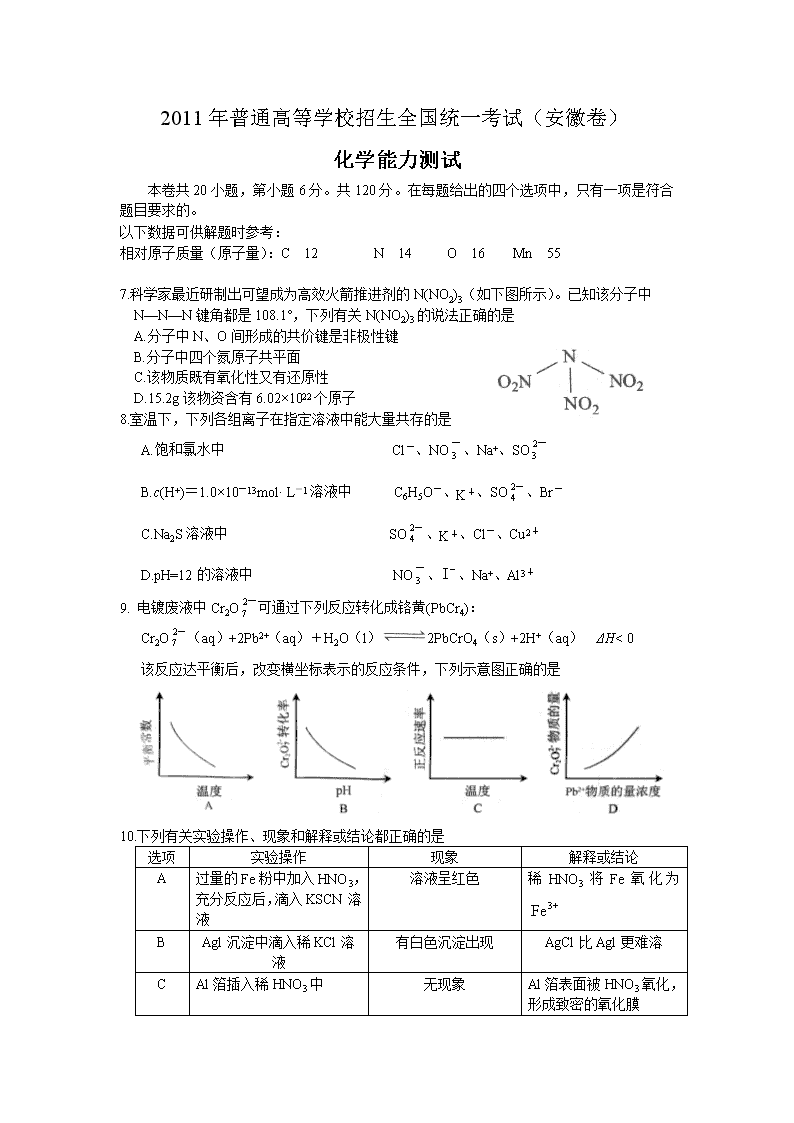
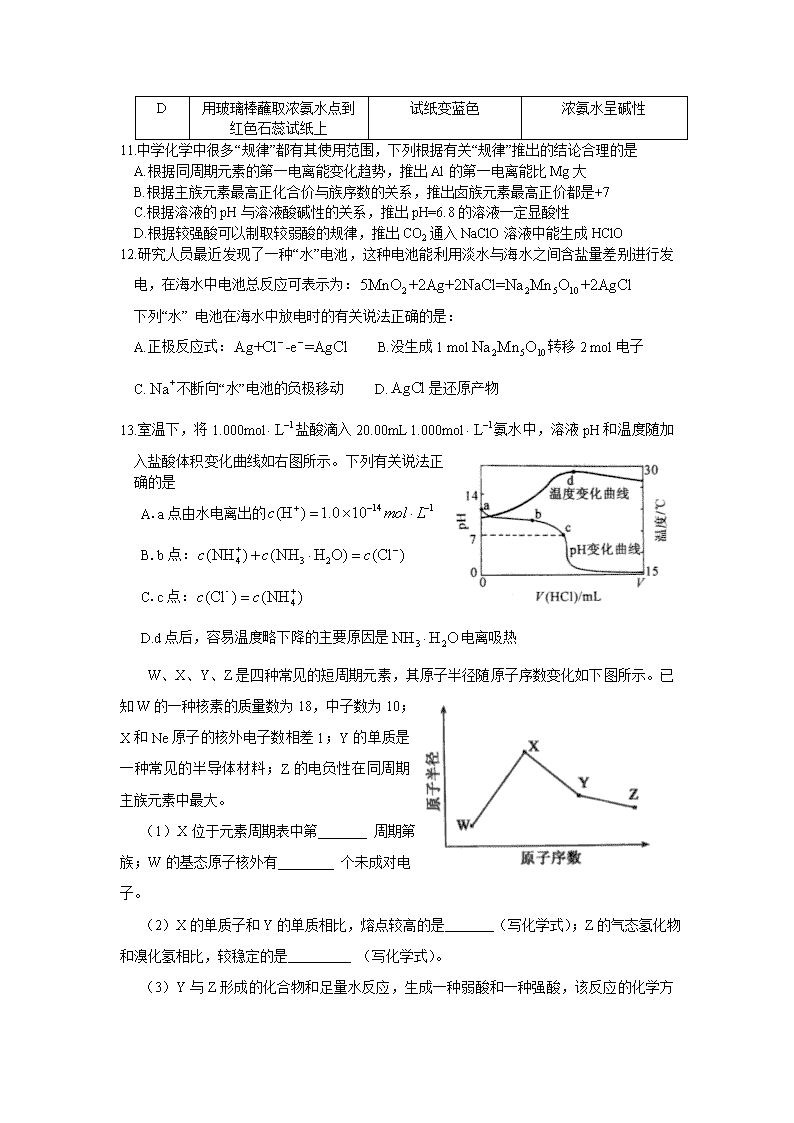
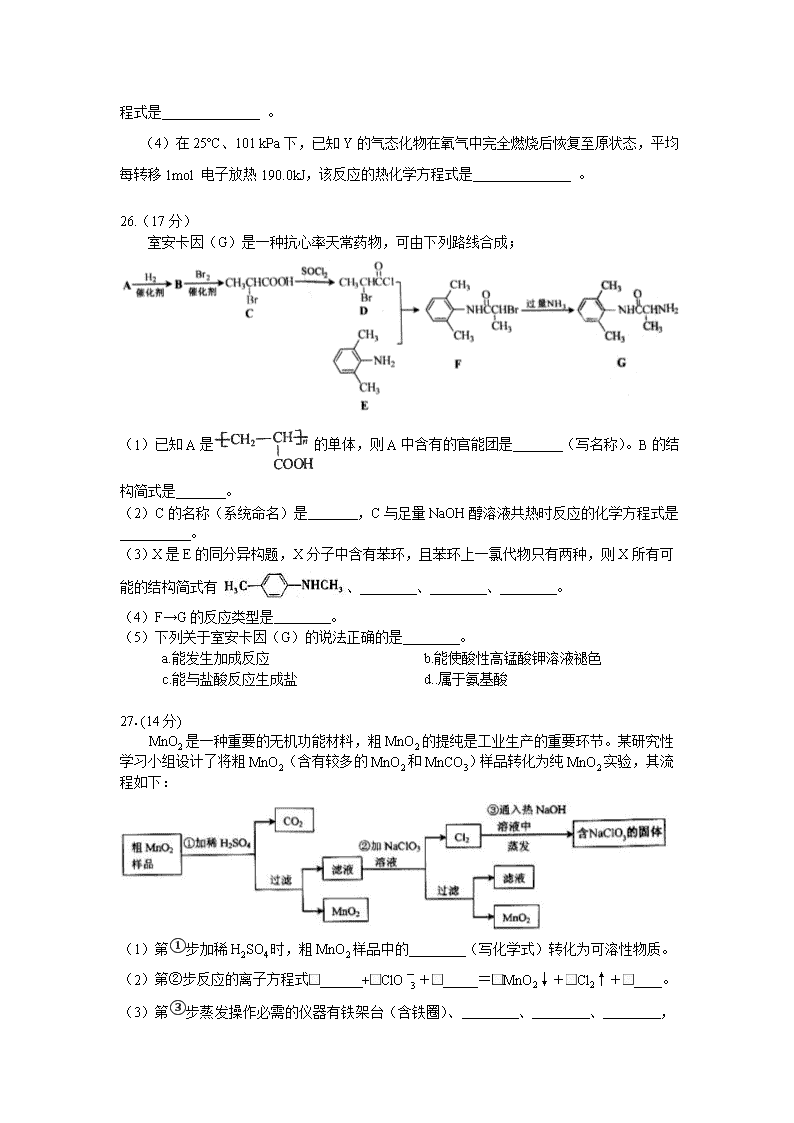
2011年普通高等学校招生全国统一考试(安徽卷) 化学能力测试 本卷共20小题,第小题6分。共120分。在每题给出的四个选项中,只有一项是符合题目要求的。 以下数据可供解题时参考: 相对原子质量(原子量):C 12 N 14 O 16 Mn 55 7.科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中 N—N—N键角都是108.1°,下列有关N(NO2)3的说法正确的是 A.分子中N、O间形成的共价键是非极性键 B.分子中四个氮原子共平面 C.该物质既有氧化性又有还原性 D.15.2g该物资含有6.02×1022个原子 8.室温下,下列各组离子在指定溶液中能大量共存的是 A.饱和氯水中 Cl-、NO、Na+、SO B.c(H+)=1.0×10-13mol· L-1溶液中 C6H5O-、K+、SO、Br- C.Na2S溶液中 SO、K+、Cl-、Cu2+ D.pH=12的溶液中 NO、、Na+、Al3+ 9. 电镀废液中Cr2O可通过下列反应转化成铬黄(PbCr4): Cr2O(aq)+2Pb2+(aq)+H2O(l)2PbCrO4(s)+2H+(aq) ΔH< 0 该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是 10.下列有关实验操作、现象和解释或结论都正确的是 选项 实验操作 现象 解释或结论 A 过量的Fe粉中加入HNO3, 充分反应后,滴入KSCN溶液 溶液呈红色 稀HNO3将Fe氧化为 B Agl沉淀中滴入稀KCl溶液 有白色沉淀出现 AgCl比Agl更难溶 C Al箔插入稀HNO3中 无现象 Al箔 表面被HNO3氧化,形成致密的氧化膜 D 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 试纸变蓝色 浓氨水呈碱性 11.中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是 A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO 12.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为: 下列“水” 电池在海水中放电时的有关说法正确的是: A.正极反应式: B.没生成1 mol转移2 mol电子 C.不断向“水”电池的负极移动 D.是还原产物 13.室温下,将1.000mol盐酸滴入20.00mL 1.000mol氨水中,溶液pH和温度随加 入盐酸体积变化曲线如右图所示。下列有关说法正确的是 A.a点由水电离出的 B.b点: C.c点: D.d点后,容易温度略下降的主要原因是电离吸热 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。 (1)X位于元素周期表中第 周期第 族;W的基态原子核外有 个未成对电子。 (2)X的单质子和Y的单质相比,熔点较高的是 (写化学式);Z的气态氢化物和溴化氢相比,较稳定的是 (写化学式)。 (3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是 。 (4)在25ºC、101 kPa下,已知Y的气态化物在氧气中完全燃烧后恢复至原状态,平均每转移1mol 电子放热190.0kJ,该反应的热化学方程式是 。 26.(17分) 室安卡因(G)是一种抗心率天常药物,可由下列路线合成; (1)已知A是的单体,则A中含有的官能团是 (写名称)。B的结构简式是 。 (2)C的名称(系统命名)是 ,C与足量NaOH醇溶液共热时反应的化学方程式是 。 (3)X是E的同分异构题,X分子中含有苯环,且苯环上一氯代物只有两种,则X所有可能的结构简式有、 、 、 。 (4)F→G的反应类型是 。 (5)下列关于室安卡因(G)的说法正确的是 。 a.能发生加成反应 b.能使酸性高锰酸钾溶液褪色 c.能与盐酸反应生成盐 d..属于氨基酸 27.(14分) MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO2和MnCO3)样品转化为纯MnO2实验,其流程如下: (1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。 (2)第②步反应的离子方程式 +ClO+ =MnO2↓+Cl2↑+ 。 (3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 、 、 ,已知蒸发得到的固体中有NaClO3和NaOH,则一定还有含有 (写化学式)。 (4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7gMnO2,并收集到0.224 L CO2(标准状况下),则在第②步反应中至少需要 mol NaClO3。 28.((13分) 地下水中硝酸盐造成的氮污染已成为一个世界性的环节问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。 (1)实验前:①先用0.1mol·L-1H2SO4洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入 (写化学式)。 (2)右图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式 。t1时刻后,该反应仍在进行,溶液中NH的浓度在增大,Fe2+的浓度却没有增大,可能的原因是 。 (3)改课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三: 假设一:溶液的pH; 假设二: ; 假设二: ; …… (4)请你设计实验验证上述假设一,写出实验步骤及结论。 (已知:溶液中的NO浓度可用离子色谱仪测定) 实验步骤及结论 2011年普通高等学校招生全国统一考试(安徽卷) 6. 答案:B 解析:考查群落的结构演替以及人类活动对群落演替的影响。B选项不正确,发生于火山,冰川泥,以及沙丘的演替是初生演替。此演替已到了森林阶段所以一定是很长时间,人类的活动会使演替不同于自然演替的方向和速度,不同地段上的差异属于水平结构,空间上的垂直分布属于垂直结构。 7. 答案:C 解析:本题考查分子结构、氧化还原反应以及阿伏伽德罗常数等知识。A错在N—O键为极性键;N(NO2)3的结构应与氨气相同。因此分子中四个氮原子共平面不共平面,B错;该分子中的氮既有+3也有+5价,+3的氮既有氧化性又有还原性,C正确;D选项物质为0.1mol,因此所含原子数为1N0,即6.02×1023个,因此D错。 8. 答案:B 解析:本题考查氧化还原反应以及离子反应等知识。 A氯水会氧化;B在碱性环境下各离子可以共存;C选项会生成CuS沉淀;D选项不能存在于碱性环境。 9. 答案:A 解析:本题考查外界条件的变化对平衡移动的影响等相关知识。 对于放热反应升温平衡常数减小,A正确;增大pH平衡右移转化率应该增大,B错;温度升高平衡不能往哪个方向移动,正逆反应速率均增大,C错;增加会提高转化率,的物质的量应该减小。 10. 答案:D 解析:本题综合考查化学实验以及元素化合物的相关知识。 A选项,铁粉过量应该生成,不会有红色出现;B选项AgCl溶解度比Agl大;C选项Al箔插入浓中才会形成致密的氧化膜钝化。 11. 答案:D 解析:本题综合考查化学反应原理中的共性与特性。 A应考虑到IIA族第一电离能反常;B应考虑到F无正价;C应考虑到常温下pH<7溶液才为酸性。 12. 答案:D 解析:本题综合考查原电池和氧化还原反应的相关知识。 正极反应该得电子,因此A错;原电池中电解质溶液中的阳离子应该向正极移动,C错;Ag是反应的还原剂,因此AgCl是氧化产物,D错。 13. 答案:C 解析:本题综合考查水溶液中的电离平衡以及酸碱中和滴定的相关知识。 a点7查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档