- 2021-04-17 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学专题复习质量守恒定律及其应用
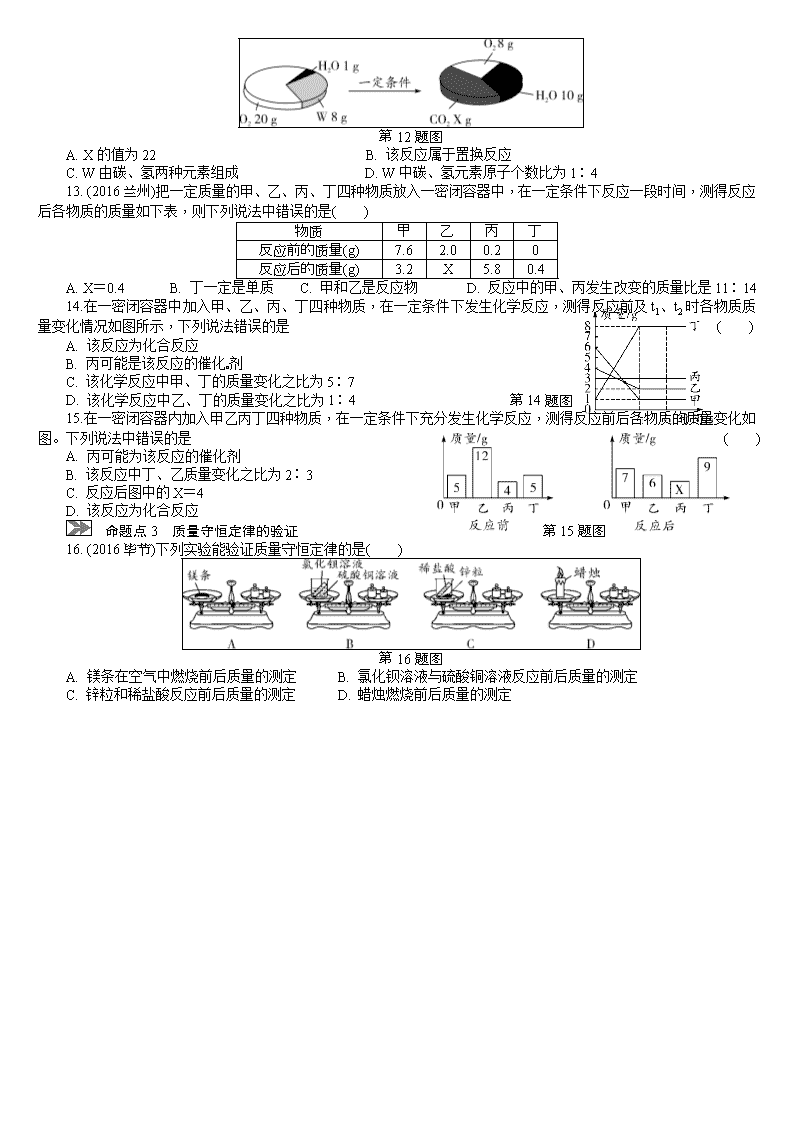
初三化学专题复习 质量守恒定律及其应用 命题点分类集训 命题点1 质量守恒定律的理解 1.科研人员研发出一种能将二氧化碳转化为甲烷的新技术。该技术以纳米镍粒子为催化剂,将二氧化碳和氢气混合加热发生发应,生成甲烷等物质,从而减少碳排放。该反应前后发生变化的是 ( ) A. 元素的种类 B. 碳原子的数目 C. 氢元素的化合价 D. 纳米镍粒子的化学性质 2.关于质量守恒定律的理解,错误的是 ( ) A. 宏观:实际参加反应的反应物总质量等于生成物总质量 B. 微观:反应前后原子种类和个数不变 C. X+3H2O=== 2H3PO4中的X为P2O5 D. 煤燃烧后灰渣质量小于煤,不能用质量守恒定律解释 命题点2 质量守恒定律的应用 考向1 化学式或化学计量数的推断 3. “气体烙铁”是一种以气体X为燃料的加热仪器,加热温度可达1 300 ℃,反应的化学方程式为2X+13O2 8CO2+10H2O。燃料X的化学式为 ( ) A. C3H8 B. C4H10 C. CH3OH D. C2H5OH 4.某物质在空气中燃烧的化学方程式为:C2H5OH+______O2 2CO2+3H2O,在“______”中填上的数字是 A. 1 B. 2 C. 3 D. 4 ( ) 5. AgNO3固体见光或受热易分解,故保存在棕色瓶中。AgNO3见光分解时会产生一种有刺激性气味的气体,该气体可能是 ( ) A. SO2 B. NH3 C. N2 D. NO2 6.偏二甲肼(C2H8N2)与N2O4反应放出的能量能把火箭送入太空,该化学方程式为:C2H8N2+2N2O4=== 2X↑+3N2↑+4H2O↑。下列说法正确的是 ( ) A. X的化学式为CO B. 偏二甲肼中碳的质量分数为40% C. 该反应属于分解反应 D. 生成N2和H2O的质量比为14∶9 7.程浩同学查阅资料得知:Cu与稀硫酸不反应,但Cu可与浓硫酸在加热的条件下反应,化学方程式为:Cu+2H2SO4(浓) CuSO4+SO2↑+2R,下列说法中不正确的是 ( ) A. 该反应中涉及了3种类型的化合物 B. R为相对分子质量最小的氧化物 C. 反应前后,H2SO4中硫的化合价全部发生了改变 D. 该反应不属于四种基本反应类型中的任何一种 考向2 物质元素组成的推断 8.某化学反应可表示为:二氧化碳+水―→M+氧气。根据以上信息,下列关于M组成的说法中正确的是( ) A. 一定含有C、H元素,可能含有O元素 B. 只含有C、H元素 C. 含有C、H、O三种元素 D. 无法确定 9.现有32 g某可燃物在密闭容器中完全燃烧后,测得生成88 g二氧化碳和72 g水,关于该可燃物的说法正确的是 A. 一定是氧化物 B. 只含有碳、氢两种元素 ( ) C. 一定含有碳、氢、氧三种元素 D. 一定含有碳、氢元素,可能含有氧元素 考向3 微观反应示意图 10.如图是四种物质a、b、c、d在化学反应过程中的微观示意图,下列说法中正确的是 ( ) 第10题图 A. 生成物中c与d的分子个数比为1∶2 B. 反应不符合质量守恒定律 C. 反应前后原子的种类改变 D. 物质c可能是一氧化碳 11.某个化学反应的微观示意图如图。有关说法正确的是 ( ) [来源:学.科.网Z.X.X.K] 第11题图 A. 该反应为分解反应 B. 该反应的化学方程式为:H2+Cl2 2HCl C. 该反应前后分子种类未发生变化 D. 该反应不遵守质量守恒定律 考向4 数据分析 12.一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如图所示。下列说法正确的是( ) 第12题图 A. X的值为22 B. 该反应属于置换反应 C. W由碳、氢两种元素组成 D. W中碳、氢元素原子个数比为1∶4 13. (2016兰州)把一定质量的甲、乙、丙、丁四种物质放入一密闭容器中,在一定条件下反应一段时间,测得反应后各物质的质量如下表,则下列说法中错误的是( ) 物质 甲 乙 丙 丁 反应前的质量(g) 7.6 2.0 0.2 0 反应后的质量(g) 3.2 X 5.8 0.4 A. X=0.4 B. 丁一定是单质[来源:Z#xx# k.ComC. 甲和乙是反应物 D. 反应中的甲、丙发生改变的质量比是11∶14 14.在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量变化情况如图所示,下列说法错误的是 ( ) A. 该反应为化合反应 B. 丙可能是该反应的催化剂 C. 该化学反应中甲、丁的质量变化之比为5∶7 D. 该化学反应中乙、丁的质量变化之比为1∶4 第14题图 15.在一密闭容器内加入甲乙丙丁四种物质,在一定条件下充分发生化学反应,测得反应前后各物质的质量变化如图。下列说法中错误的是 ( ) A. 丙可能为该反应的催化剂 B. 该反应中丁、乙质量变化之比为2∶3 C. 反应后图中的X=4 D. 该反应为化合反应 命题点3 质量守恒定律的验证 第15题图 16. (2016毕节)下列实验能验证质量守恒定律的是( ) 第16题图 A. 镁条在空气中燃烧前后质量的测定 B. 氯化钡溶液与硫酸铜溶液反应前后质量的测定 C. 锌粒和稀盐酸反应前后质量的测定 D. 蜡烛燃烧前后质量的测定 中考冲刺集训 [来源:学科网ZXXK] (时间:40分钟 满分:40分) 一、选择题(本题包括8小题,每小题2分,共16分) 1.用下列装置来验证质量守恒定律(托盘天平未画出),能达到目的的是 ( ) 2.在反应C+H2O CO+H2中,若生成物的总质量为15 g,则参加反应的水的质量为 ( ) A. 9 g B. 12 g C. 14 g D. 15 g 3.如图为某化学反应的微观过程,两个甲分子反应生成二个乙分子和一个丙分子,则从图示获得的信息中,正确的是 ( ) A. 该反应的生成物乙属于单质 B. 该反应中反应物不可能是氧化物 C. 该反应的基本类型属于复分解反应 D. 该反应反应前后各元素的化合价均不变 第3题图 4.某纯净物X在空气中完全燃烧,反应的化学方程式为:X+2O 2 CO2+2H2O。下列关于X的说法正确的是 ( ) A. X由碳、氢、氧三种元素组成 B. X的相对分子质量为10 C. X中碳、氢元素的质量比为1∶4 D. X属于有机化合物 5. (2016常德)某有机物6.0 g在空气中完全燃烧,共得到17.6 g二氧化碳和10.8 g水,则该化合物的组成元素是( ) A. 一定只含有碳元素 B. 一定只含有碳、氢两种元素 C. 一定含有碳、氢、氧三种元素 D. 一定含有碳、氢元素,可能含有氧元素 6.在一密闭容器中,a、b、c、d四种物质在一定条件下发生化学反应,反应前后各物质质量变化如图,下列说法错误的是 ( ) A. 该反应是分解反应 B. b可能是催化剂 C. 反应前后物质的总质量保持不变 D. 反应生成的c和d质量相等 第6题图 7.活性炭可处理大气污染物NO,一定条件下的密闭容器中加入NO气体和活性炭,反应生成甲、乙气体,测得各物质的质量如下表所示。下列说法正确的是 ( ) 物质质量/g 反应时间/min 活性炭 NO 甲 乙 0 24.36 3 0[来源:学。科。网Z。X。X。K] 0 2 24 1.2 x 1.32 A. x的值为23.88 B. 反应中活性炭只起吸附作用 C. 反应中有元素化合价的升高和降低 D. 生成甲、乙气体的分子数之比为1∶2 8.三种物质在密闭容器中发生反应,反应前后质量比例的变化关系如图所示。下列说法正确的是 ( ) A.反应中CaO为催化剂 B.该反应是复分解反应 C.反应后容器中固体质量减少 D.反应后容器中氧元素质量分数增 第8题图 二、填空及简答题(本题包括4小题,共20分) 9. (6分)如图是氢气在氯气中燃烧生成氯化氢的微观模拟图,请回答下列问题: 第9题图 (1)在B图中将相关粒子图形补充完整; (2)此变化前后发生改变的粒子是____________________________________________。 (3)从微观角度解释此反应为化合反应的原因是____________________________。 10. (4分)2015年8月12日天津港发生爆炸后,消防专家确认,大约40种危化品中就有700吨剧毒氰化钠(NaCN)。 (1)氰化钠(NaCN)泄漏可用过氧化氢溶液进行高效处理,氰化钠、过氧化氢和水反应生成碳酸氢钠和氨气,其反应的化学方程式为____________________________________。 (2)氰化钠是工业上冶炼黄金的重要原料,工业上生产氰化钠的化学方程式为2Na+2X+2NH3=== 2NaCN+3H2。 ①X的化学式为________。 ②NH3中N元素的化合价为________。 11. (3分)(3)质量守恒定律是帮助我们学习和认识化学反应实质的重要理论。 ①下列表述正确的是________。 A. 蜡烛燃烧后质量减小,说明质量守恒定律不是普遍规律 B. 每32 g S和32 g O2完全反应后,生成64 g SO2 C. 在化学反应aA+bB=cC+dD中一定有:a+b=c+d ②有机化合物R与足量氧气置于密闭容器中充分反应生成CO2和H2O,实验测得反应前后物质的质量如下表: R O2 CO2 H2O 反应前质量/g 46 128 0 0 反应后质量/g 0 32 x 54 则x=________;已知参加反应的物质R与氧气的分子个数之比为1∶3,则R的相对分子质量是________。 12. (7分)I.质量守恒定律的发现对化学的发展做出了重要贡献。 (1)通过称量下列各组试剂在密闭容器内混合前后的总质量,能验证质量守恒定律的是________(填标号)。 A. 蔗糖和水 B. 氯化钠溶液和硝酸钾溶液 C. 铁和氯化铜溶液 (2)在氧气中点燃红磷的实验过程,固体质量变化如图1所示。 ①从燃烧条件分析,固体质量在t1前没有发生变化的原因为__________________________________。 ②该反应的化学方程式为____________________________。 ③参加反应的氧气质量为________g。 第12题图1 第12题图2 (3)某反应的微观示意图如图2所示: ①该反应所属的基本反应类型为________。②参加反应的甲物质和生成的丙物质分子数目比为________。 三、实验探究题(本题包括1小题,共4分) 13. (4分)同学们利用如图所示的装置,对质量守恒定律进行了探究。实验结束后,老师另外提出了几个问题,请你一起参与思考。 第13题图 (1)图甲装置内物质充分反应后,冷却至室温,气球仍胀大的是________(选填“A”、“B”或“A”和“B”)。 (2)若图乙装置内Na2CO3溶液的质量为5克,滴入试管的稀盐酸质量也是5克,装置内物质充分反应后,发现NaOH浓溶液质量增加0.22克,试管中滴入紫色石蕊试液变红。 根据上述已知条件,通过分析可以确定的是________(选填序号)。 ① 原稀盐酸的溶质质量分数 ②原Na2CO3溶液的溶质质量分数 ③原NaOH溶液的溶质质量分数 ④反应后试管中NaCl的溶质质量分数 专题 质量守恒定律及其应用 命题点分类集训 命题点1 质量守恒定律的理解 1. C 2. D 命题点2 质量守恒定律的应用 3. B 4. C 5. D 6. B 7. C 8. A 9. B 10. A 11. B 12. D 13. B 14. D 15. D 命题点3 质量守恒定律的验证 16. B 中考冲刺集训 1. D 2. A 3. A 4. D 5. B 6. D 7. C 8. C 9. (6分)(1)(2分) (2)氯分子和参加反应的氢分子(2分) (3)两种分子反应生成另一种分子(2分) 10. (4分)(1)NaCN+H2O2+H2O=== NaHCO3+NH3↑(2分) (2)①C(1分) ②-3(1分)[来源:Zxxk.Com] 11. (3分)(3)①B(1分) ②88(1分) 46(1分) 12. (7分)Ⅰ.(1)C(1分) (2)①温度未达到红磷的着火点(1分) ②4P+5O2 2P2O5(2分) ③ 8.0(1分) (3)①置换反应(1分) ②1∶2(1分) 13. (4分)(1)B(2分) (2)②④(2分)查看更多