- 2021-04-17 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学一轮复习教学案第21讲物质的组成、性质和分类
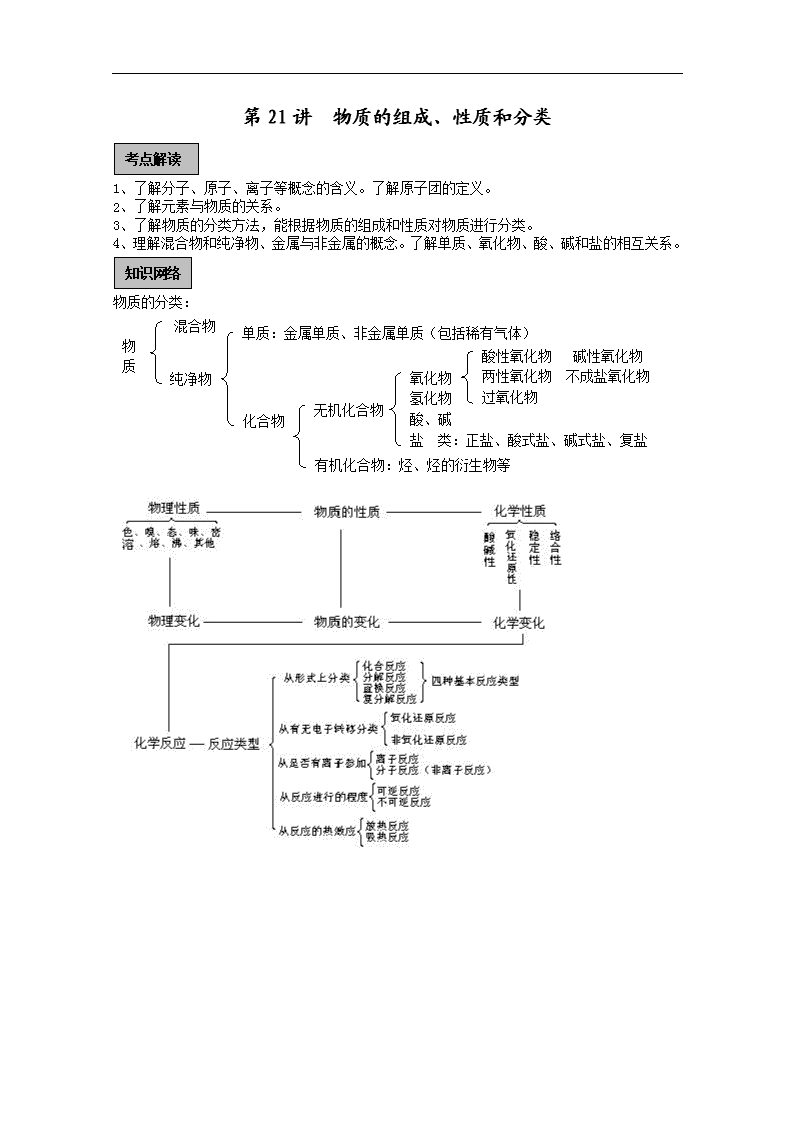
第21讲 物质的组成、性质和分类 考点解读 1、了解分子、原子、离子等概念的含义。了解原子团的定义。 2、了解元素与物质的关系。 3、了解物质的分类方法,能根据物质的组成和性质对物质进行分类。 4、理解混合物和纯净物、金属与非金属的概念。了解单质、氧化物、酸、碱和盐的相互关系。 知识网络 物质的分类: 物 质 单质:金属单质、非金属单质(包括稀有气体) 混合物 酸性氧化物 碱性氧化物 两性氧化物 不成盐氧化物 过氧化物 氧化物 氢化物 酸、碱 盐 类:正盐、酸式盐、碱式盐、复盐 纯净物 无机化合物 化合物 有机化合物:烃、烃的衍生物等 基础过关 第1课时 物质的组成 1.元素——宏观概念,说明物质的宏观组成。 元素是质子数相同的一类原子的统称。质子数相同的微粒不一定是同一种元素,因为微粒的含义要比原子广泛。 2.分子、原子、离子、“基”、 “根”、“碳正离子”——微观概念,说明物质的微观构成。 ★原子 (1)原子是化学变化中的最小粒子。确切地说,在化学反应中,原子核不变,只有核外电子发生变化。 (2)原子是组成某些物质(如金刚石、晶体硅等)和分子的基本粒子。 (3)原子是由更小的粒子构成的。 (4)原子的概念是古希腊哲学家德谟克利特从哲学的角度首先提出来的。1803年英国化学家道尔顿提出了原子说。目前人类对原子结构的认识正在不断地深入。 注意:化学反应的本质就是原子的重新排列和组合。 原子与元素的联系与区别 ★离子 离子是指带电荷的原子或原子团。 ①离子的种类: ②离子的生成途径: ③存在离子的物质:离子化合物:NaCl、CaC2、C17H35COONa;电解质溶液中:盐酸、稀硫酸等;金属晶体中:钠、铁、铜等。 注意:在金属晶体中只有阳离子,而没有阴离子。分子、原子、离子均是组成物质的基本粒子,是参加化学反应的基本单元,是化学研究的微观对象。 ★分子: 分子是能够独立存在并保持物质化学性质的一种粒子。完整理解分子的概念,应包括以下几个方面。 ①分子是一种粒子,它同原子、离子一样是构成物质的基本粒子。如:水、氧气、干冰、蔗糖等就是由分子组成的物质。②分子有质量,其数量级约为10—26kg。③分子间有间隔,并不断运动着。 ④同种分子的性质相同,不同种分子的性质不同。⑤每个分子一般是由一种或几种元素的若干原子按一定方式通过化学键结合而成的。 ⑥按组成分子的原子个数,可把分子分成 ⑦分子间存在相互作用,此作用称作分子间作用力(又称范德华力),它是一种较弱的作用力。 ★“基”、 “根”、“碳正离子” “基”是指分子中除去一个原子或原子团以后剩下的原子团(也可能是单个原子),它是电中性的,通常不能稳定存在,如—NO2硝基、—CH3甲基、—SO3H磺酸基等(注意磺酸基不能写成—HSO3)。 “根”是带电的原子团,能稳定存在,如“NO2—”亚硝酸根离子,“HSO3—”亚硫酸氢根离子,它们各带一个单位负电荷。“根”与“基”的区别在于是否带电荷。“根”与“基”的电子式也不同。如羟基—OH的电子式为 ,甲基的电子式为 ,而氢氧根OH-的电子式为 ,甲基正离子CH3的电子式为 。 3.核素——具有一定数目的质子和一定数目的中子的一种原子 同位素——具有相同质子数和不同中子数的原子互称为同位素 同素异形体——同种元素形成的结构不同的单质 典型例题 【例】(2010山东卷,9)和是氧元素的两种核素,表示阿伏伽德罗常数,下列说法正确的是 A.与互为同分异构体 B. 与核外电子排布方式不同 C.通过化学变化可以实现与间的相互转化 D.标准状况下,1.12L和1.12L均含有0.1个氧原子 解析:A中的物质是同一种物质,都是氧气,故A错;B中的两种氧原子的电子数相等,核外电子排布也相等,故B错;之间的转化,,是原子核的变化,不化学变化,故C错;1.12L标准状况下的物质的量为0.05mol,含有氧原子数为0.1,故D正确。 答案:D 第2课时 物质的分类 基础过关 1、物质的初步分类 2、纯净物和混和物 常见的混合物包括: ⑴高分子化合物(如蛋白质、淀粉、纤维素、聚合物等); ⑵分散系(包括溶液、胶体、浊液) ⑶同分异构间的混合体(如二甲苯总是混合物,含邻、间、对三种) ⑷同素异形体间的混合体 ⑸其他:①氨水、氯水、王水、天然水、硬水、软水、水玻璃、福尔马林、盐酸、浓硫酸;②爆鸣气、水煤气、天然气、焦炉气、高炉煤气、石油气、裂解气、空气; ③钢、生铁、普钙、漂白粉、碱石灰、黑火药、铝热剂、水泥、铁触媒、玻璃、煤; ④煤焦油、石油及其各种馏分、植物油和动物油。 3、单质、同素异形体 ①同种元素的原子能构成单质的分子或晶体。如白磷是4原子分子晶体: ,红磷是多原子分子如图 它们的固态是分子晶体;稀有气体单质是单原子分子,其固态也属分子晶体;碳、硅、硼的固体是原子晶体。 ②同种元素形成的同单质互为同素异形体,有因分子中原子个数不同而形成的同素异形体,如氧气(O2)和臭氧(O3);因晶体中原子排列不同而形成的同素异形体,如金刚石和石墨,白磷和红磷。 同素异形体在一定条件下可以相互转化,其转化过程破坏原有化学键,因而属于化学变化。同素异形体在纯氧中充分燃烧的产物是唯一的,因此可以由此两个方面证明其互为同素异形体。 ③单质可分为金属与非金属两大类,金属单质具有金属光泽、导电、导热,固态时有延展性;在化学反应中是还原剂。非金属单质一般没有金属光泽,质脆易碎,除个别(石墨)外不善于导电传热。非金属性强者在化学反应中是氧化剂。 4、化合物 不同元素组成的纯净物叫化合物。它又分为有机化合物和无机化合物两大类。无机化合物的初步分类见前页表 (1)氢化物:由氢和另一种元素形成的化合物。一般由非金属元素形成的氢化物,其固体属分子晶体,熔点较低,常温呈气态,称气态氢化物;碱金属及碱土金属(ⅡA)与氢形成的氢化物则属于离子型氢化物,其中氢元素为-1价。 (2)氧化物:由氧和另一种元素形成的化合物。根据其性质可进一步分为: A.碱性氧化物-与酸反应生成盐和水的氧化物。一般低价金属氧化物,特别是活泼金属氧化物(ⅠA、ⅡA族)属于此类氧化物 B.酸性氧化物-与碱反应生成盐和水的氧化物。一般非金属氧化物,特别是高价非金属氧化物(CO2、SO2、SO3)和高价金属氧化物(Mn2O7、CrO3)属于此类氧化物 C.两性氧化物-既能跟酸起反应又能跟碱起反应,生成盐和水的氧化物。如Al2O3、ZnO、Beo等。 注意: a酸性氧化物、碱性氧化物(包括两性氧化物)的对应(化合价一致)水化物是含氧酸或碱。 b.少数几种氧化物如CO、NO等,既不能跟酸,也不能与碱反应生成盐和水,叫做不成盐氧化物。 c.酸性氧化物、碱性氧化物分别可以看成是含氧酸、碱失去水的剩余部分,又称酸酐,酸酐(其中相应元素R的化合价相同)),如SO3是硫酸的酸酐,SO2是亚硫酸的酸酐,N2O5是硝酸的酸酐。至于NO2既不是硝酸也不是亚硝酸的酸酐。 d.通常的氧化物中氧元素的化合价为-2价。氧元素和碱金属、某些碱土金属还能形成化合价为-1价的过氧化物,如Na2O2和BaO2以及超氧化物,如KO2。 (3)酸:由氢和酸根组成,与碱反应生成盐和水。酸是一种电解质,在电离时生成酸根阴离子,其阳离子全部都是氢离子。 ①按组成分无氧酸(酸根不含氧元素),它们是酸性气态氢化物水溶液,称氢某酸,如氢氯酸HCl(俗称盐酸),氢碘酸HI、氢硫酸H2S、氢氰酸HCN等;含氧酸(酸根中含氧元素)称某酸如硫酸H2SO4、硝酸HNO3,有不同变价的按其化合物称高氯酸HClO4,氯酸HClO3,亚氯酸HClO2,次氯酸HClO。 相同元素、且成酸价态相同的酸还可按酸分子中失水情况分正酸和偏酸,如H3PO4为磷酸,HPO3为偏磷酸;H4SiO4为原硅酸,H2SiO3为硅酸;H3AlO3为铝酸,HAlO2为偏铝酸等。 ②按其性质不同可分 a.强酸与弱酸 按相同条件同浓度下的电离度区分。常见酸的强弱: 强酸:HClO4、H2SO4、HNO3、HCl、HBr、HI;中强酸:H2SO3、H3PO4;弱酸:HF、CH3COOH、H2CO3、H2S、HClO、HAlO2、H2SiO3 b.挥发性酸又称低沸点酸如HCl、HF、HBr、HI、HNO3、H2S和不挥发性酸又称高沸点酸如H2SO4、H3PO4。另有某些不稳定含氧酸如H2SO3、H2CO3、HClO,只存在于水溶液中。 c.氧化性酸和非氧化性酸,这是根据酸根阴离子在化学反应中的氧化性与非氧化性划分的,酸中的H+都有氧化性。常见的氧化性酸有硝酸、浓硫酸和次氯酸,非氧化性酸如盐酸、氢氟酸、磷酸。 注:酸性强弱和氧化性强弱之间没有联系和因果关系,如次氯酸HClO是强氧化性弱酸。 (4)碱:由金属和氢氧根组成(氨水NH3·H2O除外),且与酸反应生成盐和水,它电离生成的阴离子全部是氢氧根。可以按性质分为强碱与弱碱,也可以按溶解性分为可溶性碱和难溶碱。如: KOH、NaOH、Ba(OH)2为可溶性强碱; Ca(OH)2为微溶性强碱;Fe(OH)2 Fe(OH)3、Cu(OH)2为难溶性弱碱;NH3·H2O为可溶性弱碱 (5)盐:由金属(或NH4+)离子与酸根组成的化合物。仅由金属与酸根组成的盐叫正盐,如Na2SO4、K3PO4;如组成中还有氢元素,即有酸式根的为酸式盐,如NaHSO4、NaHCO3、Ca(H2PO4)2;除金属和酸根外还有氢氧根为碱式盐,如Cu2(OH)2CO3、Mg(OH)Cl等,一般碱式盐的水溶性较差;在电离时产生两种阳离子和一种酸根离子的盐是复盐,如KAl(SO4)2·12H2O、(NH4)2Fe(SO4)2、KCl·MgCl2·6H2O。 (5)络合物: 含有络离子的化合物属于络合物. 例如络盐[Ag(NH3)2]Cl、络酸H2[PtCl6]、络碱[Cu(NH3)4](OH)2等;也指不带电荷的络合分子,例如[Fe(SCN)3]、[Co(NH3)3Cl3]等。配合物又称络合物。 (6)其它常见的无机化合物,如Mg3N2、CaC2一般不称盐类而属于氮化物、碳化物 典型例题 【例1】(2010山东卷,13)下列推断正确的是 A.SiO2 是酸性氧化物,能与NaOH溶液反应 B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在 D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 解析:酸性氧化物能够跟碱反应,生成盐和水的氧化物,故A正确,因为 , 与反应生成, 与反应除生成外,还生成,故B错;在空气中会发生反应,故C错;因为新制氯水中含有,故滴入少量的紫色石蕊的现象是先变红,后褪色,故D错。 答案:A 【例2】(湖南雅礼中学)下列物质按不同类别分组,所得组合最不合理的是( ) (1)糖类 (2)塑料 (3)石油 (4)蛋白质 (5)合成纤维 (6)棉花 (7)陶瓷 (8)玻璃 (9)天然气 (10)水泥 (11)合成橡胶 (12)煤 (13)油脂 (14)羊毛 A.(1)、(4)、(13) B.(2)、(5)、(11) C.(7)、(8)、(10)、(14) D.(3)、(9)、(12) [解析]A所涉及的都是基本营养物质,分类合理;B所涉及的都是有机合成材料,分类合理;D所涉及的都是有机燃料,分类合理。而C中(7)、(8)、(10)属于传统型的无机非金属材料,(14)属于天然有机高分子材料。 [答案]C 【例3】(2010河南省平顶山市调研考试)硫酸不仅具有酸性,而且还具有强氧化性、吸水性、脱水性等,请把硫酸在下列使用过程中所表现出的性质填写在空白处: (1) 浓硫酸常作某些气体的干燥剂:______________; (2) 红热的炭放入浓硫酸中,有气体放出:______________; (3) 蔗糖中加入浓硫酸时,蔗糖变黑:______________。 答案(1) 吸水性 (2) 强氧化性 (3)脱水性 第3课时 物理变化和化学变化 基础过关 1.物理变化与化学变化 ⑴物理变化:没有生成其他物质的变化。即物理变化仅是物质形态的变化。如:水的三态转化,石油的分馏,用CCl4萃取碘水中的碘。物理变化过程中可能发生化学键的断裂或者形成化学键,如食盐晶体熔化时就是破坏晶体中的离子键,而液体NaCl降温变成晶体时,又形成了离子键。 ⑵化学变化:变化时生成其他物质,这种变化叫做化学变化。又叫化学反应。与物理变化相比,化学变化有以下特征: ①有新物质生成②常伴有放热、发光、变色、发声等现象③变化的本质是:旧键断裂、同时新键形成。如:石油裂化,煤干馏,胃内消化食物等。 化学变化过程的同时也发生了物理变化。例如,点燃蜡烛时,石蜡受热熔化是物理变化,石蜡燃烧生成CO2和H2O是化学变化。 2.物理性质与化学性质 物理性质:物质不需要发生化学变化就表现出来的性质,叫做物理性质。如颜色、状态、气味、溶解性、熔点、沸点、硬度、密度等。物理性质是物质本身的一种属性,一般指不涉及物质化学组成改变的一类性质。 化学性质:物质在化学变化中表现出来的性质叫做化学性质。化学性质也是物质本身的一种属性,是化学研究的主要对象之一,是学习化学的主要内容。 (1)化学性质主要包括 ①氧化性、还原性②酸性、碱性③稳定性④络合性 (2)影响化学性质的因素 ①物质结构。结构是影响化学性质的最重要因素,结构决定物质的主要化学性质。结构包括:原子结构、分子结构、离子结构、晶体结构等。 ②物质的浓度对化学性质也有影响,如浓H2SO4与稀H2SO4的性质不同,浓HNO3与稀HNO3的性质不同等。 Cu十H2SO4(稀)——不反应 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 典型例题 【例1】下列各组物质中不易用物理性质区别的是( ) A.苯和四氯化碳 B.酒精和汽油 C.氯化铵和硝酸铵晶体 D.碘和高锰酸钾固体 解析: A中苯和四氯化碳可利用两者在水中的溶解性和密度加以区分;B中酒精和汽油可利用其在水中的溶解性加以区分;D中碘和高锰酸钾固体可利用其在水中的溶解性和溶液颜色加以区分。 答案:C。 【例2】下列过程中,不涉及化学变化的是( ) A.甘油加水作护肤剂 B.用明矾净化水 C.烹鱼时加入少量的料酒和食醋可减少腥味,增加香味 D.烧菜用过的铁锅,经放置常出现红棕色斑迹 解析:化学变化与物理变化的本质区别是:是否有新物质生成。甘油稀释后仍具有吸湿性,可做护肤剂,该过程中不涉及化学变化;明矾溶于水后,发生反应Al3++3H2O=Al(OH)3+3H+,产生了Al(OH)3 胶体,从而可净化水;烹鱼时加入少量的料酒和食醋可减少腥味,增加香味的原因是该过程中发生了C2H5OH+CH3COOH→CH3COOC2H5+H2 O,产生了具有果香味的乙酸乙酯的缘故;烧菜用过的铁锅,由于在潮湿的环境中发生了电化腐蚀,Fe最终被氧化成Fe2O3·nH2O,而出现红棕色斑迹。后三者都是化学变化过程。 答案:A。 第4课时 元素、同位素、核素、同素异形体 基础过关 1、元素:具有相同核电荷数(即质子数)的同一类原子的总称。如:所有核电荷数为1的原子都称作氢原子,总称为氢元素。到目前为止,已经发现了110余种元素。 2、同位素:具有相同质子数和不同中子数的同种元素的不同种原子,互称同位素。“同位”是指在周期表中处于同一位置。同位素的特征是原子序数相同而质量数不同。大多数元素都有几种甚至十几种的同位素。 (1)同位素的实例 H有三种同位素:11H、12H、13H;O有三种同位素: 816O、817O; 118O有三种同位素:612C、613C、614C ;Sn有十种同位素: 50112Sn、50114Sn、50115Sn····50124Sn, U有二种同位素: 92235、U92238U 。 目前已知的同位素达数千种。 (2)同位素的稳定性 (3)同位素的性质:a.天然同位素有稳定的百分组成b.化学性质几乎相同(同种元素的同位素) (4)同位素的应用:用612C作相对原子质量和阿伏加德罗常数的标准; 示踪原子:用614C测岩石的年龄;放射治疗,如60C。等核能,如2H,235U等 ⑶核素: 具有一定数目的质子和一定数目的中子的一种原子叫做核素。即质子数、中子数不完全相同的一种原子就称为一种核素。例如:11H、12H、13H、612C、613C、614C、92235、U92238U 都各自独立称为核素,即8种核素(但属于3种元素)。 注意:同一种元素的不同核素之间互称同位素。 4、同素异形体:由同种元素所形成的几种性质不同种单质叫做同素异形体。如O2(氧气)和O3(臭氧),红磷(P)和白磷(P4),金刚石和石墨等。 (1)同素异形体的物理性质不同,化学性质相似。②性质不同的原因是结构不同或组成不同。 (2)同素异形体之间可以相互转化,属于化学变化,但不属于氧化还原反应。如: 物质的组成、性质和分类单元测试题 一、选择题 l、以下说法正确的足…………………………( ) A.纳米材料是指一种称为“纳米”的新物质制成的材料 B.绿色食品是指不含任何化学物质的食品 C.生物固氮是指植物通过叶面直接吸收空气中的氮气 D.光导纤维是以二氧化硅为主要原料制成的 2、已知自然界中氧的同位素有16O、17O、18O,氧的同位素有H、D,从水分子的组成来看,自然界的水一共有………………( ) A.3种 B.6种 C.9种 D.12种 3、下列广告用语在科学上没有错误的是………… ( ) A.这种饮料中不含任何化学物质 B.这种蒸馏水绝对纯净,其中不含任何离子 C.这种口服液含有丰富的氮、磷、锌等微量元素 D.没有水就没有生命 4、关于非金属元素N、O、Cl、P的叙述,正确的是( ) A.在通常情况下其单质均为气体 B.其单质均由双原子分子构成 C.都属于主族元素 D.每种元素仅生成一种氢化物 5、下列物质一定不是天然高分子的是…………… ( ) A.橡胶 B.蛋白质 C.尼龙 D.纤维素 6、只含有一种元素的物质………………………… ( ) A.可能是纯净物也可能是混合物 B.可能是单质也可能是化合物 C.一定是纯净物 D.一定是单质 7、当今化学界关注的热点之一的C60,可以看成是金刚石的…… ( ) A.同素异形体 B.同分异构体 C.同位素 D.同系物 某矿泉水标签上印有下列字样:主要成分(单位:mg/L)Ca:20.2,K:39.1,Mg:3.27,Zn:0.06,F:0.02,重碳酸:7,偏硅酸:4,不含CO2。回答下列5—10题: 8、标签上的“Ca、K、Mg、Zn、F”是指………… ( ) A、单质 B、元素 C、原子 D、分子 9、标签上的“重碳酸”“偏硅酸”是指………… ( ) A、碳酸分子和偏硅酸分子 B、碳酸和偏硅酸的正盐 C、HCO3-和SiO32- D、碳酸和偏硅酸的酸式盐 10、某矿泉水瓶标签上“不含CO2”说明………… ( ) A、这种矿泉水是纯净的 B、CO2不能溶解在这种矿泉水中 C、这种矿泉水没有分解出CO2 D、这种矿泉水灌瓶前除去了CO2 11、用化学方法不能实现的是………… ( ) A、生成一种新分子 B、生成一种新离子 C、生成一种新原子 D、生成一种新单质 12、由两种原子组成的纯净物………… ( ) A、一定是化合物 B、可能是单质,可能是化合物 C、一定是单质 D、一定是同素异形体 13、下列物质固态时,必定是分子晶体的是………… ( ) A、酸性氧化物 B、非金属单质 C、碱性氧化物 D、含氧酸 14、人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”。在五金顺序中,把一种金属的位置向后移一位,正好符合化学规律。这种金属和这条化学规律是………… ( ) A、银、质量守恒定律 B、铁、金属活动性顺序表 C、铜、金属活动顺序表 D、铁、元素周期表 15、美国发射的航天器已将我国研制的磁谱仪带入太空,其目的是探索反物质的存在。反物质的主要特征是电子带正电荷、质子带负电荷。以下可表示物质酸和碱中和反应实质的是… ( ) A、H-+OH+=H2O B、H++OH+=H2O C、H-+OH-=H2O D、H++OH-=H2O 16、无机化学中也存在同分异构体,互为同分异构体的一组无机物是………… ( ) A、NH4CNO与尿素CO(NH2)2 B、H2O与D2O C、[Cr(H2O)5Cl]Cl2·H2O与[Cr(H2O)4Cl2]Cl·2H2O D、Si(OH)4与H4SiO4 17、下列化学式及结构式中,从成键情况看来不合理的是………… ( ) 18、某共价化合物分子中含有C、N、O、H四种元素,且以nC、nN、nO分别表示C、N和O的原子数目,则H原子数目最多为………… ( ) A、2nO+2 B、2nC+nN C、2(nC+nN) D、2nC+nN+2 19、下列叙述中正确的是………… ( ) A、阳离子不一定是金属离子,含阳离子的物质一定含阴离子 B、阴、阳离子相互作用不一定形成离子化合物 C、离子化合物均属于强电解质,都易溶于水 D、由某金属元素的阳离子和某非金属元素阴离子组成的物质一定是纯净物 20、下列实验或生产操作:①蛋白质溶液中加入硫酸铵形成沉淀;②二氧化氮经加压凝成无色液体;③石蜡催化裂化;④碘受热变成碘蒸汽;⑤照相底片被感光。其中,没有新的物质生成的是………… ( ) A、①④ B、②③ C、①③⑤ D、①②④ 21、下列车员物质按照纯净物、混合物、电解质和非电解质顺序排列的是………… ( ) A、盐酸、水煤气、醋酸、干冰 B、冰醋酸、福尔马林、硫酸钠、乙醇 C、单甘油酯、混甘油酯、苛性钾、石灰石 D、胆矾、漂白粉、氯化钾、氯气 22、航天技术测得三氧化二碳(C2O3)是金星大气层的成份之一,下列关于C2O3的说法中错误的是………… ( ) A、C2O3与CO2都是碳的氧化物 B、C2O3与CO2都是碳酸的酸酐 C、C2O3与CO都具有还原性 D、C2O3与C的燃烧产物都是CO2 23、下列变化能够实现的是………… ( ) ①弱酸与盐溶液反应生成强酸 ②两种氧化物发生反应有气体生成 ③两种酸的溶液充分反应后溶液呈中性 ④复分解反应中既没有生成水,也没有生成沉淀和气体 A、只有①③ B、只有②④ C、只有①②④ D、①②③④ 24、某些化学试剂可用于净水。水处理中使用的一种无机高分子混凝剂的化学式可表示为:[Al2(OH)nClm·yH2O]x式中m等于………… ( ) A、3-n B、6-n C、6+n D、3+n 25、最近,科学家用一种称为“超酸”的化合物H(CB11H6Cl6)和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。该反应看起来很陌生,但反应类型上可以跟中学化学里某个熟悉的化学反应相比拟。该化学反应是………… ( ) A.Zn+2HCl == ZnCl2+H2↑ B.NaOH+HCl == NaCl+H2O C.NH3+HCl == NH4Cl D.H2O+CH3COOH =H3O++CH3COO— 26、对于复分解反应:X+Y=Z+W,下列叙述正确的是………… ( ) A、若Z是强酸,则X或Y必有一种是酸 B、若Y是强碱,X是盐,则Z或W必有一种是弱碱 C、若W是弱碱,Z是盐,则X或Y必有一种是强碱 D、若X是强酸,Y是盐,反应后可能有强酸或弱酸生成 27、“混盐”是指一种金属离子与多种酸根离子构成的盐,如氯化硝酸钙[Ca(NH3)Cl]就是一种混盐。“复盐”是指含有多种简单阳离子和一种酸根阴离子的盐如KAl(SO4)2,下列各化合物中属于混盐的是………… ( ) A、CaOCl2 B、(NH4)3Fe(SO4)2 C、BiONO3 D、K3[Fe(CN)6] 28、被誉为“太空金属”的钛,在室温下,不与水、稀硫酸、稀盐酸和稀硝酸作用,但易溶于氢氟酸,其原因可能是………… ( ) A、氢氟酸的酸性比其他酸强 B、氢氟酸的氧化性比其他酸强 C、氢氟酸的还原性比其他酸强 D、钛离子易与氟离子形成可溶性难电离物质 29、我国的稀土含量丰富,稀土元素可用RE表示。在提纯过程中可以向稀土元素的硫酸盐溶液中加入粉状Na2SO4,使稀土元素转化为沉淀,反应为:………… ( ) RE2(SO4)3+Na2SO4+xH2ORE2(SO4)3·Na2SO4·xH2O(x=1,2) 下列叙述正确的是: A、该反应一定在强碱溶液中进行 B、产生沉淀的反应为复分解反应 C、反应生成的沉淀属于复盐 D、产生沉淀的变化属于化学变化 30、铝和镓的性质相似,如M(OH)3都是难溶的两性氢氧化物。在自然界镓常以极少量分散于铝土矿,如Al2O3中。用NaOH溶液处理铝矿(Al2O3)时,生成NaAlO2、NaGaO2;而后通入适量CO2,得Al(OH)3沉淀,而NaGaO2留在溶液中(循环多次后成为提取镓的原料)。发生后一步反应是因为 ( ) A、镓酸酸性强于铝酸 B、铝酸酸性强于镓酸 C、镓浓度小,所以不沉淀 D、Al(OH)3是难溶物 31、(北京理综)近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80MPa下合成出金刚石,具有深远意义。下列说法不正确的是 (B) A. 由二氧化碳合成金刚石是化学变化 B. 金刚石是碳的一种同位素 C. 钠被氧化最终生成碳酸钠 D. 金刚石中只含有非极性共价键 二、非选择题 32、已知在一定条件下可发生反应:2KClO3+I2=2KIO3+Cl2,此反应属于________反应(从分解、化合、置换、复分解反应中选择填空)。有人据此认为碘的非金属性比氯强,你认为对吗?(错对与否,都需说明原因) ______________________________________________________________ 33、结构化学家鲍林(Pauling)曾提出一条经验规则:设含氧酸的化学式为HnROm,其中(m-n)为 非羟基氧的原子数。而含氧酸的强弱与非羟基氧原子数(m-n)有如下关系: (m-n) 0 1 2 3 含氧酸强度 弱酸 中强 强 很强 实例 HClO H3PO4 HNO3 HClO4 请回答: (1)按此规则判断:H3AsO4,H2SO4,HMnO4三处酸性由强到弱的顺序是_________。 (2)H3PO3和H3AsO3的分子组成相似,但酸性强弱相差很大,已知H3PO3为中强酸而H3AsO3为弱酸,试推断它们的结构式,H3PO3为__________,H3AsO3为_________。 34、硼酸晶体成片状,有滑腻感,可作润滑剂,硼酸分子结构可表示为。硼酸对人体的受伤组织有缓和的防腐作用,故可用于医药和食品防腐等方面 (1)根据以上所述可知硼酸应属于_____________。 A、强酸 B、中强酸 C、弱酸 (2)研究表明:在大多数情况下,元素的原子在形成分子或离子时,其最外电子层具有达到8电子稳定结构的趋势。在硼酸分子中,最外层达到8个电子稳定结构的原子有_______个。 (3)硼酸和甲醇在浓硫酸存在的条件下,可生成挥发性硼酸三甲酯,试写出硼酸完全酯化的化学方程式(注明反应条件)_______________________________________。 (4)已知硼酸0.01mol可被20mL0.5mol·L-1NaOH溶液恰好完全中和,据此推测:硼酸在水中显酸性的原因是(写电离方程式)_____________________________________。 35、双氧水(H2O2)和水都是极弱电解质,但H2O2比H2O更显酸性。 (1)若把H2O2看成是二元弱酸,请写出它在水中的电离方程式:_______________。 (2)鉴于H2O2显弱酸性,它可以同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出H2O2与Ba(OH)2作用形成正盐的化学方程式:_______________。 (3)水电离生成H3O+和OH-叫做水的自偶电离。同水一样,H2O2也有极微弱的自偶电离,其自偶电离的方程式为:______________________。 参考答案: 1、D 2、D 3、D 4、C 5、C 6、B 7、A 8、 B 9 、C 10、 D 11、C 12 、B 13、 D 14、 B 15、 A 16 、C 17、 B 18、 D 19 、B 20 、A 21、 B 22、 B 23 、D 24 、B 25 、B 26 、D 27 、A 28 、D 29 、CD 30 、D 31、B 32、错。非金属性指得电子能力,而此反应中I元素是失电子。 33、(1)HMnO4>H2SO4>H3AsO3 (2) 34、(1)C(2)3(3)H3BO3+3CH3OHB(OCH3)3+3H2O (4)H3BO3 +H2O →B(OH)4-+H+ 35、(1)H2O2 HO2-+H+;HO2- H++O22- (2)H2O2+Ba(OH)2= Ba O2+2 H2O; 1.3.5 2,4,6 2H2O2+Ba(OH)2= Ba(HO2)2+2 H2O; 1.3.5 (3)2 H2O2 HO2-+H3O2+ 查看更多