- 2021-04-17 发布 |
- 37.5 KB |
- 17页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版高中化学必修1课件:第3章 第1节 金属的高中化学性质(2)
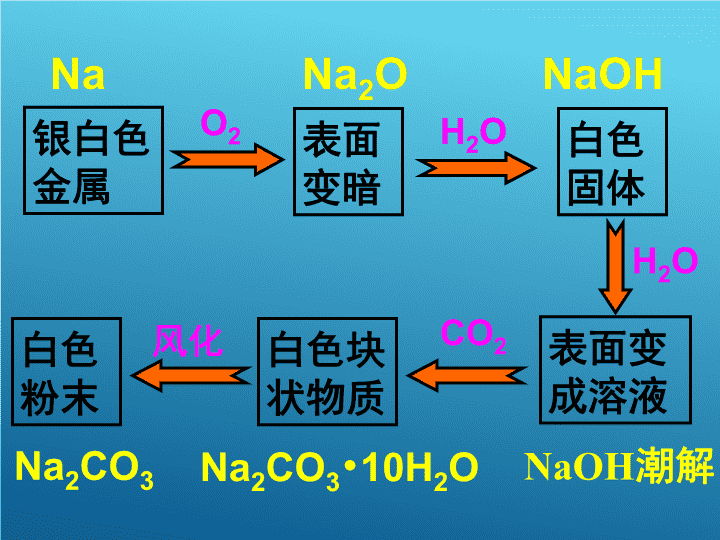
银白色 金属 表面 变暗 白色 固体 表面变 成溶液 白色块 状物质 O2 H2O H2O CO2风化白色 粉末 Na Na2O NaOH NaOH潮解Na2CO3•10H2ONa2CO3 二.金属与水的反应 1.金属钠和水的反应 实验5: 将一小块金属钠投入滴有酚酞的水中 现 象 及 解 释 浮 游 熔 响 红 金属钠的密度小于水 产生的气体推动金属钠来回游动 反应放热,钠的熔点较低 剧烈反应,产生气体 有碱性物质生成 2Na + 2H2O = 2NaOH + H2↑ 思考 1、金属钠引起火灾时应当怎 样灭火? 2、金属钠为什么保存在煤油中? 总结:钠的物理性质和化学性质 物理性质:银白色的固体,质软,密度 比水小(0.97g/cm3), 熔点较低(97.87℃) 化学性质: 化学性质很活泼 1.与氧气反应 4Na + O2 = 2Na2O 2Na + O2 === Na2O2 点燃 2.与水反应 2Na + 2H2O = 2NaOH + H2↑ 2.铁与水蒸气的反应 铁不能与冷、热水反应, 但能否与水蒸气反应? 请设计一个简单的实验装置,使还 原铁粉与水蒸气反应。 思考: 1. 该反应装置包括哪几部分? 水蒸气的发生装置 水蒸气与铁粉反应装置 产物的检验(收集)装置 水蒸气的 发生装置 水蒸气与铁 粉反应装置 产物收 集装置 方案1: 方案2: 方案3: 4、实验是否安全 3Fe+4H2O (g) Fe3O4+4H2↑ 三.铝与氢氧化钠溶液的反应 1.铝与稀盐酸的反应 化学方程式为: 2Al + 6HCl = 2AlCl3 + 3H2↑ 离子方程式为: 2Al+6H+=2Al3+ +3H2 ↑ 2.铝与氢氧化钠溶液的反应 2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑ 离子方程式为: 2Al + 2OH- + 2H2O =2AlO2 - + 3H2 ↑ 三.铝与氢氧化钠溶液的反应 1.铝与稀盐酸的反应 2Al+6H+=2Al3+ +3H2 ↑ 铝既能与强酸溶液反应也能与强碱溶 液反应,因此酸、碱可直接侵蚀铝的保护 膜以及铝制品本身,铝制品餐具不宜用来 蒸煮或长时间存放酸性、碱性或咸的食物 三.铝与氢氧化钠溶液的反应 1.铝与稀盐酸的反应 2Al+6H+=2Al3+ +3H2↑ 2.铝与氢氧化钠溶液的反应 2Al + 2OH- + 2H2O =2AlO2 - + 3H2 ↑ 以上我们学习了金属的一些化学性质,通过分 析不难发现,在反应中这些金属元素的化合价 都发生了变化,它们从0价升为正价。 在这些变化中,金属表现了强 的还原性,做还原剂 在自然界中金属多以化合态存在。只有 极少数金属以游离态存在 三.铝与氢氧化钠溶液的反应 1.铝与稀盐酸的反应 化学方程式为: 2Al + 6HCl == 2AlCl3 + 3H2 离子方程式为: 2Al+6H+==2Al3+ +3H2 2.铝与氢氧化钠溶液的反应 2Al+2NaOH+2H2O==2NaAlO2+3H2 铝既能与强酸溶液反应也能与强碱溶液反应,因此酸、碱可 直接侵蚀铝的保护膜以及铝制品本身,铝制品餐具不宜用来蒸 煮或长时间存放酸性、碱性或咸的食物查看更多