- 2021-04-16 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮复习选择题标准练11含解析
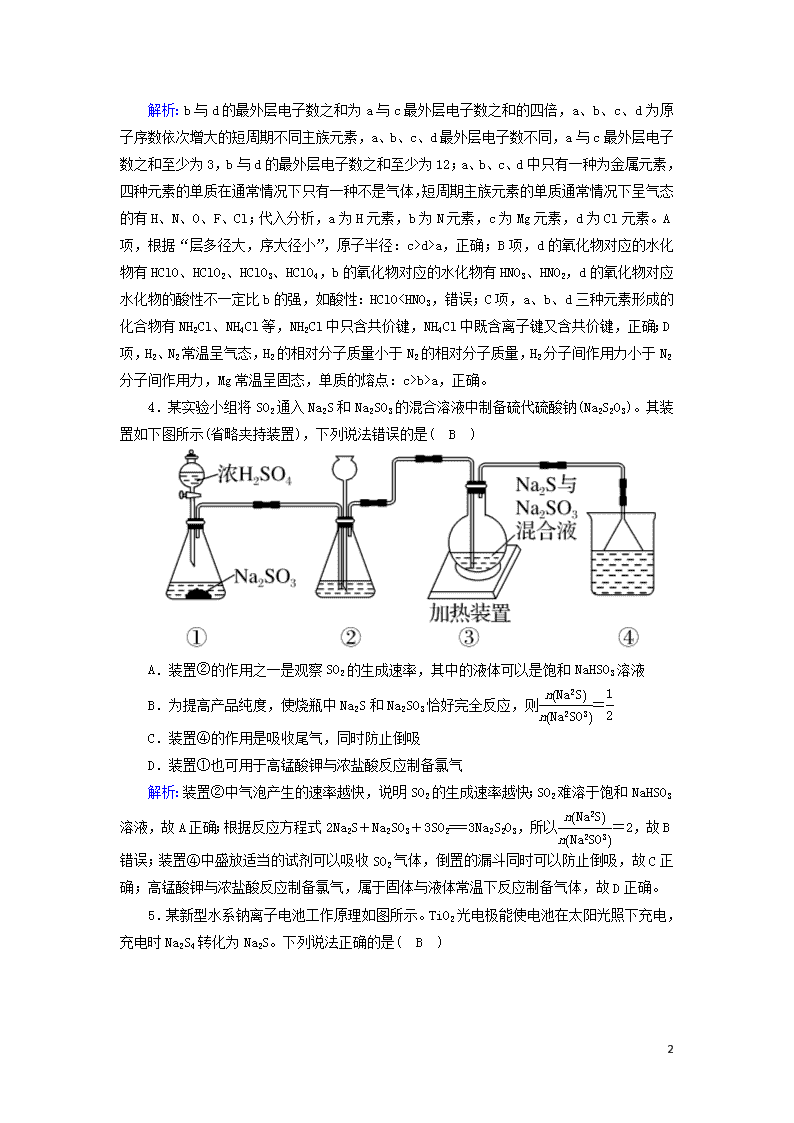
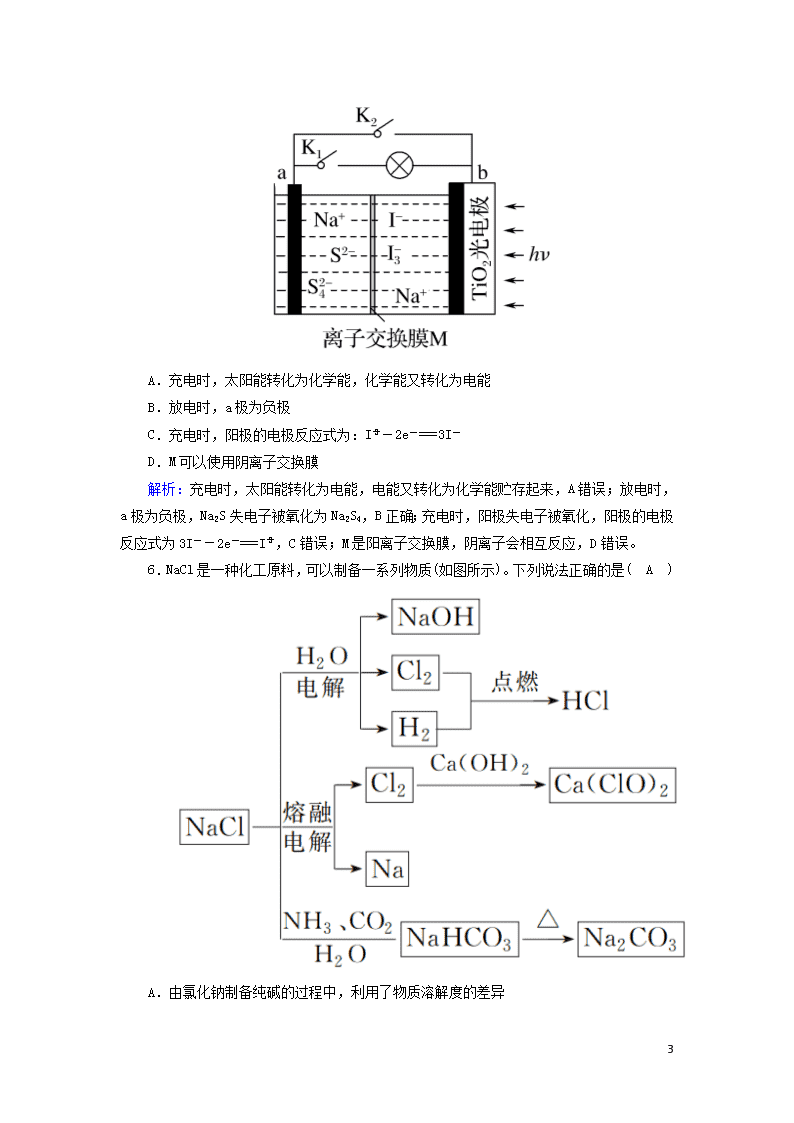
选择题标准练(十一) 满分:42分 每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。 1.下列诗句中,加点字(词)所指代物质的主要成分与其他三项不相同的是( A ) A.柳絮飞时花满城 B.朝如青丝暮成雪 C.狐裘不暖锦衾薄 D.春蚕到死丝方尽 解析:A项,柳絮飞时花满城,柳絮主要成分是纤维素,与其他三项不相同,正确;B项,朝如青丝暮成雪,青丝主要成分是蛋白质,错误;C项,狐裘不暖锦衾薄,狐裘主要成分是蛋白质,错误;D项,春蚕到死丝方尽,丝主要成分是蛋白质,错误。 2.莎普爱思的有效成分是由苄达酸与赖氨酸生成的有机盐,苄达酸结构如图所示。下列关于苄达酸的叙述正确的是( B ) A.分子式为C16H16N2O3 B.属于芳香族化合物,且有弱酸性 C.苯环上的一氯代物有5种 D.所有原子可能共平面 解析:A项,根据结构简式可知其分子式为C16H14N2O3,错误;B项,含有苯环属于芳香族化合物,含有羧基,具有弱酸性,正确;C项,分子中有两个苯环,苯环上的氢原子有七种,所以一氯代物有7种,错误;D项,根据甲烷为正四面体结构,分子中含有亚甲基,所有原子不可能共平面,错误。 3.a、b、c、d为原子序数依次增大的短周期不同主族元素,其中只有一种为金属元素,四种元素的单质在通常情况下只有一种不是气体,b与d的最外层电子数之和为a与c最外层电子数之和的四倍。下列叙述不正确的是( B ) A.原子半径:c>d>a B.d的氧化物对应的水化物酸性均比b的强 C.a、b、d三种元素形成的化合物可能既含离子键又含共价键 D.单质的熔点:c>b>a 5 解析:b与d的最外层电子数之和为a与c最外层电子数之和的四倍,a、b、c、d为原子序数依次增大的短周期不同主族元素,a、b、c、d最外层电子数不同,a与c最外层电子数之和至少为3,b与d的最外层电子数之和至少为12;a、b、c、d中只有一种为金属元素,四种元素的单质在通常情况下只有一种不是气体,短周期主族元素的单质通常情况下呈气态的有H、N、O、F、Cl;代入分析,a为H元素,b为N元素,c为Mg元素,d为Cl元素。A项,根据“层多径大,序大径小”,原子半径:c>d>a,正确;B项,d的氧化物对应的水化物有HClO、HClO2、HClO3、HClO4,b的氧化物对应的水化物有HNO3、HNO2,d的氧化物对应水化物的酸性不一定比b的强,如酸性:HClO查看更多