- 2021-04-16 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
黑龙江省大庆市铁人中学2020-2021高一化学10月月考试题(Word版附答案)
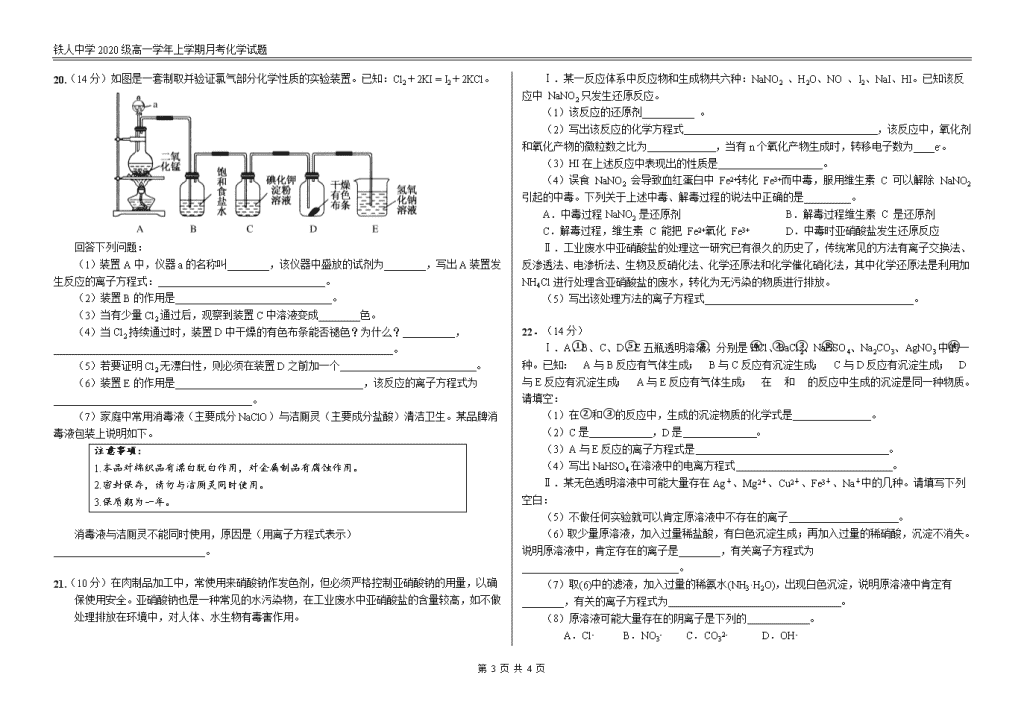
铁人中学2020级高一学年上学期月考化学试题 铁人中学2020级高一学年上学期月考 化学试题 试题说明:1、本试题满分100分,答题时间90分钟。 2、 请将答案填写在答题卡上,考试结束后只交答题卡。 3、 可能用到的相对原子质量:H:1 C:12 N:14 O:16 S:32 Na:23 Fe:56 Cu:64 K:39 第Ⅰ卷 选择题部分 一、选择题(每小题只有一个选项正确,每小题3分,共54分。) 1.新冠肺炎传播途径主要为直接传播、接触传播和气溶胶传播。气溶胶传播是指飞沫混合在空气中,形成气溶胶,吸入后导致感染,而气溶胶是胶体的一种。胶体区别于其它分散系的本质特征是( ) A.胶体是稳定的分散系 B.胶体是纯净物,其它分散系是混合物 C.产生丁达尔现象 D.分散质粒子直径在10-9~10-7m之间 2.下列各组物质,按酸、碱、盐、氧化物的顺序排列的是( ) 选项 酸 碱 盐 氧化物 A 硫酸 火碱 纯碱 水 B 醋酸 熟石灰 火碱 干冰 C 硝酸 纯碱 明矾 过氧化氢 D 盐酸 氧化钙 氯化钠 氧化镁 3.氯气是一种有毒气体,在运输与储存过程中必须防止泄漏。一旦储存液氯的钢瓶发生泄漏,必须立即采取措施。下列各种措施不合理的是( ) A.将人群向高处疏散 B.将人群逆风向疏散 C.用浸有烧碱溶液的毛巾捂住口鼻 D.向泄漏地点撒一些石灰 4.分类法是学习和研究化学的一种常用的科学方法.下列分类合理的是( ) ①Fe2O3、CaO、Na2O2都是碱性氧化物 ②Na2CO3是正盐,NaHCO3 是酸式盐 ③H2SO4与KHSO4均含相同的元素氢,故KHSO4也可以称为酸 ④洁净的空气、纯净的盐酸都是混合物 ⑤根据分散系能否产生丁达尔现象将分散系分为胶体、溶液和浊液 A.只有①③⑤ B.只有②④ C.只有①②④ D.只有②③⑤ 5.下列说法正确的是( ) A.硫酸钡难溶于水,所以硫酸钡不是电解质 B.CO2溶于水得到的溶液能导电,所以CO2是电解质 C.NaCl固体不导电,但是其水溶液导电,因此NaCl固体是电解质 D.某物质若不是电解质,就一定是非电解质 6.下列有关Na2O2的叙述中,正确的是( ) A.过氧化钠与二氧化碳反应是置换反应 B.过氧化钠可用于呼吸面具中作为氧气的来源 C.过氧化钠常用于自来水杀菌消毒 D.阴离子与阳离子个数比为1:1 7.下列关于物质的用途说法不正确的是( ) A.碳酸氢钠作胃药 B.过氧化钠作供氧剂 C.碳酸钠作食品膨化剂 D.氯气制漂白粉 8.关于氢氧化铁胶体的制备正确的是( ) A.将小烧杯中25mL氢氧化钠溶液加至沸腾,向其中滴加氯化铁饱和溶液,加热煮沸至溶液呈红褐色,停止加热 B.制备氢氧化铁胶体时,可以用蒸馏水也可以用自来水 C.制备氢氧化铁胶体的原理是FeCl3+3H2OFe(OH)3↓+3HCl D.将小烧杯中25mL蒸馏水加至沸腾,向沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至溶液呈红褐色,停止加热 9.庆祝中华人民共和国70周年的焰火晚会令人难忘,五颜六色的焰火的产生与焰色试验有关。下述对焰色试验的叙述正确的是( ) ①钾的火焰颜色要透过蓝色钴玻璃观察 ②焰色试验是金属单质的特性 ③钡的焰色为绿色,钙元素的焰色为砖红色 ④每次实验后,要将铂丝用硫酸洗净 ⑤没有铂丝时,也可以用光洁无锈的铁丝代替 第 4 页 共 4 页 铁人中学2020级高一学年上学期月考化学试题 ⑥所有金属或他们的化合物在火焰上灼烧时都会使火焰呈现出特征颜色 A.仅有⑥不正确 B.仅有①③⑤正确 C.仅有①⑤正确 D.全正确 10.下列离子方程式书写正确的是( ) A.钠与水反应:4Na+2H2O = 4Na++2OH-+H2↑ B.碳酸氢钠溶液与氢氧化钠溶液混合:HCO3-+OH- = CO2↑+H2O C.用氢氧化钠溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O D.小苏打溶液与稀硫酸混合:CO32-+2H+ = CO2↑+H2O 11.已知A、B、C、D、E均为含氯元素的化合物,在一定条件下有下列转化关系(未配平): ①A→B+NaCl ②B+H2O→C+H2 ③D+NaOH→A+B+H2O ④E+NaOH→B+C+H2O 这五种化合物中Cl元素化合价由高到低的顺序是( ) A.D、A、B、E、C B.C、E、B、D、A C.A、D、B、E、C D.C、E、D、B、A 12.在新制的漂白粉溶液中,下列各组离子能大量共存的是( ) A.Na+、K+、CO32-、NO3- B.Na+、Ag+、NO3-、OH- C.K+、Na+、NO3-、CH3COO- D.H+、NH4+、NO3-、Na+ 13.下列4种鉴别碳酸钠和碳酸氢钠的方法中,不正确的是( ) A.在等浓度溶液中滴加澄清石灰水观察是否有沉淀产生 B.在在等浓度溶液中滴加BaCl2溶液观察是否有沉淀产生 C.在等浓度溶液中滴入几滴酚酞比较溶液颜色深浅 D.取少量的固体试样加热后称量质量变化 14.Cu与HNO3反应时,Cu被HNO3氧化成Cu(NO3)2,又知该反应中氧化剂和还原剂的个数比为 2:3,则该反应中的还原产物是( ) A.NO2 B.NH4NO3 C.N2 D.NO 15.反应3Cl2+8NH3=6NH4Cl+N2常用于判断氯气管道是否漏气,下列对于这一反应的叙述正确的是( ) A.Cl2是还原剂 B.NH3中部分N元素被氧化 C.NH4Cl既是氧化产物又是还原产物 D.作氧化剂和作还原剂微粒数之比是3:8 16.实验表明:将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,内环呈白色外环呈红色或浅红色,下列有关说法中不正确的是( ) A.内外环颜色的差异表明氯水中含有H+和HClO等粒子 B.Cl2和水的离子方程式为:Cl2+H2O=2H++Cl-+ClO- C.此实验表明氯水具有酸性、漂白性 D.内外环上颜色的差异表明此变化过程中,指示剂显色反应比氧化还原反应快 17.已知还原性S2->I->Fe2+>Br->Cl-,下列判断不正确的是( ) A.Fe3+与I-在水溶液中不能大量共存 B.氧化性:Cl2>Br2>I2 C.将足量Br2加入到FeCl2溶液中,离子反应方程式为Br2+2Cl-═2Br-+Cl2 D.将Cl2通入到FeBr2溶液中,Cl2应优先氧化Fe2+,再氧化Br- 18.为实现“绿色化学实验”进课堂,某化学教师为“氯气与金属反应”设计了如图装置的实验。实验操作:先给钠预热,等钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述中错误的是( ) A.钠着火燃烧产生苍白色火焰 B.反应生成的大量白烟是氯化钠晶体 C.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气 D.用湿润的淀粉KI试纸靠近管口,可根据其颜色变化判断氯气是否被碱液完全吸收 第Ⅱ卷 非选择题部分 二、填空题(共4小题,共46分) 19.(8分)以下为中学化学中常见的几种物质:①NaOH溶液 ②铜丝 ③Ba(OH)2固体 ④无水乙醇 ⑤稀硫酸 ⑥氯水 ⑦氨水 ⑧SO2 ⑨硫酸钡晶体 ⑩熔融NaCl。 (1)上述状态下可导电的 (填序号,下同); 上述状态下不能导电的电解质是 。 (2)写出⑤和⑦发生反应的离子方程式 。 (3)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是______。 第 4 页 共 4 页 铁人中学2020级高一学年上学期月考化学试题 20.(14分)如图是一套制取并验证氯气部分化学性质的实验装置。已知:Cl2+2KI = I2+2KCl。 回答下列问题: (1)装置A中,仪器a的名称叫________,该仪器中盛放的试剂为________,写出A装置发生反应的离子方程式:________________________________。 (2)装置B的作用是______________________________。 (3)当有少量Cl2通过后,观察到装置C中溶液变成________色。 (4)当Cl2持续通过时,装置D中干燥的有色布条能否褪色?为什么?__________,_________________________________________________________________。 (5)若要证明Cl2无漂白性,则必须在装置D之前加一个 。 (6)装置E的作用是____________________________________,该反应的离子方程式为______________________________________。 (7)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下。 注意事项: 1.本品对棉织品有漂白脱白作用,对金属制品有腐蚀作用。 2.密封保存,请勿与洁厕灵同时使用。 3.保质期为一年。 消毒液与洁厕灵不能同时使用,原因是(用离子方程式表示)_____________________________。 21.(10分)在肉制品加工中,常使用来硝酸钠作发色剂,但必须严格控制亚硝酸钠的用量,以确保使用安全。亚硝酸钠也是一种常见的水污染物,在工业废水中亚硝酸盐的含量较高,如不做处理排放在环境中,对人体、水生物有毒害作用。 Ⅰ.某一反应体系中反应物和生成物共六种:NaNO2 、H2O、NO 、I2、NaI、HI。已知该反应中 NaNO2只发生还原反应。 (1) 该反应的还原剂__________ 。 (2)写出该反应的化学方程式 ,该反应中,氧化剂和氧化产物的微粒数之比为 ,当有n个氧化产物生成时,转移电子数为____e-。 (3)HI在上述反应中表现出的性质是____________________。 (4)误食 NaNO2 会导致血红蛋白中 Fe2+转化 Fe3+而中毒,服用维生素 C 可以解除 NaNO2 引起的中毒。下列关于上述中毒、解毒过程的说法中正确的是_________。 A.中毒过程NaNO2 是还原剂 B.解毒过程维生素 C 是还原剂 C.解毒过程,维生素 C 能把 Fe2+氧化 Fe3+ D.中毒时亚硝酸盐发生还原反应 Ⅱ.工业废水中亚硝酸盐的处理这一研究已有很久的历史了,传统常见的方法有离子交换法、反渗透法、电渗析法、生物及反硝化法、化学还原法和化学催化硝化法,其中化学还原法是利用加NH4Cl进行处理含亚硝酸盐的废水,转化为无污染的物质进行排放。 (5)写出该处理方法的离子方程式________________________________________。 22.(14分) Ⅰ.A、B、C、D、E五瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3、AgNO3中的一种。已知:①A与B反应有气体生成;②B与C反应有沉淀生成;③C与D反应有沉淀生成;④D与E反应有沉淀生成;⑤A与E反应有气体生成;⑥在②和③的反应中生成的沉淀是同一种物质。请填空: (1)在②和③的反应中,生成的沉淀物质的化学式是 。 (2)C是 ,D是 。 (3)A与E反应的离子方程式是 。 (4)写出NaHSO4在溶液中的电离方程式 。 Ⅱ.某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种。请填写下列空白: (5)不做任何实验就可以肯定原溶液中不存在的离子 。 (6)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中,肯定存在的离子是________,有关离子方程式为______________________________。 (7)取(6)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明原溶液中肯定有________,有关的离子方程式为 。 (8)原溶液可能大量存在的阴离子是下列的 。 A.Cl- B.NO3- C.CO32- D.OH- 第 4 页 共 4 页 铁人中学2020级高一学年上学期月考化学试题 铁人中学2020级高一学年上学期月考 化学试题答案 一、 选择题 题号 1 2 3 4 5 6 答案 D A C B C B 题号 7 8 9 10 11 12 答案 C D C C B C 题号 13 14 15 16 17 18 答案 A D B B C A 二、 非选择题 19. (8分,每空2分) (1) ①②⑤⑥⑦⑩ ③⑨ (2) H++NH3·H2O=NH4++H2O (3) ①⑤ 20. (14分) (1) 分液漏斗(1分) 浓盐酸(1分) MnO2+4H++2Cl-Mn2++Cl2↑+2H2O(2分) (2) 吸收Cl2中的氯化氢(1分) (3)蓝(1分) (4)能(1分)因为Cl2与带出的H2O(g)反应生成HClO,使有色布条褪色(1分) (5)装有浓硫酸的洗气瓶 (1分) (6)吸收多余的氯气 或吸收尾气 (1分) Cl2+2OH-=Cl-+ClO-+H2O (2分) (7)ClO- + Cl- +2H+= Cl2↑+H2O (2分) 21.( 10分) (1)HI(1分) (2)2NaNO2+4HI═2NO↑+I2+2NaI+2H2O (2分) 2:1 (1分) 2n (1分) (3)还原性和酸性 (1分,漏写不给分) (4)BD (2分,写对一个给1分) (5)NO2- + NH4+ = N2↑+2H2O (2分) 22.(14分) (1)AgCl (1分) (2)AgNO3(1分)BaCl2(1分) (3)CO32-+2H+ = H2O+CO2↑(2分) (4)NaHSO4 =Na++H++SO42- (1分) (5)Cu2+、Fe3+ (1分) (6)Ag+ (1分) Ag++Cl-=AgCl↓ (2分) (7)Mg2+(1分) Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+ (2分) (8)B(1分) 第 4 页 共 4 页查看更多