- 2021-04-14 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高三化学迎高考冲刺卷三
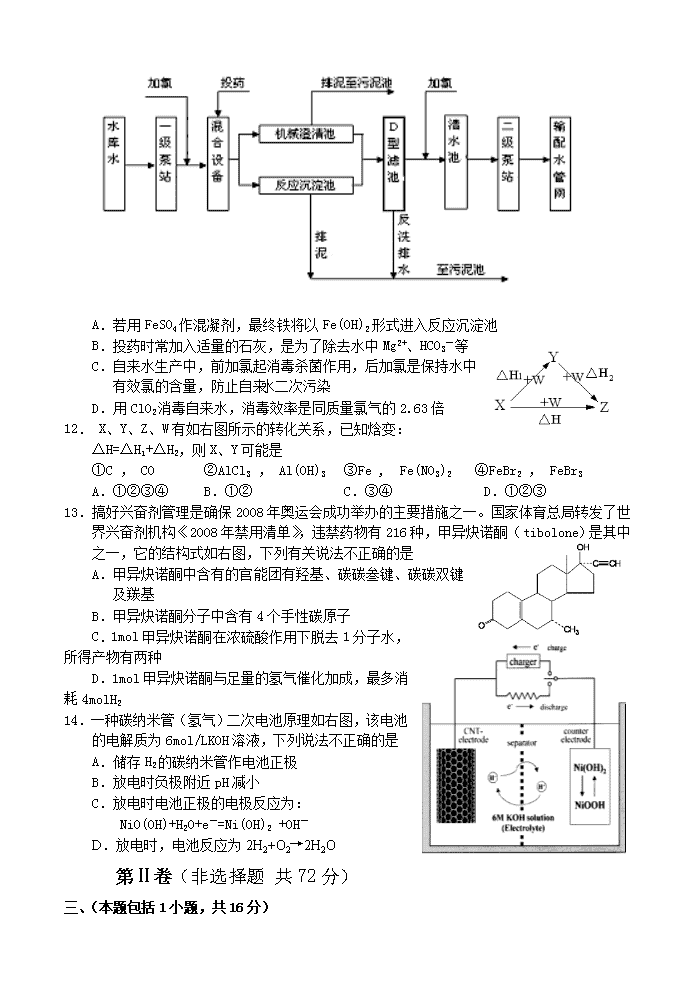
2008年高三化学迎高考冲刺卷三 第Ⅰ卷 (选择题共48分)(盐城)5.15 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 一、选择题(本题包括8小题,每小题3分,共24分。每小题只有1个选项符合题意) 1.6月5日是世界环境日,今年世界环境日主题是 “促进低碳经济”。 下列行为中不符合“促进低碳经济”宗旨的是 A.提高能源效率、寻找替代能源、保护森林以及生态友好型消费 B.推广以液化石油气代替天然气作民用燃料 C.推广利用二氧化碳与环氧丙烷和琥珀酸酐的三元共聚物的生物降解材料 D.推广“绿色自由”计划,吸收空气中CO2并利用廉价能源合成汽油 2.下列有关说法不正确的是 A.能使品红试液褪色的气体不一定是SO2 B.胶黏剂UF结构为:,可推测其单体为尿素和甲醇 C.CO2电子式为 D.命名为4-甲基-2-戊烯 3.下列实验操作正确的是 A.用蒸发溶剂的方法,将氯化铁稀溶液蒸发浓缩为饱和溶液 B.氢氟酸储存在带玻璃塞的棕色试剂瓶中 C.金属钾储存在煤油中 D.实验室制取乙烯时,常含有少量的CO2、SO2及H2O(g)杂质,可依次通过高锰酸钾溶液和碱石灰得较纯净的乙烯气体 4.LiAlH4()、LiH是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4 在125℃分解为LiH、H2和Al。下列说法不正确的是 A.LiH与D2O反应,所得氢气的摩尔质量为4g/mol B.1molLiAlH4 在125℃完全分解,转移3mol电子 C.LiAlH4溶于适量水得到无色溶液,则化学方程式可表示为:LiAlH4+2H2O=LiAlO2+4H2↑ D.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 5.X、Y、Z是三种短周期元素,在周期表中的相对位置如图所示,有关说法正确的是 X Y Z A.X、Y、Z可以都是金属 B.原子半径Z>Y>X C.最高价氧化物对应的水化物酸性Z>Y>X D.X、Y、Z可形成分子,若Z、X原子满足8电子结构,则Y原子也满足8电子结构 6.在含有大量Na+和NO3-的溶液中,能大量共存的离子组是 A.H+ Fe3+ ClO- Cl- B.H+ NH4+ Fe2+ Br- C.Ag+ K+ CO32- SO42- D.K+ AlO2- Cl- OH- 7.下列说法不正确的是 A.BaCrO4(s) Ba2+(aq)+ CrO42- (aq)的平衡体系中,加入BaCl2浓溶液沉淀量增多 B.pH=2的酸溶液与pH=12的强碱溶液等体积混合,所得溶液pH≤7 C.苯酚显色原理为:6C6H5OH+Fe3+Fe(C6H5O)63-(紫色)+6H+,则检验水杨酸()中的酚羟基,需加入适量的小苏打溶液后,再加入氯化铁溶液 D.某试液中加入盐酸酸化的氯化钡溶液有白色淀淀,该试液中一定含有SO42- 8.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是 A.2.24LCl2中含有的原子数一定为0.2 ×6.02×1023 B.0.1L2mol·L-1的Na2CO3溶液中含有的CO32-数目为0.2 ×6.02×1023 C.0.88gC3H8中含有的共价键总数目为0.2 ×6.02×1023 D.7.8g过氧化钠粉末与水反应转移的电子数为0.2 ×6.02×1023 二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分) 9.下列离子方程式不正确的是 A.用两个铜电极电解食盐水:2Cl-+2H2O 2OH- + H2↑+ Cl2↑ B.AgCl悬浊液中加入硫化钠饱和溶液:2AgCl + S2-=Ag2S +2Cl- C. Ca(HCO3)2溶液中加入过量KOH溶液:Ca2+ + HCO3- +OH- =CaCO3↓+ H2O D.Fe(OH)3溶于过量的HI溶液:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O 10.早在1807年化学家戴维用电解熔融氢氧化钠制得钠, 4NaOH(熔) 4Na + O2↑+ 2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为: 3Fe+4NaOHFe3O4+2H2↑十4Na↑。下列有关说法正确的是 A.电解熔融氢氧化钠制钠,阳极发生电极反应为: 2OH--2e-=H2↑+O2↑ B.盖·吕萨克法制钠原理是利用铁的还原性比钠强 C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数也相同 D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 11.自来水加工处理流程如下,下列有关说法不正确的是 A.若用FeSO4作混凝剂,最终铁将以Fe(OH)2形式进入反应沉淀池 B.投药时常加入适量的石灰,是为了除去水中Mg2+、HCO3-等 C.自来水生产中,前加氯起消毒杀菌作用,后加氯是保持水中有效氯的含量,防止自来水二次污染 D.用ClO2消毒自来水,消毒效率是同质量氯气的2.63倍 12. X、Y、Z、W有如右图所示的转化关系,已知焓变: △H=△H1+△H2,则X、Y可能是 ①C , CO ②AlCl3 , Al(OH)3 ③Fe , Fe(NO3)2 ④FeBr2 , FeBr3 A.①②③④ B.①② C.③④ D.①②③ 13.搞好兴奋剂管理是确保2008年奥运会成功举办的主要措施之一。国家体育总局转发了世界兴奋剂机构《2008年禁用清单》,违禁药物有216种,甲异炔诺酮(tibolone)是其中之一,它的结构式如右图,下列有关说法不正确的是 A.甲异炔诺酮中含有的官能团有羟基、碳碳叁键、碳碳双键及羰基 B.甲异炔诺酮分子中含有4个手性碳原子 C.1mol甲异炔诺酮在浓硫酸作用下脱去1分子水,所得产物有两种 D.1mol甲异炔诺酮与足量的氢气催化加成,最多消耗4molH2 14.一种碳纳米管(氢气)二次电池原理如右图,该电池的电解质为6mol/LKOH溶液,下列说法不正确的是 A.储存H2的碳纳米管作电池正极 B.放电时负极附近pH减小 C.放电时电池正极的电极反应为: NiO(OH)+H2O+e-=Ni(OH)2 +OH- D.放电时,电池反应为2H2+O2→2H2O 第Ⅱ卷(非选择题 共72分) 三、(本题包括1小题,共16分) 15.(16分)选择性催化还原(SCR)是在有催化剂的条件下将NOx 转变为N2和H2O,这是目前国外硝酸厂进行尾气治理所普遍采用的一种方法。 某校甲、乙两个化学兴趣小组拟验证NO能被氨气还原并测算其转化率。 (一)甲组拟制取活性亚铬酸铜催化剂 亚铬酸铜(Adkin催化剂)是极好的NO催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:CuO·Cr2O3等,统称为亚铬酸铜。该组同学取一定量硝酸铜溶液(并加少量硝酸钡作稳定剂)、 重铬酸铵溶液与氨水作用得土黄色沉淀, 将沉淀物[经测定为:碱式铬酸铜铵(CuNH4(OH)CrO4 )]过滤、洗涤,80℃烘干12h, 最后焙烧。 (1)过滤用到的玻璃仪器有: (选填序号,下同);焙烧用到的仪器有: 。 A.蒸发皿 B.石棉网 C.泥三角 D.烧杯 E.坩埚钳 F.酒精灯 G.玻璃棒 H.漏斗 I.坩埚(部分仪器已略去) (2)CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,该反应的化学方程式: 。 (二)乙组拟用甲组制得催化剂按下列流程进行实验。 试回答下列问题: (3)若制取氨气在A装置,则发生反应的化学方程式为: ; 若用B装置制取氨气,则分液漏斗和锥形瓶中盛放的药品分别是: 。 (4)用图C装置制取NO时,用可抽动的铜丝其优点是: ; (5)装置⑦的作用可能是: 。 (6)若进入装置⑤的NO共2688mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下2016mLN2,则NO的转化率为: 。 四、(本题包括2小题,共16分) 16.(10分)现有部分短周期元素的性质或原子结构如下表: 元素编号 元素性质或原子结构 T 能形成双原子分子,原子间存在3对共用电子对 X M层有3个电子 Y 最外层电子数是最内层电子数2倍,其最高氧化物是一种固体,用于生产光导纤维 Z 最高正价为+7价 (1)写出元素Z的离子结构示意图 。 Y的最高价氧化物中,化学键Y—O的物质的量与Y的物质的量之比为: (填数字)。 (2)X的最高价氧化物与烧碱反应的离子反应方程式为: 。 (3)Z的非金属性比T元素强,用化学方程式表示: 。 (4)XT是一种新型的无机材料,可由X的最高价氧化物与T的单质及焦炭反应生成,逸出的气体具有可燃性,写出反应方程式,并标出电子转移方向和数目。 。 17.(6分) 化肥在农业生产中占有重要位置,目前使用的合成氨催化剂是由四氧化三铁主催化剂和助催化剂(万分之一氧化铝和万分之一氧化钾等)组成。N2和H2在催化剂表面反应机理如下(Cata是catalyst缩写,表示催化剂): ①N2(g)+Cata→2N(Cata) ②H2(g)+Cata→2H(Cata) ③N(Cata)+H(Cata)→NH(Cata) ④NH(Cata)+H(Cata)→NH2(Cata) ⑤NH2(Cata)+H(Cata)→NH3(Cata) ⑥… 试探究下列问题: (1)请补充⑥(最后一步反应)机理的式子: ; (2)从共价键键能分析,可能最慢的一步是: (填数字),该过程: (填放热或吸热)。 (3)石灰氮是一种氮素肥效长的肥料,同时也是一种低毒﹑无残留的农药,它可由电石与氮气反应得到,石灰氮中阳离子与阴离子具有相同的质子总数,试写出制备石灰氮的化学方程式: 。 (4)某研究性学习小组拟用甲醛法测定常见铵态氮肥的含氮量,(资料支撑: 4NH4+ + 6HCHO = (CH2)6N4H+ + 3H+ + 6H2O,所生成的H+和(CH2)6N4H+可用NaOH标准溶液滴定,采用酚酞作指示剂)。用甲醛法测定含氮量,不适合的铵盐是: (选填序号)。 A.NH4Cl B.(NH4)2SO4 C.NH4NO3 D.NH4HCO3 五、(本题包括2小题,共16分) 18.(8分)绿色有机合成是指采用无毒、无害的原料、催化剂和溶剂,选择具有高选择性、高转化率,不生产或少生产对环境有害的副产品合成。下列是BHC公司新发明的布洛芬(Ibuprofen)绿色合成方法。 试回答下列问题: (1)反应③属于羰基合成,反应①、②分别所属的有机反应类型是: 、 。 (2)反应①的化学方程式为: 。 (3)与布洛芬互为同分异构体的芳香族化合物中,其结构可表示为的酯类,X的结构 有: 种(填数字)。 (4)某学生提议用Reppe反应一步合成布洛芬,并使原子利用率100%,已知:RCH=CH2+CO+H2O RCH(CH3)COOH,请一种有机原料合成布洛芬: ▲ 19.(8分)TBC是优良的增塑剂,具有很好的相容性,且挥发性小、耐寒、耐光及耐水等,广泛用于医学卫生用品,它的结构式如右图,合成时柠檬酸与正丁醇合成数据如下: 下表中实验数据均为用活性炭固体杂多酸作催化剂,实验时催化剂总量占原料的1%,实验结果如下表。表1:酸醇物质的量之比对酯化率的影响;表2:酯化时间对酯化率的影响;表3:酯化率随温度变化情况。 表1 n(酸)︰n(醇) 1︰5.0 1︰5.5 1︰6.0 1︰6.5 1︰7.0 酯化率/% 95.1 96.3 97.0 97.4 97.2 表2 时间/h 0.5 1.0 2.0 3.0 5.0 酯化率/% 40.0 70.2 94.3 97.4 97.4 表3 温度/℃ 130 140 145 150 160 酯化率/% 89.5 96.2 97.4 97.4 97.2 试回答下列问题 (1)酯化反应适宜的条件n(酸)∶(醇)、时间/h、温度/℃分别是: (选填序号)。 A.1∶5,1,130 B.1∶5.5 ,1,140 C.1∶7 ,2,160 D.1∶6.5 ,3,145 (2)TBC的一种标准谱图如右,它是 (A、1H-NMR图谱 B、红外光谱 C、质谱) (3)TBC与足量NaOH溶液反应的化学方程式: 。 (4)柠檬酸的一种同分异构体A,能发生如下转化: A可能的结构式为: (只写一种)。 六、(本题包括1小题,共12分) 20.(12分)煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。 已知:CO(g)+H2O(g)H2(g)+CO2(g)的平衡常数随温度的变化如下表: 温度/℃ 400 500 800 平衡常数Kc 9.94 9 1 试回答下列问题 (1)上述正向反应是: 反应(选填:放热、吸热)。 (2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动 的有 (选填A、B、C、D、E)。 A B C D E n(CO2) 3 1 0 1 1 n(H2) 2 1 0 1 2 n(CO) 1 2 3 0.5 3 n(H2O) 5 2 3 2 1 (3)已知在一定温度下:C(s)+CO2(g) 2CO(g)平衡常数K; C(s) + H2O(g) CO(g)+H2(g) 平衡常数K1; CO(g)+H2O(g)H2(g)+CO2(g) 平衡常数K2 , 则K、K1、K2之间的关系是: 。 (4)若在500℃时进行,若CO、H2O的起始浓度均为0.020 mol/L,在该条件下,CO的最大转化率为: 。 (5)若在800℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y= 。 (6)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃ 达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K= 。 七、选做题(下列A、B两题分别对应于“物质的结构与性质”和“实验化学”两个选修课程模块的内容,考生只要选择其中的一题作答,如果两题全做,则一律按第一题评分。共12分) 21A.《物质的结构与性质》(12分) 砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如右图。试回答下列问题 (1)下列说法正确的是 (选填序号)。 A.砷化镓晶胞结构与NaCl相同 B.第一电离能:As>Ga C.电负性:As>Ga D.砷和镓都属于p区元素 E.半导体GaP、SiC与砷化镓为等电子体 (2)砷化镓是将(CH3)3Ga和AsH3用MOCVD方法制备得到, 该反应在700℃进行,反应的方程式为: 。 AsH3空间形状为: (CH3)3Ga中镓原子杂化方式为: 。 (3)Ga的核外电子排布式为: 。 (4)AsH3沸点比NH3低,其原因是: 。 高三化学冲刺卷三化学答案及评分标准 1.B 2.B 3.C 4.A 5.A 6.D 7.D 8.C 9.AC 10.D 11.A 12.A 13.BC 14.AD 15.(本题共16分,每空均2分) (1)D、G、H ; C、E、F、G、I(多选少选均不给分)。 (2)2Cu(OH)NH4CrO4Cr2O3·2CuO+N2↑+5H2O(产物写错、不配平不给分)。 (3)2NH4Cl+Ca(OH)2CaCl2+2NH3↑ +2H2O;浓氨水、碱石灰(生石灰或氢氧化钠固体) (4)反应可以随时关停、操作方便、反复使用、节约药品。 (5)吸收未反应的NO (6)90% 16.(本题共10分,每空均2分) (1) ;4 (2)Al2O3+2OH-=2AlO2-+H2O (3)3Cl2 +2NH3=N2+6HCl(或3Cl2+8NH3=N2+6NH4Cl); (4) (写方程式和标电子转移方向各1分) 17.(本题共6分) (1)NH3(Cata)→NH3(g) +(Cata);(1分) (2)①;吸热;(各1分,共2分) (3)CaC2 + N2→CaCN2 + C,(2分) (4)D(1分) 18.(本题共8分) (1)取代反应、加成反应 (每空1分,共2分) (2)(2分,缺少乙酸不给分) (3)6(2分); (4)(2分) 19.(本题共8分,每空均2分) (1)D ; (2)B (3) (4) (只要写出合理的结构式均给分)。 20.(本题共12分,每空均2分) (1)放热 (2)BCE(多选、漏选及错选均不给分) (3)K=K1/K2 (4)75% (5)y=x (6)0.44(或4/9) 21A.(本题12分,每空均2分) (1)BCDE(多选少选均不给分) (2)(CH3)3Ga+AsH3 GaAs+3CH4 (或:)。三角锥,sp2 (3)1s22s22p63s23p63d104s24p1 (4)NH3分子间能形成氢键,而As电负性小,半径大,分子间不能形成氢键。查看更多