- 2021-04-14 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广东大埔华侨二中2020届高三1月月考化学试题
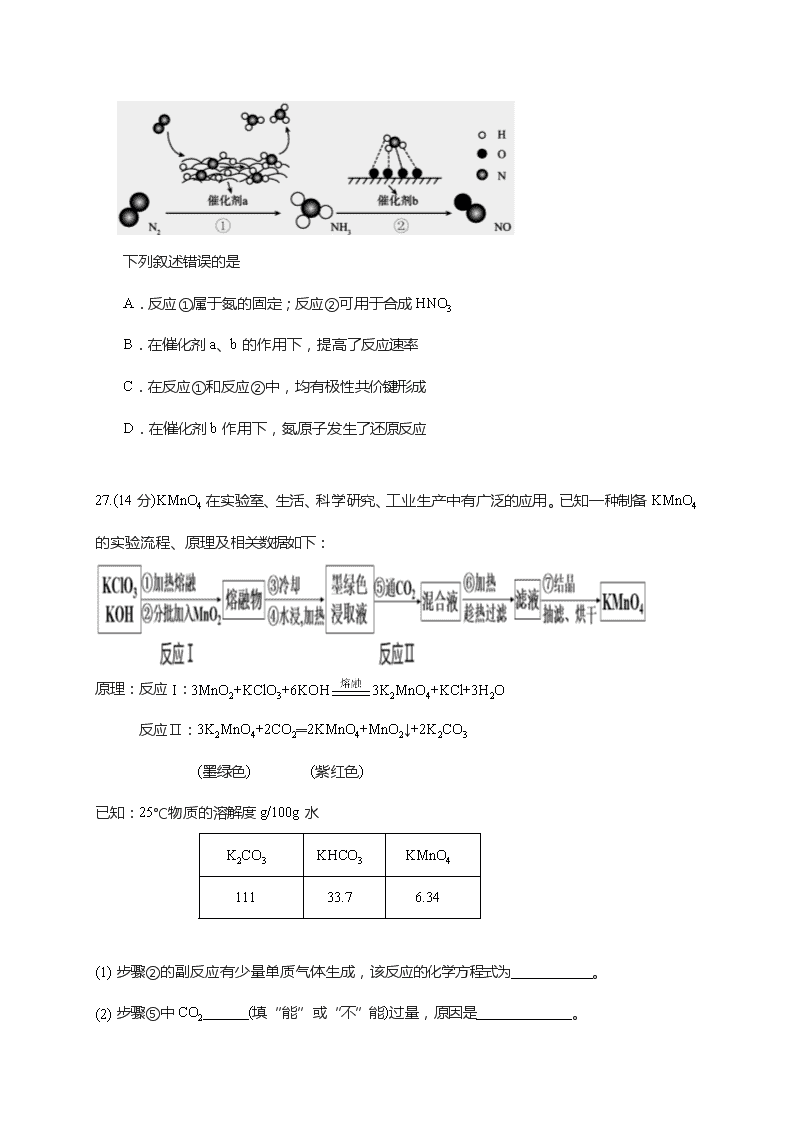
广东大埔华侨二中2020届高三1月化学测试题 相对原子质量:C 12 Na 23 O 16 K 39 Mn 55 Fe 56 一、选择题 7.含有对氯苯酚和醋酸钠的废水净化原理如图所示。下列说法错误的是 A.本装置集净化、供电于一体,产物之一还有消毒作用 B.每消耗1molCH3COO-,通过质子交换膜的质子的物质的量为8mol C.在该装置中,B极上的电势比A极上的电势高 D.A极的电极反应为 8.五种短周期主族元素的关系如图所示。TX2是制光导纤维制品的主要原料。下列说法中错误的是 A.Y是非金属性最强的元素 B.R与X形成的化合物是一种两性化合物 C.T的晶体是一种重要的半导体材料 D.简单离子半径Y比Z、R的都小 9.25℃时,进行下图所示滴定并得到对应曲线。下列说法错误的是 A.Ka2(H2C2O4)=10-4.19 B.直线Ⅰ中X= C.在NaHC2O4溶液中c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-) D.Ⅰ、Ⅱ两条直线的斜率均为1 10.已知苯乙烯和立方烷的结构分别为(b)、(p)。 下列说法中正确的是 A. b、p难溶于苯 B. b、p互为同分异构体 C. b、p的一氯代物分别有6种和1种(不考虑立体异构) D. b、p均不能使酸性KMnO4溶液退色 11.下列说法错误的是 A.建筑钢筋属于金属材料 B.制玻璃和水泥都要用到石灰石 C.天然气、水煤气、液化石油气均是化合物 D.聚乙烯、纤维素都属于高分子化合物 12.设NA为阿伏加德罗常数的值,下列说法正确是 A. 12g金刚石中含有共价键数目为4NA B. 标况下2.24LSO3含有的氧原子数目为0.3 NA C. 1 L 0.1 mol·L-1NH4NO3溶液中含有氮原子总数为0.2NA D. 电解熔融氯化钠,当阳极生成2.24L氯气时,阴极产生0.1NA个Na 13.下图为N2分子在催化剂的作用下发生的一系列转化示意图: 下列叙述错误的是 A.反应①属于氮的固定;反应②可用于合成HNO3 B.在催化剂a、b的作用下,提高了反应速率 C.在反应①和反应②中,均有极性共价键形成 D.在催化剂b作用下,氮原子发生了还原反应 27.(14分)KMnO4在实验室、生活、科学研究、工业生产中有广泛的应用。已知一种制备KMnO4的实验流程、原理及相关数据如下: 原理:反应I:3MnO2+KClO3+6KOH3K2MnO4+KCl+3H2O 反应Ⅱ:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3 (墨绿色) (紫红色) 已知:25℃物质的溶解度g/100g水 K2CO3 KHCO3 KMnO4 111 33.7 6.34 (1) 步骤②的副反应有少量单质气体生成,该反应的化学方程式为___________。 (2) 步骤⑤中CO2______(填“能”或“不”能)过量,原因是_____________。 (1) 流程中可循环利用的物质主要是_________(写化学式)。 (2) 忽略本流程中含锰物质的循环利用,理论上0.3mol MnO2最多得到产品KMnO4的质量为________g。某同学在实验中得到干燥产品的质量多于理论值,排除称量因素,从步骤⑦分析,可能的原因是_______________。 (3) 草酸钠滴定法分析高锰酸钾纯度步骤如下: Ⅰ.称取1.5800g高锰酸钾产品,配成100mL溶液 Ⅱ.准确称取三份0.5360g已烘干的Na2C2O4,置于三个不同的洁净锥形瓶中,分别加入少量蒸馏水使其溶解,再加入少量硫酸酸化;各 Ⅲ.锥形瓶中溶液加热到75~80℃,趁热用I中配制的高锰酸钾溶液滴定至终点。 记录实验数据如表 实验次数 V1(滴定前读数/mL) V2(滴定后读数/mL) (V2 -V1)/mL 1 2.65 22.67 20.02 2 2.60 23.02 20.42 3 2.60 22.58 19.98 已知:2MnO4﹣+ 5C2O42﹣+16H+ ═ 2Mn2++ 10CO2↑+ 8H2O 则KMnO4的纯度为__________(保留四位有效数字);若滴定后俯视滴定管读数,所得KMnO4的纯度将___(填“偏高”或“偏低”或“无影响”)。 28.(14分)锡酸钠用作媒染剂,纺织品的防火剂、增重剂,以及制造陶瓷、玻璃和用于镀锡等。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠(Na2SnO3)的工艺流程图如下: 请回答下列问题: (1) Sb(ⅤA)最高正化合价为_____。 (2) 流程中“脱砷、脱铅、脱锑”均要涉及的分离实验操作是_________。 (3)“碱浸”时,若SnO含量较高,工业上则加入NaNO3除去SnO,且检测到有NH3生成,① 该反应的离子方程式为____________________; ② 如图是“碱浸”实验的参数,请选择“碱浸”的合适条件__________。 (3) “脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为________。 (4) “脱锑”时发生的主要化学反应属于_________。 A.置换反应 B.氧化还原反应 C.非氧化还原反应 (6) 硫酸盐光亮镀锡液成分简单,主要有硫酸亚锡、硫酸等成分。镀锡液中硫酸的作用是__________;镀锡时阳极反应式为______________。 29.(15分)研究发现,反应CCl4(g)+H2(g)CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等) ⑴ CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则: CCl4(g)+H2(g)CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示) ⑵在密闭容器中,CCl4+H2CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。 实验 序号 温度 /℃ 初始CCl4浓度/ (mol·L-1) 初始H2浓度/ (mol·L-1) CCl4的平 衡转化率 1 110 0.8 1.2 α1 2 110 1 1 50% 3 100 1 1 α3 ① 实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。② 实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为 mol· L-1·min-1。 ③ 110 ℃时,该反应的化学平衡常数的数值为________。 ④ 实验3中,α3的值________。 A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断 ⑶ 120 ℃时,分别进行H2的初始浓度为2 mol·L-1和4 mol·L-1的实验(其他条件相同)。测得CCl4的消耗百分率(x%,实线)和生成物中CHCl3的百分含量(y%,虚线)随时间(t)的变化关系如图。 ① 图中表示H2起始浓度为2 mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。 ② 依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。 34.(15分)亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝) +3KCl,回答问题: (1) 写出基态Fe3+的核外电子排布式_________。 (2) K4[Fe(CN)6]中的作用力除共价键外,还有______和________。含有12molσ键的K4[Fe(CN)6的物质的量为________mol。 (1) 黄血盐中N原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为_____,电负性由大到小的排序为________。 (2) Fe、Na、K的晶体结构如图所示。 ① 钠的熔点比钾更高,原因是__________________________. ② Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______g/cm3。 35.(15分)以苯和丙酮为原料合成化妆品中间体M路线如下: 已知: ① R—CH==CH—R′+ (R、R′代表烃基或氢原子) (1) A的结构简式为 ,A中含有的官能团名称是__________。 (2) 生成A和C的反应类型依次是____、_____。中间体M的分子式为_______。 (3) 写出流程中由苯生成D的化学方程式:___________________________。 (4) C为二烯烃(C8H14),写出符合下列条件的C的一种同分异构体的结构简式 。 ① 含有六个碳形成的碳环 ② 核磁共振氢谱图中显示有四组峰,且峰面积之比为3∶2∶1∶1 (5) 设计以乙醛(CH3CHO)、C2H2为原料制备的合成路线(用流程图表示,无机试剂任选):____________________________________。 答案与评分标准 7 8 9 10 11 12 13 C D B B C C D (注:主观题回答合理的可给分,化学方程式或离子方程式没有配平的扣1分) 27. (14分) ⑴ 2KClO32KCl + 3O2↑ (2分) ⑵ 不能 (1分) CO2(过量)+KOH = KHCO3,因生成KHCO3的溶解度比 K2CO3的小,可能在KMnO4析出时结晶析出而影响产品的纯度。 (2分) ⑶ MnO2 (2分) ⑷ 31.6 (2分) 蒸发过度,使K2CO3伴随KMnO4析出 (2分) ⑸ 80.00% (,或0.8000,2分);偏高 (1分) 28. (14分) (1) +5 (1分) (2) 过滤 (1分) (3) ① 4SnO+NO3-+7OH-=NH3↑+4SnO32- +2H2O (2分) ② c(OH-)=2.5mol/L、温度85 ℃ (2分) (4) PbO+S2-+2H2O===PbS↓+4OH- (2分) (5) A B (2分选1个对的给1分,全对的给2分,凡有错不得分) (6) 抑制Sn2+的水解,促进阳极Sn的溶解(2分); Sn-2e-=Sn2+ (2分) 29. (15分) ⑴ △H2 -△H1+2△H3 (2分) ⑵ ① 大于 (2分) ② 5/6×10-3 (或0.00083,2分,合理给分) ③ 1 (2分) ④ D (3分) ⑶ ① d (2分) ② 4 (2分) 35.(15分) ⑴ 1s22s22p63s23p63d5 或[Ar]3d5 (1分) ⑵ 配位键、离子键 (2分) 1 (2分) ⑶ sp (2分) N>O>C (2分) O>N>C (2分) ⑷ ①Na的半径小,形成的金属键键能大,熔点高 (2分) ② (2分) 36.(15分) (1) 或 (2分) 羟基、碳碳三键(或碳碳叁键) (2分) (2) 加成反应、消去反应 (2分) C16H24 (2分) (3) (2分) (4) (2分) (5) (3分)查看更多