- 2021-04-14 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学试题单元汇编
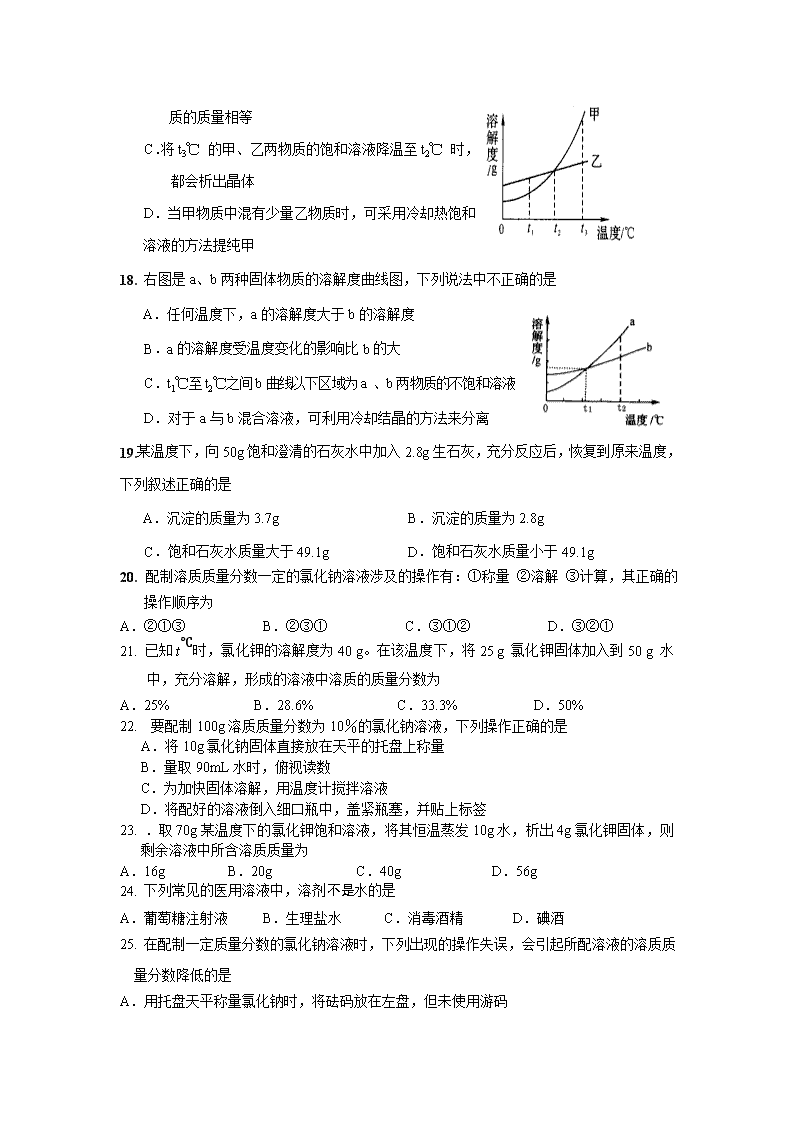
中考化学试题单元汇编(7) 1.下列关于海水晒盐原理的分析,正确的是 A.利用阳光照射使海水升温得到食盐 B.利用机械动力搅拌得到食盐 C.利用阳光和风力将水分蒸发得到食盐 D.利用海水在阳光下发生分解反应制得食盐 2..某溶液甲,经过若干操作,析出10g晶体后变成溶液乙(甲、乙两溶液为同种溶质),下列说法正确的是 A.甲一定是饱和溶液 B.溶液的溶质质量分数:乙不一定小于甲 C.乙一定是饱和溶液 D.溶液的溶质质量分数:乙一定小于甲 3. 生活中常见的下列物质,属于溶液的是 A. 牛奶 B. 泥水 C. 蔗糖水 D. 花生油 4. 配制一定溶质质量分数的氯化钠溶液,操作顺序正确的是 A. 计算、溶解、称量、量取 B. 溶解、量取、计算、称量 C. 计算、称量、量取、溶解 D. 称量、量取、溶解、计算 5. 欲配制100kg溶质质量分数为7.1%的KNO3溶液作无土栽培的营养液,需KNO3的 质量为 A. 7.1kg B. 14.2kg C. 71kg D. 92.9kg 6. 分析表中的数据,以下看法不可取的是 A. 生理盐水是依据人体血液的特点配制的 B. 表中三种溶液的含盐质量分数均为0.9%纯属巧合 C. 人类祖先可能是从原始海洋逐渐进化到陆地上的 D. 人体血液与原始海水之间可能有某些尚未认识的关系 7. .甲、乙、丙三种物质在不同温度下的溶解度见下表: 温度 物质 0 30 60 90 甲 13.3 45.8 110 202 乙 35.5 36.0 37.1 38.1 丙 0.18 0.16 0.12 0.08 下列有关说法正确的是 A.甲、乙、丙三种物质的溶解度大小顺序是甲>乙>丙 B.30℃时,三种物质的饱和溶液溶质质量分数甲>乙>丙 C.降低温度可使丙的饱和溶液变为不饱和溶液 D.使甲物质从一定温度下的饱和溶液中析出,一般采用蒸发溶剂的方法 8. 市场上有一种俗称“摇摇冰”的罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动使它们混合,罐内饮料温度就会降低。这种固体物质可能是 A、生石灰 B、烧碱 C、食盐 D、硝酸铵 9. 以下饮料和食品中,属于溶液的是 A、豆浆 B、果酱 C、矿泉水 D、 10. 下列做法能改变溶液中溶质质量分数的是 A、将氯化铵的饱和溶液降温 B、将硝酸钾的饱和溶液升温 C、把氯化钠的饱和溶液恒温蒸发 D、在蔗糖的饱和溶液中再加少量蔗糖 11. 在25℃时,向饱和的澄清石灰水中,加入少量的氧化钙,再恢复到25℃,关于该溶液的下列说法中正确的是 A.溶质的质量不变 B.溶质的质量减少 C.溶质的质量分数减少 D.溶质的质量分数增大 12. 向一接近饱和的KNO3溶液中,逐渐加KNO3体,下列图象中符合溶液中溶质质量变化规律的是( )。 13. t℃时,有两瓶硝酸钾溶液,—瓶是饱和溶液(溶质的质量分数为40%),另一瓶是溶质的质量分数为10%的溶液。下列实验操作中,无法区分这两种溶液的是 A.加一定量的水 B.加入少量硝酸钾晶体 C.降低温度 D.t℃时蒸发少量水 14. 在配制10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的可能原因是:①用量筒量取水时俯视读数 ②配制溶液的烧杯用少量蒸馏水润洗 ③在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数 ④盛装溶液的试剂瓶用蒸馏水润洗 ⑤氯化钠晶体不纯 A.①②③④⑤ B.只有①②④⑤ C.只有①②③ D.只有②③④⑤ 15. 图1中能正确反映题中所描述的变化事实的是 固体质量 溶质质量分数 0 时间 溶质质量分数 0 时间 溶质质量分数% 0 接近饱和的氯化钠溶液 中加入氯化钠固体 A 不饱和硝酸钾溶液升温 B 一定量水中加入浓 硫 酸 C 加热蒸发稀盐酸 D 0 浓硫酸质量 溶质质量分数 图1 16. 某溶质溶解在水中,形成的溶液与水相比较,一定不会改变的是 A.沸点 B.导电性 C.颜色 D.水分子的构成 17. 根据右图的溶解度曲线,判断下列说法中不正确的是 A.t1℃ 时,甲物质的溶解度小于乙物质的溶解度。 B.t2℃ 时,甲、乙两物质的饱和溶液中含甲、乙两物 质的质量相等 C.将t3℃ 的甲、乙两物质的饱和溶液降温至t2℃ 时, 都会析出晶体 D.当甲物质中混有少量乙物质时,可采用冷却热饱和 溶液的方法提纯甲 18. 右图是a、b两种固体物质的溶解度曲线图,下列说法中不正确的是 A.任何温度下,a的溶解度大于b的溶解度 B.a的溶解度受温度变化的影响比b的大 C.t1℃至t2℃之间b曲线以下区域为a 、b两物质的不饱和溶液 D.对于a与b混合溶液,可利用冷却结晶的方法来分离 19.某温度下,向50g饱和澄清的石灰水中加入2.8g生石灰,充分反应后,恢复到原来温度,下列叙述正确的是 A.沉淀的质量为3.7g B.沉淀的质量为2.8g C.饱和石灰水质量大于49.1g D.饱和石灰水质量小于49.1g 20. 配制溶质质量分数一定的氯化钠溶液涉及的操作有:①称量 ②溶解 ③计算,其正确的操作顺序为 A.②①③ B.②③① C.③①② D.③②① 21. 已知t℃时,氯化钾的溶解度为40 g。在该温度下,将25 g 氯化钾固体加入到50 g 水中,充分溶解,形成的溶液中溶质的质量分数为 A.25% B.28.6% C.33.3% D.50% 22. 要配制100g溶质质量分数为10%的氯化钠溶液,下列操作正确的是 A.将10g氯化钠固体直接放在天平的托盘上称量 B.量取90mL水时,俯视读数 C.为加快固体溶解,用温度计搅拌溶液 D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签 23. .取70g某温度下的氯化钾饱和溶液,将其恒温蒸发10g水,析出4g氯化钾固体,则剩余溶液中所含溶质质量为 A.16g B.20g C.40g D.56g 24. 下列常见的医用溶液中,溶剂不是水的是 A.葡萄糖注射液 B.生理盐水 C.消毒酒精 D.碘酒 25. 在配制一定质量分数的氯化钠溶液时,下列出现的操作失误,会引起所配溶液的溶质质量分数降低的是 A.用托盘天平称量氯化钠时,将砝码放在左盘,但未使用游码 B.用量筒量取蒸馏水读数时,仰视凹液面的最低处 C.将量筒中的水倒入烧杯时,有水洒出 D.将配好的氯化钠溶液转移到细口瓶中时,不慎洒出部分溶液 26. 木糖醇是目前市场上一种理想的蔗糖替代品,在某些温度下其溶解度分别为:30℃时70g、50℃时84g,、60℃时90g。右图表示的是木糖醇等固体的溶解度曲线。根据曲线判断下列说法错误的是( ) A.X为木糖醇的溶解度曲线 B.随着温度的升高,Z物质的溶解度逐渐减小 C.30℃时,X、Y、Z三种物质的饱和溶液中溶质质量分数最大的是Y D.50℃时,Y、Z两物质的溶解度相等 27. 将一杯20℃时的硝酸钠饱和溶液变为不饱和溶液,可采用的方法是 A.降低温度 B.加入溶剂 C.倒去一半溶液 D.蒸发溶剂 28. 氯化钠和碳酸钠晶体的溶解度(00C---300C)如下表所示: 00C 100C 200C 300C NaCI(g) 35.7 35.8 36.0 36.3 Na2CO3·10H2O(g) 7.0 12.5 21.5 38.8 根据上表分析下列几种说法: ①碳酸钠晶体的溶解度受温度影响较大 ②将含水各1OOg的氯化钠与碳酸钠的饱和溶液,从300C降至O0C ,析出晶体的质量相等 ③氯化钠和碳酸钠晶体的溶解度相等时所对应的温度在2O0C --300C之间 ④欲从含有少量NaCI杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取降低溶液温度的方式上述说法中,完全正确的一组是 A·①② B·①②③ C·①③④ D·①②④ 29. 农业上常用质量分数为16%的氯化钠溶液来选种。下列方法能配制出该选种溶液的是 0 t1 t2 t(℃) N M a S(g/100g水) A.4g氯化钠和16g水 B.16g20%的氯化钠溶液和5g水 C.10g8%的氯化钠溶液蒸发4g水 D.14g10%的氯化钠溶液和1g氯化钠 30. 右图是M、N两种物质的溶解度曲线,在 t2℃时往盛有100g水的烧杯中先后加入 a g M和a g N(两种物质溶解时互不影响, 且溶质仍是M、N),充分搅拌。将混合物 的温度降低到t1℃,下列说法正确的是 A、t2℃时,得到M的饱和溶液 B、t2℃时,得到N的不饱和溶液 C、温度降低到t1℃时,M、N的溶质质量分数相等,得到M、N的不饱和溶液 D、温度降低到t1℃时,M、N的溶解度相等,得到M、N的饱和溶液 31. 右图是A、B两种固体物质的溶解度曲线。下列说法中错误的是 A.A物质的溶解度受温度变化的影响较大,B物质的溶解度受温度变化的影响较小 B.t℃时,等质量的A、B饱和溶液中含有相同质量的溶质 C.当温度大于t℃时,A溶液一定比B溶液浓 D.B中含有少量A时,用溶解、蒸发、结晶的方法除去B中的A 32. 20℃,硝酸钾的溶解度为30g,在此温度下,向50g水中加入20g硝酸钾后,所得溶液的溶质质量分数为 A、40.0﹪ B、30.0﹪ C、28.6﹪ D、23.1﹪ 33. 小强在家庭小实验中把下列物质分别放人适量水中充分搅拌,其中不能得到溶液的是 A.酒精 B.纯碱 C.食盐 D.植物油 34. .海水淡化可采用膜分离技术,如右图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进人左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水,对加压后右侧海水成分变化进行分析,正确的是 A.溶质质量增加 B.溶液质量不变 C.溶剂质量减少 D.溶质质量分数不变 35. 现将40℃时的一杯硝酸钾溶液降温至20℃,结果有少量晶体析出,则下列说法错误的是 A、40℃时的溶液一定为饱和溶液 B、20℃时溶液中溶质的质量分数比40℃时小 C、20℃时的溶液一定为饱和溶液 D、溶剂的质量没有改变 36. t℃将一定量的某物质的不饱和溶液均分为三份,分别加热蒸发溶剂,然后把温度降至t℃ 。已知从三份溶液中蒸发的溶剂分别为10g、20g、30 g,析出的晶体不含结晶水,其质量分别为 ag、bg、cg,则 a、b.c三者的关系正确的为 A. c=2b-a B.c=2a+b C.c=a+b D.c= a+2b 37. .把60"C的硝酸钾饱和溶液冷却到20℃,下列叙述错误的是 A.溶解度减, B.溶液的质量不变 C.溶液由浓变稀 D.溶剂的质量不变 38. 将下列四种家庭常用的调味品分别放入水中,不能形成溶液的是 A.醋酸 B.蔗糖 C.食盐 D.香油 39. 现有一杯20℃的硝酸钾饱和溶液,欲改变其溶质质量分数,下列方法可行的是 A.加人一定量的硝酸钾 B.升温到6090 C.加人一定量的水 D,恒温蒸发部分水 二、填空简答题 1.在生活中我们知道这样的事实:①食盐易溶于水,而难溶于植物油;②硝酸钾易溶于水, 而碳酸钙难溶于水; ③蔗糖在热水中溶解的质量比在等质量的冷水中溶解的质量多。 上述事实①②③分别说明,固体物质的溶解度主要与 、 、 三个因素有关。 2..将一块塑料板放入500C的硝酸钾饱和溶液中,塑料板漂浮于液面上(如图)。若将溶液降温到200C时,可观察到的现象是 ; 。若要看到塑料板上浮,应采用的方法是 。 3. 根据图1和图2回答问题: 图1 图2 (1)在t1℃时,等质量的甲、乙两种固体物质在水中的溶解现象如图1所示,要使剩余的甲固体继续溶解可采用的方法是____________。 (2)图2中a、b分别表示上述两种物质的溶解度曲线,在________℃时,这两种物质的溶解度相等;a表示的是_____________物质(填“甲”或“乙”)的溶解度曲线。 4. 小明同学绘制了如图所示A、B两种固体物质的溶解度曲线: (1)当 ℃时,A物质与B物质的溶解度相等; (2)若将B物质从溶液中结晶析出,宜采用的结晶方法是: ; (3)我国有许多盐碱湖,湖中溶有大量的NaCl 和Na2CO3,那里的人们冬天捞碱,夏天晒盐,据此你认为图中(填字母) 曲线与纯碱的溶解度曲线相似。 5. 20℃时,分别向盛有10g水的的两支试管中,加入等质量的甲、乙两种固体物质,使其充分溶解,可观察到如右图所示的现象。 (1)20℃时, (填“A”或“B”)试管中的溶液一定是饱和溶液; (2)右图2中表示甲物质的溶解度曲线的是 (填“a”或“b”),要使A试管中剩余的固体继续溶解可采用的方法是 。 6. 右图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线。现有t2oC 时甲、乙、丙三种物质的饱和溶液(无固体存在),请根据下图回答: (1)丙物质的溶解度随温度升高而 。(填“增大”、“减小”、“不变”) (2)t2oC时,三种物质中溶解度最大的 。 (3)将三种饱和溶液分别从t2oC降温到t1oC时,析出晶体最多的是 ___________。 7. 如图所示是A、B两种固体溶解度曲线 ①在t1℃时,A的溶解度比B__________(填“大” 或“小”) ②在t2℃时__________(填“能”或“不能”)配成 A B S(g) 40 t1 t2 t℃ 40%的A溶液 ③在t2℃时,将A、B两种物质的饱和溶液降 0 温到t℃时,A的饱和溶液中溶质的质量分数比B 的饱和溶液中溶质的质量分数_____(填“大”或“小”) 8. 右图是部分物质的溶解度曲线,根据 该曲线图回答问题: (1)下列说法中错误的是 (填A、 B、C符号) A.硝酸钾的溶解度大于氯化钠的溶解度 B.0°C时物质的溶解度都为0g C. 图中所列物质的溶解度都随温度的升高而增大 (2)10°C时,100 g水中溶解 g硝酸钠才能形成饱和溶液,该饱和溶液中溶质的质量分数是 (精确到0·1%)。 9. 下图甲是A、B、C三种固体物质的溶解度曲线图。 (1)甲图中,t2℃时,A、B、C三种物质中,溶解度最大的是 。P点所表示的含义为 ______________________________________________________________。 (2)t℃时,将B物质的不饱和溶液转变成饱和溶液可采取的方法有____________________。 (3)如乙图所示,20℃时,把试管放入盛有X的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则X可能为A、B、C三种固体物质中的哪一种? 。 10. 我市濒江临海,有较长的海岸线,海洋资源十分丰富。 ⑴海水晒盐可获得粗盐,在实验室中粗盐经过溶解、 、 可制得精盐。 t1 t2 温度/℃ 溶 解 度/g MgCl2 MgSO4 KCl ⑵晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,右图是它们的溶解度曲线示意图。 ①设t1℃时MgCl2、KCl和MgSO4三种物质的溶解度分别为a、b、c,则它们的大小关系为 。 ②将卤水加热到t2℃以上,根据溶解度曲线,首先析出的晶体是 。 ⑶目前世界上60%的镁是从海水中提取的。其主要步骤如下: 溶 液 试剂A 试剂B MgCl2 溶液 熔融 电解 无水MgCl2 Mg Mg(OH)2 沉淀 海水(主要 含NaCl和MgSO4等) ①提取Mg的过程中,试剂A可以选用_________,试剂B选用_________,由无水MgCl2制取Mg的反应类型为 。 ②分离出Mg(OH)2后的NaCl溶液中还含有CaCl2、Na2SO4等杂质,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量盐酸。实验中加入过量BaCl2溶液是为了除去 ;加入过量Na2CO3溶液的目的是 。 ⑷目前海水淡化普遍采用“多级闪急蒸馏法”,证明蒸馏得到的水为淡水的方法是 。海底矿产资源“可燃冰”,其主要成分是水合甲烷晶体(CH4·nH2O),若水合甲烷晶体中CH4的质量分数为10%,则水合甲烷晶体的化学式为 。 11. 右图为A、B两种固体物质的溶解度曲线。请回答: (1)曲线上Q点表示 ① 。 (2)在l0℃时,两种物质的饱和溶液中溶质的质量分数A ② B(选填“>”、“=”或“<”)。 (3)30℃时,将10 gA物质加人到盛有100 g水的烧杯中,充分搅拌,得到不饱和溶液,若再加入A物质 ③ g或降温到 ④ ℃,则都能恰好形成饱和溶液。 12. 常温下,向盛有几小粒硝酸钾晶体的试管中,加入饱和硝酸钾溶液,并固定在盛有水的烧杯中(如右图所示)。 小军同学向烧杯中加入某种物质后并搅拌,结果试管中的晶体消失了。请你猜测,小军同学加入的物质可能是___________、______________ 13. 溶液在生产和科研中具有广泛的用途。在农业上,为了选种子,需要配制1 5%的盐溶液。现有3 0 kg食盐固体,可配制食盐溶液_______kg。配制食盐溶液的一般骤为①______________________,②_____________________________,③溶解。 14. 右图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答: ⑴P点的含义是 。 ⑵t2℃时30g a物质加入到50g水中不断搅拌,能形成80g溶液吗? (填写“能”或“不能”)。 ⑶t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是 (填写物质序号)。 ⑷将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是 (填写选项序号)。 A.c>a=b B.a=b>c C.a>b>c D.b>a>c 15.若将一定质量的硝酸钾不饱和溶液变为饱和溶液,则: A.溶液的质量一定变小 B.溶液中溶质量分数一定变大 C.溶液的质量一定变大 D.溶液中溶质的质量分数可能不变 16. 右图是A、B、C三种物质的溶解度随温度变化的曲线图.根据图回答:(1)S表示物质的溶解度,在________________℃时SA=SB>SC; (2)随着温度的升高,A、B、C三种物质的饱和溶液中有溶质从溶液中析出的是_________________。 (3)要将B物质从它的饱和溶液中析出,应采用的方法是_______________(填冷却或蒸发) (4)t3℃时,90 gA物质的饱和溶液中,含有A物质_________________g。 17. 氯化钠和硝酸钾两种物质的溶解度随温度(0~100℃)的变化见下表: 0℃ 20℃ 40℃ 60℃ 80℃ 100℃ NaCl(g) 35.7 36.0 36.6 37.3 38.4 39.8 KNO3(g) 13.3 31.6 63.9 110 169 246 请分析表格中的数据,回答下列问题: ①若两物质的溶解度相等,此时所对应的温度范围在 之间; ②20℃时,氯化钠饱和溶液的质量分数 硝酸钾饱和溶液的质量分数(填“>”、“<”或“=”); ③某同学欲从含有少量氯化钠的硝酸钾中分离出硝酸钾,他应采取的方法是 。 18. 下面的表格中列出了氯化铵在不同温度下的溶解度: 温度/℃ 0 10 20 30 40 50 60 70 80 溶解度/g 29.4 33.3 37.2 41.4 45.8 50.4 55.2 60.2 65.6 (1)从表中可得到的一条信息是___________________________________。 (2)在20℃时,向100g水中加入50g氯化铵,形成氯化铵的______(填“饱和”或“不饱和“)溶液,将其温度升高至60℃时,溶液的质量为________g ,该溶液中溶质与溶剂的质量比为______________。 19. 为了配制50g 5%的氯化钠溶液,需进行如下操作:① 计算;② 用托盘天平称量 _________g 氯化钠;③ 用__________(填“10mL”或“50mL”)量筒量取______mL水;④ 将两者置于烧杯中,用玻璃棒搅拌。 20. A图表示硝酸钾和氢氧化钙的溶解度随温度变化的情况。B图中甲、乙试管分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。向烧杯中加入一种物质后,甲试管中固体减少,乙试管中的固体增加,则加入的物质可能是 或 。 20. 20℃时,取相同质量的a、b、c三种物质的饱和溶液分别置于三个烧杯中,再分别向其 中加入相同质量的相应固体溶质,将温度升高到40℃,固体的溶解情况如图1所示。图2为a、b、 c三种物质的溶解度曲线。请仔细阅读图1和图2回答下列问题: 图1 图2 (1)三种物质的溶解度关系为b>a>c时的温度为t℃,则t的取值范围是____________________。 (2)烧杯甲里是_________物质的溶液,烧杯乙里是___________物质的溶液。 (3)40℃时,烧杯_________里的溶液中溶剂最少。 (4)各种状态下,各烧杯(甲、乙、丙)里的溶液中溶质质量分数的比较一定正确的是__________。 A、甲(状态2)>甲(状态1) B、乙(状态1)>甲(状态3) C、甲(状态1)=乙(状态2) D、乙(状态3)>丙(状态3) 三.计算题 1. 在t℃时,有94g饱和硝酸钾溶液,当蒸发掉25g水,再冷却到t℃时,剩余溶液的质量为41.5g,求: (1) 硝酸钾在t℃时的溶解度;(2) 剩余溶液中溶质的质量分数。 2. 向盛有12.60g碳酸氢钠固体的烧杯中,加入100.5g硫酸溶液恰好反应。反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如图所示。烧杯连同药品的起始质量为200.0g。反应的化学方程式为: 2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑ 回答下列问题: (1) 当碳酸氢钠与硫酸溶液恰好完全反应时, 所需的时间约为 。 (2) 当碳酸氢钠与硫酸溶液完全反应时,所产生二氧化碳的质量为 。 (3) 反应后,所得硫酸钠溶液的溶质质量分数为多少? 3. 实验室有一瓶未开封的浓盐酸,部分标签如右图所示。这瓶浓盐酸中溶液的质量为 g.若用这瓶浓盐酸来配制200g溶质质量分数为10%的稀盐酸,需量取浓盐酸的体积是 mL,水的体积是 mL。查看更多