- 2021-04-14 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江苏专版2020中考化学复习方案第09部分化学实验试题
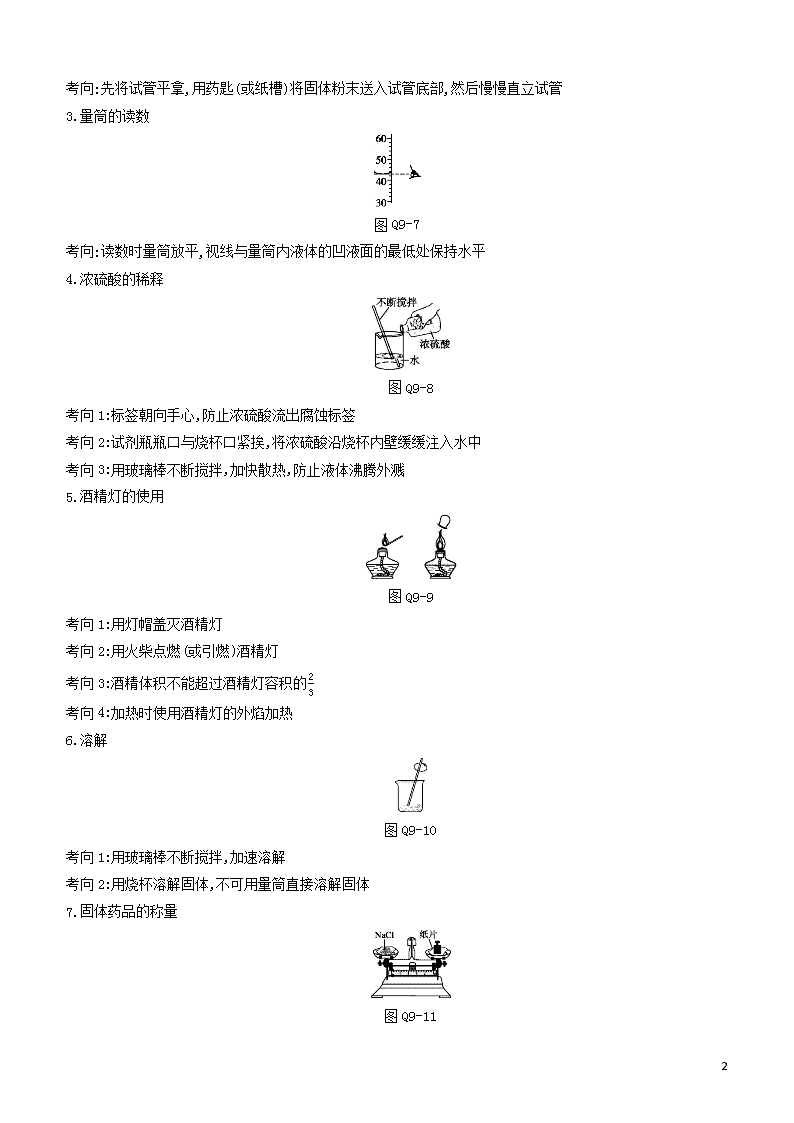
第九部分 化学实验 一、仪器的识别 1.与气体制取相关的仪器 图Q9-1 2.其他相关仪器 图Q9-2 二、基本操作 1.过滤 图Q9-3 考向1:过滤时需用玻璃棒引流,防止液体外溅,冲破滤纸 考向2:滤纸边缘低于漏斗边缘,漏斗内液面低于滤纸边缘,玻璃棒下端紧靠在三层滤纸处 考向3:漏斗下端尖嘴紧靠烧杯内壁 2.固体药品的取用 (1)密度较大的块状药品或金属颗粒的取用 图Q9-4 考向:先把试管横放,用镊子把药品放入试管口,再把试管慢慢地竖立起来,使药品缓缓地滑落到试管的底部,以免打破试管 (2)颗粒状或粉末状固体药品的取用 图Q9-5 考向:试剂瓶瓶塞倒放在实验台上 图Q9-6 7 考向:先将试管平拿,用药匙(或纸槽)将固体粉末送入试管底部,然后慢慢直立试管 3.量筒的读数 图Q9-7 考向:读数时量筒放平,视线与量筒内液体的凹液面的最低处保持水平 4.浓硫酸的稀释 图Q9-8 考向1:标签朝向手心,防止浓硫酸流出腐蚀标签 考向2:试剂瓶瓶口与烧杯口紧挨,将浓硫酸沿烧杯内壁缓缓注入水中 考向3:用玻璃棒不断搅拌,加快散热,防止液体沸腾外溅 5.酒精灯的使用 图Q9-9 考向1:用灯帽盖灭酒精灯 考向2:用火柴点燃(或引燃)酒精灯 考向3:酒精体积不能超过酒精灯容积的23 考向4:加热时使用酒精灯的外焰加热 6.溶解 图Q9-10 考向1:用玻璃棒不断搅拌,加速溶解 考向2:用烧杯溶解固体,不可用量筒直接溶解固体 7.固体药品的称量 图Q9-11 7 考向1:称量时应该遵循“左物右码”原则 考向2:药品应放在称量纸上称量,如果药品具有腐蚀性或易潮解,则应放在玻璃器皿中称量 考向3:砝码用镊子夹取 8.检查装置的气密性 图Q9-12 考向:选择题中一般表现为正确选项,填空题中多为叙述如何检查装置的气密性 9.少量液体的滴加 图Q9-13 考向:滴加液体时,要保持胶头滴管竖直悬空于试管口正上方,不可把胶头滴管伸入试管内或触及试管壁 10.蒸发 图Q9-14 考向1:用玻璃棒搅拌,防止液体飞溅 考向2:移开蒸发皿时要用坩埚钳,不能直接用手拿,以免烫伤 考向3:用酒精灯的外焰加热 11.液体的加热 图Q9-15 考向1:试管夹从试管底部套上,取下,夹在试管的中上部,试管倾斜与水平线成45° 考向2:试管内液体不能超过试管容积的13 考向3:预热后,用酒精灯的外焰加热 12.闻药品的气味 图Q9-16 考向:闻药品气味时,用手轻轻地在瓶口扇动,使极少量的气体飘进鼻孔 7 13.固体的加热 图Q9-17 考向1:夹在离试管口13处,试管口略向下倾斜 考向2:用酒精灯的外焰加热 14.测定溶液的pH 图Q9-18 考向1:用干燥洁净的玻璃棒蘸取少量待测液,滴在干燥的pH试纸上 考向2:pH试纸放在点滴板上且不能用水润湿 15.倾倒液体 图Q9-19 考向1:标签朝向手心,防止药品流出腐蚀标签 考向2:瓶口紧挨试管口 考向3:试管稍微倾斜 考向4:瓶塞倒放在桌面上 三、粗盐中难溶性杂质的去除 1.粗盐提纯的目的:除去粗盐中难溶性杂质。 2.粗盐提纯的步骤 图Q9-20 (1)溶解:①使粗盐中可溶性的物质完全溶于水;②玻璃棒的作用是加快物质的溶解速率。 (2)过滤:①将不溶于液体的固体物质与液体分离的一种方法;②注意“一贴、二低、三靠”; ③玻璃棒的作用是 引流。 (3)蒸发:①物质从液态转化为气态的过程(中考中专门指除去滤液中的水分得到溶质的过程);②玻璃棒的作用是使溶液均匀受热,防止局部受热不均造成液滴飞溅;③待蒸发皿中出现较多固体时,停止加热,利用余热将 7 滤液蒸干。 3.过滤后滤液仍浑浊的原因 (1)滤纸破损,部分液体未经过滤直接流入盛接滤液的烧杯中。 (2)过滤时,液面高于滤纸边缘。 (3)盛接滤液的烧杯不干净。 4.粗盐纯度的计算 粗盐纯度=提纯的产物质量粗盐样品质量×100% 5.误差分析 (1)纯度偏高的原因:①过滤操作不当,过滤后滤液仍浑浊;②蒸发不干,产物含有水分。 (2)纯度偏低的原因:①溶解时倒水量不足,氯化钠只有部分溶解;②溶解时有液体溅出;③过滤时没用玻璃棒引流导致有液体溅出;④过滤时没有等滤液全部流入烧杯,就拿走烧杯;⑤蒸发时蒸干后才停止加热;⑥蒸发时没用玻璃棒搅拌,局部过热,液滴飞溅等。 四、一定溶质质量分数的氯化钠溶液的配制 1.步骤 图Q9-21 以配制50 g溶质质量分数为15%的氯化钠溶液为例。 (1)计算:需要氯化钠固体的质量是7.5 g,需要水42.5 mL。 (2)称取氯化钠:使用托盘天平称取氯化钠之前,先要调零,然后在天平两端分别放上质量相等的纸片,用镊子夹取5 g的砝码置于天平的右盘,并将游码调到2.5 g刻度处,用药匙向天平的左盘纸片上加氯化钠,待天平平衡后,将称好的氯化钠倒入烧杯中。 (3)量取水:选择量程为50 mL的量筒,先向量筒中倒入接近40 mL的水,当量筒内的水接近刻度线时,改用胶头滴管吸取水滴加到刻度线,读数时量筒放置平稳,并使视线与液体凹液面的最低处保持水平,将量好的水倒入烧 杯中。 (4)溶解:用玻璃棒不断搅拌,使氯化钠完全溶解。玻璃棒的作用是搅拌,加快氯化钠的溶解速率。 (5)转移:氯化钠完全溶解后,将氯化钠溶液转移到指定的容器中,贴上标签(标签中注明溶液的名称和溶质质量分数,如氯化钠溶液、15%)。 2.误差分析 (1)溶质质量分数偏低的原因: ①用量筒量取水时,仰视读数。 ②称量氯化钠固体时天平左盘放砝码(使用游码),右盘放固体。 ③溶解时烧杯内有水珠,不干燥。 ④样品中有杂质。 7 (2)溶质质量分数偏高的原因: ①量取液体时俯视读数。 ②砝码上沾有油污,称量有误差。 五、实验室制取氧气和二氧化碳 1.实验原理 (1)制取O2:①2KMnO4K2MnO4+MnO2+O2↑ ②2KClO32KCl+3O2↑ ③2H2O22H2O+O2↑ 记忆技巧:①实验室制氧气,化学方程式前面化学计量数为2;②反应物中含锰元素的无需二氧化锰;③都为分解反应。 (2)制取CO2:CaCO3+2HClCaCl2+H2O+CO2↑ 2.发生装置 (1)固固加热型 图Q9-22 举例:实验室用高锰酸钾或氯酸钾制氧气。 注意:用高锰酸钾制氧气时,需在试管口塞一团棉花,防止高锰酸钾粉末进入导管造成堵塞。 (2)固液(或液液)常温型 图Q9-23 举例:实验室用大理石或石灰石和稀盐酸反应制CO2;用过氧化氢溶液制O2;用锌与稀硫酸反应制H2。 3.收集装置 (1)排空气法:操作简单,收集到的气体比较干燥,但气体纯度不高。 图Q9-24 7 适用范围不与空气中的任何成分发生反应,密度与空气密度相差较大密度比空气大的气体(如O2、CO2)用向上排空气法密度比空气小的气体(如H2、NH3)用向下排空气法 (2)排水法:难溶或微溶于水,且不与水反应的气体可用排水法收集,排水法收集的气体纯度较高,但含有一定量的水蒸气,不干燥。 图Q9-25 注意:①以高锰酸钾、氯酸钾为原料制取氧气时,若用排水法收集气体,收集完后,先撤离导管再熄灭酒精灯;②用排水法收集气体,收集满的标志是瓶口有大气泡冒出。 4.检验和验满 图Q9-26 5.多功能瓶的使用 (1)用于洗气(均长进短出) 图Q9-27 (2)用于收集气体 图Q9-28 7查看更多