- 2021-04-14 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学三十个复习专题专题25怎样进行化工生产流程解题突破
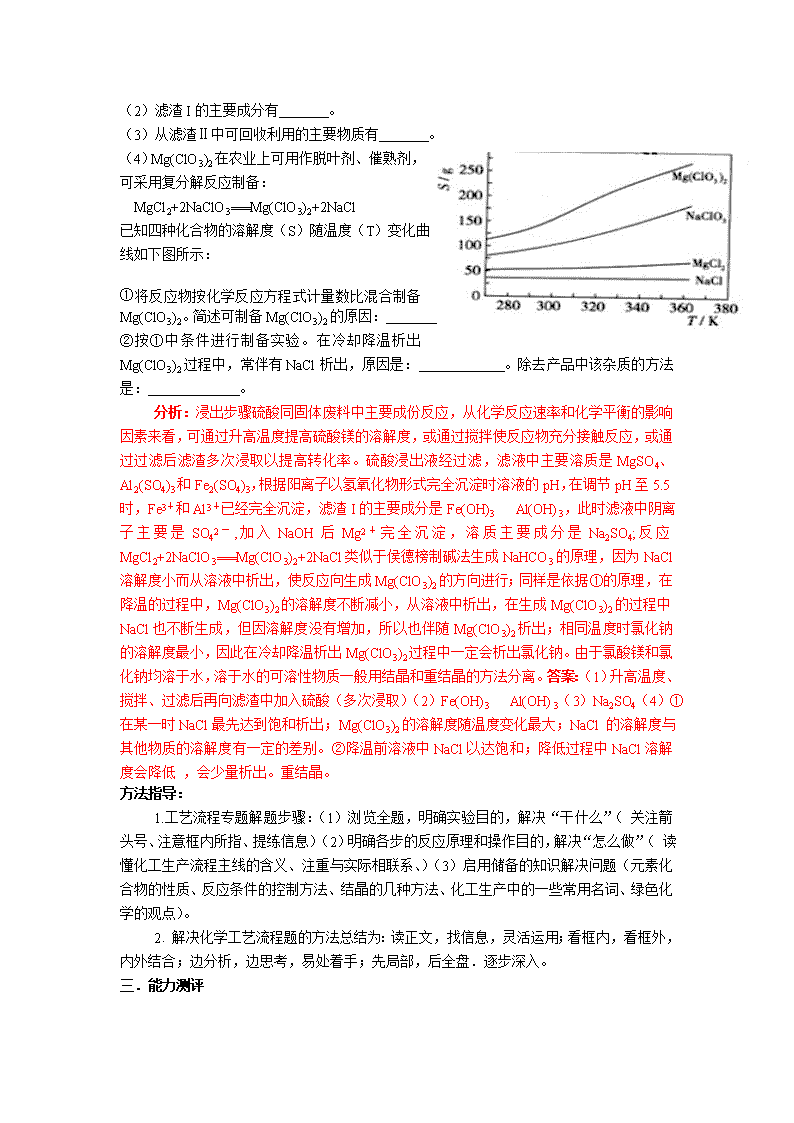
专题25.怎样进行化工工艺流程解题突破 考试说明中:能够敏捷、准确地获取试题所给的相关信息,并与已有知识整合,在分析评价的基础上应用新信息的能力。能将与化学相关的实际问题分解,综合运用相关知识和科学方法,解决生产、生活实际和科学研究中的简单化学问题的能力。 高考试卷中:化工生产技术的“工艺流程题”已成为江苏每年高考的新亮点和主流题型。化学工艺流程题就是将化工生产中的主要生产阶段即生产流程用框图形式表示出来.并根据生产流程中涉及的化学知识进行巧妙设问,与化工生产紧密联系的试题。 答题过程中:根据“化学工艺流程题”的特点,要准确、顺利地解题,除了要掌握高中化学必备的知识外,最关键的是要具备“化学工艺流程题”的解题思路和掌握一些解题方法技巧。解题思路可以总结为以下几句话:认真阅读,熟悉流程,加工信息,根据设问,规范答题。 一。能力展示 1.钡盐行业生产中排出大量的钡泥[主要含有、、、等]。某主要生产、、的化工厂利用钡泥制取,其部分工艺流程如下: (1)酸溶后溶液中,与的反应化学方程式为 。 (2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸, 原因是 、 。 (3)该厂结合本厂实际,选用的X为 (填化学式);中和Ⅰ使溶液中 (填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)。 (4)上述流程中洗涤的目的是 。 2. 从铝土矿(主要成分是,含、、MgO等杂质)中提取两种工艺品的流程如下: 请回答下列问题: (1)流程甲加入盐酸后生成Al3+的方程式为_________. (2)流程乙加入烧碱后生成Si的离子方程式为________. (3)验证滤液B含,可取少量滤液并加入________(填试剂名称)。 (4)滤液E、K中溶质的主要成份是________(填化学式),写出该溶液的一种用途________ (5)已知298K时,的容度积常数=5.6×,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的=_______. 过程分析: 1.本题主要考查的是无机化工流程的分析,此题为化工生产题型,主要考察了化合物性质。(1)Ba(FeO2)2与HNO3反应,生成对应的硝酸盐;(2)控制温度,不用浓硝酸的目的是控制反应速率,防止反应速率过快;同时浓硝酸容易挥发分解;(3)通过产物,结合溶液的酸碱性,选用的X为BaCO3,在I中有Fe3+、H+和Ba2+、NO3-等,加入BaCO3后,能使Fe3+和H+浓度降低;(4)在废渣中有可溶性钡盐,有毒,因此,洗涤的目的是减少可溶性钡盐对环境的污染。答案: (1)Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O (2)防止反应速度过快 浓HNO3易挥发、分解 (3)BaCO3 Fe3+ H+ (4)减少废渣中可溶性钡盐对环境的污染 2.本题考查铝土矿中氧化铝提取的工艺流程。(1)与HCl反应生成Al3+,应为铝土矿中Al2O3。(2)SiO2可以溶于NaOH中生成Na2SiO3。(3)检验Fe3+的特征反应很多,如与KSCN显血红色,与苯酚显紫色,与OH-显红褐色沉淀等。(4)生成E、K时,CO2均是过量的,故应生成NaHCO3。(5),=5.6×10-12/(0.1)2=5.6×10-10。答案:(1)Al2O3 + 6H+ 2Al3+ +3H2O。(2)SiO2 + 2OH- SiO32 - + H2O(3)硫氰化钾(或硫氰酸钾、苯酚溶液等合理答案:)(4)NaHCO3;制纯碱或做发酵粉等合理答案:(5)5.6×10-10mol/L 精要点评: 1. ①试题源于生产实际,体现化学学科特点,能培养中学生“学以致用”的学习观;②试题内容丰富,涉及高中化学知识范围广,能考查学生的知识掌握情况及解决实际问题的知识迁移能力;③试题阅读量大、又辅以框图等非文字形式,能考查学生的加工材料、提取信息的能力。 2。要能成功应对每一设问必须经过一系列过程:提取信息à储存、加工信息à问题的分解à新信息与已有知识、待解决问题的整合à组织化学术语进行表达。 二.能力培养 1.某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下: 沉淀物 Fe(OH)3 Al(OH)3 Mg(OH)2 PH 3.2 5.2 12.4 部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题: (1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。 (2)滤渣I的主要成分有 。 (3)从滤渣Ⅱ中可回收利用的主要物质有 。 (4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备: MgCl2+2NaClO3===Mg(ClO3)2+2NaCl 已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示: ①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。 ②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。 分析:浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率。硫酸浸出液经过滤,滤液中主要溶质是MgSO4、Al2(SO4)3和Fe2(SO4)3,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe3+和Al3+已经完全沉淀,滤渣I的主要成分是Fe(OH)3 Al(OH)3,此时滤液中阴离子主要是SO42-,加入NaOH后Mg2+完全沉淀,溶质主要成分是Na2SO4;反应MgCl2+2NaClO3===Mg(ClO3)2+2NaCl类似于侯德榜制碱法生成NaHCO3的原理,因为NaCl溶解度小而从溶液中析出,使反应向生成Mg(ClO3)2的方向进行;同样是依据①的原理,在降温的过程中,Mg(ClO3)2的溶解度不断减小,从溶液中析出,在生成Mg(ClO3)2的过程中NaCl也不断生成,但因溶解度没有增加,所以也伴随Mg(ClO3)2析出;相同温度时氯化钠的溶解度最小,因此在冷却降温析出Mg(ClO3)2过程中一定会析出氯化钠。由于氯酸镁和氯化钠均溶于水,溶于水的可溶性物质一般用结晶和重结晶的方法分离。答案:(1)升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)(2)Fe(OH)3 Al(OH)3(3)Na2SO4(4)①在某一时NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化最大;NaCl 的溶解度与其他物质的溶解度有一定的差别。②降温前溶液中NaCl以达饱和;降低过程中NaCl溶解度会降低 ,会少量析出。重结晶。 方法指导: 1.工艺流程专题解题步骤:(1)浏览全题,明确实验目的,解决“干什么”( 关注箭头号、注意框内所指、提练信息)(2)明确各步的反应原理和操作目的,解决“怎么做”( 读懂化工生产流程主线的含义、注重与实际相联系、)(3)启用储备的知识解决问题(元素化合物的性质、反应条件的控制方法、结晶的几种方法、化工生产中的一些常用名词、绿色化学的观点)。 2.解决化学工艺流程题的方法总结为:读正文,找信息,灵活运用;看框内,看框外,内外结合;边分析,边思考,易处着手;先局部,后全盘.逐步深入。 三.能力测评 1. 以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下: (1)反应I前需在溶液中加入 ▲ (填字母),以除去溶液中的。 A.锌粉 B.铁屑 C.KI溶液 D. (2)反应Ⅰ需控制反应温度低于35℃,其目的是 。 (3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是 。 (4)反应Ⅳ常被用于电解生产(过二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为 。 解题分析: 1.(1)在溶液中除去溶液中的,最好选用铁屑或铁粉,比较简单。(2)如果温度过高会导致NH4HCO3分解同样也会加快Fe2+的水解(温度越高水解速率越快)这样会使原料利用率降低。(3)由题目看出在III反应中生成的K2SO4 为固体,而K2SO4在无机溶剂中溶解度是比较大的,要想使K2SO4析出只能降低其溶解度所以加入醇类溶剂目的降低K2SO4 的溶解度。(4)根据阴阳极反应原理阳极失电子发生氧化反应,此题实质是电解硫酸铵溶液,在根据反应后的产物得出正确的答案。答案:(1)B(2)防止NH4HCO3分解(或减少Fe2+的水解)(3)降低K2SO4 的溶解度,有利于K2SO4 析出。(4)2SO42- -2e-2S2O82- 防错机制: 化工流程题考查的知识点多,非常灵活,对考生的审题、分析问题、解决问题、文字表达等方面的能力都要求非常高,不易得高分,这就要求我们在平时做这类习题时要善于归纳、总结,认真审题,善于从题目或问题中获取信息来帮助自己解题,同时在平时的学习中要熟记一些基本的实验操作,如沉淀的洗涤、沉淀是否完全的检验方法、从溶液中得到晶体的方法等。 四.能力提升 1.工业上用粗氧化铜(含杂质FeO)为原料制取氯化铜晶体(CuCl2•2H2O)的生产流程如下: 物质 Fe(OH)2 Cu(OH)2 Fe(OH)3 完全沉淀时的pH ≥9.6 ≥6.4 3~4 (1)写出向溶液A中加入NaClO的离子方程式 。 (2)沉淀C的化学式为 。 (3)实验室如何检验沉淀E已洗涤干净? 。 (4)低温蒸发的目的是 。 (5)流程中两次加入了CuO,而不是一次性向溶液B中加入过量的CuO,其理由是 2.(CrO3)易溶于水、醇、硫酸和乙醚,不溶于丙酮。某工艺以铬酸钠为原料制备铬酸酐的流程如下: (1)在上述流程中可直接循环利用的物质有: 。 (2)“苛化蒸氨”的化学方程式 。 (3)“热过滤”的原因可能是: 。 (4)含有硫酸、CrO3的硅胶可用于检测酒后驾车现象,其原理是:乙醇会被氧化生成乙醛,同时CrO3被还原为硫酸铬[Cr2(SO4)3],试写出反应的化学方程式 。 3.铁氧体可用于隐形飞机上吸收雷达波涂料。一种以废旧锌锰电池为原料制备锰锌铁氧体的主要流程如下: ⑴当x=0.4,试用氧化物形式表示该铁氧体组成 。 ⑵酸浸时,二氧化锰被还原的化学方程式为: 。 ⑶活性铁粉除汞时,铁粉的作用是 (选填:氧化剂、还原剂、吸附剂)。 ⑷煮沸1h是为了使 分解。 ⑸同时加入MnSO4和铁粉的目的是 。 4.活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO): 已知:几种离子生成氢氧化物沉淀时的pH如下表: 待沉淀离子 Fe2+ Fe3+ Zn2+ Cu2+ 开始沉淀时pH 6.34 1.48 6.2 5.2 完全沉淀时pH 9.7 3.2 8.0 6.4 请问答下列问题: ⑴ 步骤A加H2O2发生反应的离子方程式是 ,该步骤需控制溶液pH的范围是 。 ⑵ A溶液中主要含有的溶质是 。 ⑶ 碱式碳酸锌经焙烧制得活性ZnO的反应△H>0,该反应能自发进行的原因是△H (选填“=”、“>”、“<”)0。 ⑷ 若经处理后的废水pH=8,此时Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。 5.KNO3是重要的化工产品,下面是一种已获得专利的KNO3制备方法的主要步骤: 搅拌 反应Ⅰ 饱和(NH4)2SO4母液 过滤 蒸发浓缩 冷却结晶 过滤 反应Ⅱ 反应Ⅳ 反应Ⅲ 冷却结晶 过滤 KCl NH4HCO3 CaCO3 KNO3(s) 滤液 Ca(NO3)2溶液 CO2 HNO3溶液 NH4Cl CaSO4 CO2 (1)反应Ⅰ中,CaSO4与NH4HCO3的物质的量之比为1︰2,该反应的化学方程式为 。 (2)反应Ⅱ需在干态、加热的条件下进行,加热的目的是 ;从反应Ⅳ所得混合物中分离出CaSO4的方法是趁热过滤,趁热过滤的目的是 。 (3)检验反应Ⅱ所得K2SO4中是否混有KCl的方法是:取少量K2SO4样品溶解于水, 。 (4)整个流程中,可循环利用的物质除(NH4)2SO4外,还有 (填化学式)。 (5)将硝酸与浓KCl溶液混合,也可得到KNO3,同时生成等体积的气体A和气体B。B是三原子分子,B与O2反应生成1体积气体A和2体积红棕色气体C。B的分子式为 。 习题答案 1.(1)2Fe2+ + ClO- + 2H+ = 2Fe3+ + Cl―+ H2O (2)Fe(OH)3 (3)取最后一次洗涤液少量于试管中,加入AgNO3溶液,无白色沉淀生成,说明已洗干净 (4)抑制Cu2+水解,防止晶体中结晶水失去(答出一点即可) (5)一次性加入过量的CuO将导致Fe3+和Cu2+同时生成沉淀 2.(1)NH3 (2)(NH4)2CrO4+CaO=CaCrO4+2NH3↑+H2O (3)温度较高时H2CrO4的溶解度较大,便于同微溶的硫酸钙分离 (4)3C2H5OH+2CrO3+3H2SO4→3CH3CHO+Cr2(SO4)3+6H2O 3.⑴2MnO3ZnO5Fe2O3 ⑵MnO2+H2O2+H2SO4MnSO4+O2↑+2H2O ⑶还原剂 ⑷H2O2 ⑸调节滤液离子是成分,符合水热后获得锰锌铁氧化体组成(二次加入铁粉还可进一步除去汞) 4.⑴ 2Fe2++H2O2+2H+=2Fe3++2H2O 3.2~5.2 ⑵ (NH4)2SO4 ⑶ > ⑷ 0.78 5. (1)CaSO4+2NH4HCO3=CaCO3↓+(NH4)2SO4+H2O+CO2↑ (2)分离NH4Cl与K2SO4,加快化学反应速率 防止KNO3结晶,提高KNO3的产率 (3)加入Ba(NO3)2溶液至不再产生沉淀,静置,向上层清液中滴加AgNO3溶液,若有沉淀生成,说明K2SO4中混有KCl (4)CaSO4、KNO3 (5)NOCl查看更多