- 2021-04-13 发布 |
- 37.5 KB |
- 27页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
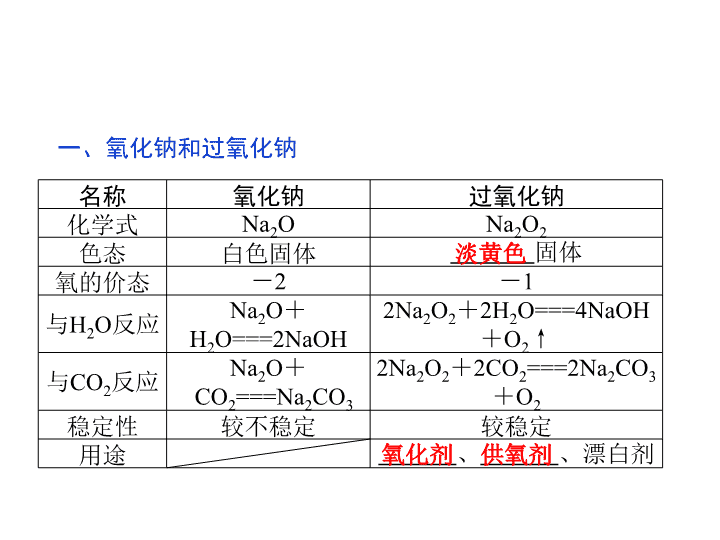
高中-化学:3纳的重要化合物
1.了解氧化钠、过氧化钠的主要 性质和用途。 2.了解碳酸钠、碳酸氢钠的主要 性质和用途。 3.了解焰色反应的概念及操作。 一、氧化钠和过氧化钠 名称 氧化钠 过氧化钠 化学式 Na2O Na2O2 色态 白色固体 固体 氧的价态 -2 -1 与H2O反应 Na2O+ H2O===2NaOH 2Na2O2+2H2O===4NaOH +O2↑ 与CO2反应 Na2O+ CO2===Na2CO3 2Na2O2+2CO2===2Na2CO3 +O2 稳定性 较不稳定 较稳定 用途 、 、漂白剂 淡黄色 氧化剂 供氧剂 (1)Na2O2属于碱性氧化物吗?为什么? (2)Na2O2中阴阳离子的个数比是多少? 【思考·提示】 (1)不属于,碱性氧化物指 能与酸反应生成盐和水的氧化物,Na2O2与盐酸 反应时不仅生成NaCl和水,还会有氧气生成, 所以不属于碱性氧化物。 (2)阴阳离子个数比为:N(O22-)∶ N(Na+)= 1∶ 2。 思考 二、碳酸钠和碳酸氢钠 名称 碳酸钠 碳酸氢钠 化学式 Na2CO3 NaHCO3 色态 细小白色晶体 俗名 纯碱、苏打 小苏打 溶解性 水中 水中 ,但比 Na2CO3溶解度小 与足量 盐酸反 应 产生气 体速率 慢 快 原理 Na2CO3+ 2HCl===2NaCl+ CO2↑+H2O NaHCO3+ HCl===NaCl+ CO2↑+H2O 白色粉末 易溶易溶 三、焰色反应 1.定义 很多 在灼烧时都会 使火焰呈现特殊的颜色。金属或它们的化合物 2.操作 ——将铂丝(或光洁的铁丝)用 洗净 ↓ ——将洗净的铂丝在火焰上灼烧至与 ↓ ——蘸取试样 ↓ ——在无色火焰上灼烧,并观察 ↓ ——再用 洗净铂丝 ↓ ——在火焰上灼烧至 盐酸 原火焰颜 色相同 火焰颜色 盐酸 无色 3.几种金属的焰色 钠:黄色,钾: 色(观察时要透 过 )。 紫 蓝色钴玻璃 1.原理 2Na2O2+2CO2===2Na2CO3+O2 2Na2O2+2H2O===4NaOH+O2↑ Na2O2与H2O的反应实质可分为两个过程: Na2O2+2H2O===2NaOH+H2O2 2H2O2===2H2O+O2↑ 反应过程中有H2O2生成,H2O2有强氧化性,所 以当将Na2O2加入滴有酚酞的水中时,溶液先变红后 褪色。 Na2O2与CO2、H2O的反应 2.物质的量的关系 无论是CO2或H2O的单一物质还是二者的混 合物,通过足量的Na2O2时,CO2或H2O与放出O2的物质的量之比均为2∶ 1,即气体减小的体积等 于生成O2的体积。 3.固体质量关系 相当于固体(Na2O2)只吸收了CO2中的“CO”, H2O中的“H2”;可以看作发生相应的反应:Na2O2+CO===Na2CO3、Na2O2+H2===2NaOH(实际上 两反应不能发生)。 4.先后顺序关系 一定量的Na2O2与一定量CO2和H2O(g)的混 合物的反应,解决问题时可视作Na2O2先与CO2反 应,待CO2反应完成后,Na2O2再与H2O发生反应 (实际情况复杂得多)。 5.电子转移关系 不论是与CO2还是与H2O反应,CO2与H2O均 既不是氧化剂也不是还原剂,反应的实质都是 Na2O2自身发生的氧化还原反应,所以每有1 mol O2生成时,转移的电子均为2 mol。 Na2O2与H2O发生反应时,产物NaOH既不 是氧化产物也不是还原产物。 特别提醒 (2008年高考北京卷)1 mol过氧化钠与2 mol碳酸氢钠 固体混合后,在密闭容器中加热充分反应,排出气体物 质后冷却,残留的固体物质是( ) A.Na2CO3 B.Na2O2 Na2CO3 C.NaOH Na2CO3 D.Na2O2 NaOH Na2CO3【思路点拨】 解答本题应注意以下两点: (1)根据各物质的物质的量进行计算。 (2)CO2和H2O与Na2O2反应时,要考虑反应的先后顺 序。 【解析】 Na2O2与NaHCO3的混合物受热分解时,首先是NaHCO3分 解, 2 mol 1 mol 1 mol 1 mol 产生的CO2与H2O均可与Na2O2反应,由于Na2O2与H2O反应生成NaOH, 而NaOH又可与CO2反应生成H2O,故可以认为是CO2先与Na2O2反应,CO2耗 尽后H2O才开始反应。而根据2Na2O2+2CO2===2Na2CO3+O2可知,生成的1 mol CO2恰好与1 mol Na2O2完全反应生成Na2CO3,H2O不会再与Na2O2反应, 故最终固体产物只有Na2CO3。 【答案】 A (1)上题中若将2 mol NaHCO3改为1 mol NaHCO3,最终残留固体是什么? (2)若将Na2O2改为过量呢? 【提示】 (1)Na2CO3和NaOH。1 mol NaHCO3分解生成0.5 mol H2O和0.5 mol CO2,首先 CO2与0.5 mol Na2O2反应生成Na2CO3,CO2耗尽后, 0.5 mol H2O恰好与剩余0.5 mol Na2O2完全反应,故 最终残留物为Na2CO3和NaOH。 (2)Na2O2和Na2CO3、NaOH。若Na2O2过 量,NaHCO3分解产生的CO2与H2O可先后与 Na2O2反应生成Na2CO3和NaOH,加上残留的 Na2O2,故最终残留物为三种,即Na2O2、 Na2CO3、NaOH。 1.把4.48 L CO2通过一定质量的固体 Na2O2后,收集到3.36 L(标准状况)气体,则这 3.36 L气体的质量是( ) A.3.8 g B.5.6 g C.4.8 g D.6.0 g 解析:选D。依据气体体积的差量解此题。CO2与足量的Na2O2反应,气 体体积变为原来的一半。 2CO2+2Na2O2===2Na2CO3+O2 ΔV 2 1 1 2.24 L 1.12 L (4.48-3.36)L 1.鉴别 Na2CO3与NaHCO3的鉴别与除杂 依据 原理 结论 与盐酸反 应的剧烈 程度 Na2CO3+ 2HCl===2NaCl+H2O+ CO2↑NaHCO3+ HCl=== NaCl+H2O+ CO2↑ 生成气体剧烈的是 NaHCO3,相对不剧烈 的是Na2CO3 盐酸逐滴 加入时的 现象 CO32-+H+===HCO3 - HCO3 -+H+=== CO2↑ +H2O 逐滴加入盐酸立即产 生气体的是NaHCO3, 开始不产生气体,滴 加一会才产生气体的 是Na2CO3 2.除杂 混合物 除杂方法及试剂 Na2CO3固体(NaHCO3) 加热 NaHCO3溶液(Na2CO3) 通入足量CO2气体 Na2CO3溶液(NaHCO3) 加入适量NaOH溶液 有两个无标签的试剂瓶,分别装有Na2CO3和 NaHCO3固体,有四位同学为鉴别它们采用以下不同 方法,其中不可行的是( ) A.分别将它们配制成溶液,再加入澄清石灰 水 B.分别将它们配制成溶液,再逐滴加入等浓 度的稀盐酸 C.分别将它们配制成溶液,再加入CaCl2溶液 D.分别加热,再用石灰水检验是否有CO2产生 【解析】 A项中发生的反应分别为:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,2NaHCO3 +Ca(OH)2===CaCO3↓+Na2CO3+2H2O,两者现象相同(产生白色沉淀);B项Na2CO3溶液中滴加 盐酸,开始无现象,后来产生气体,而NaHCO3溶液中一滴入盐酸立即产生气体,现象不同;C 项Na2CO3与CaCl2发生反应:Na2CO3+CaCl2===CaCO3↓+2NaCl,产生白色沉淀,NaHCO3与 CaCl2不反应,可以鉴别;D项将固体物质分别加热后,只发生反应:2NaHCO3 Na2CO3+H2O+ CO2↑,产生的CO2能使澄清石灰水变浑浊,故选A。 【答案】 A 2.下列关于碳酸钠和碳酸氢钠的比较中,正确 的是( ) A.二者在水中的溶解度不同,碳酸氢钠的溶解 度大于碳酸钠的溶解度 B.二者热稳定性不同,碳酸钠的热稳定性大于 碳酸氢钠的热稳定性 C.二者都能与盐酸反应放出二氧化碳气体,等 物质的量的碳酸钠和碳酸氢钠与同浓度的盐酸反应产 生气体的量和反应快慢不同 D.二者在一定的条件下可以相互转化 解析:选BD。相同条件下,Na2CO3在水中的溶解度比NaHCO3大,A 项不正确;Na2CO3受热不分解,NaHCO3受热易分解,Na2CO3的热稳定性比 NaHCO3大,B项正确;相等物质的量的Na2CO3、NaHCO3分别与盐酸反应生 成气体的量相等,NaHCO3反应更快,C项不正确;二者可以相互转化,D项 正确。查看更多