- 2021-04-12 发布 |
- 37.5 KB |
- 60页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年高考化学一轮复习课件:模块5 第十一单元 第3节 晶体结构与性质
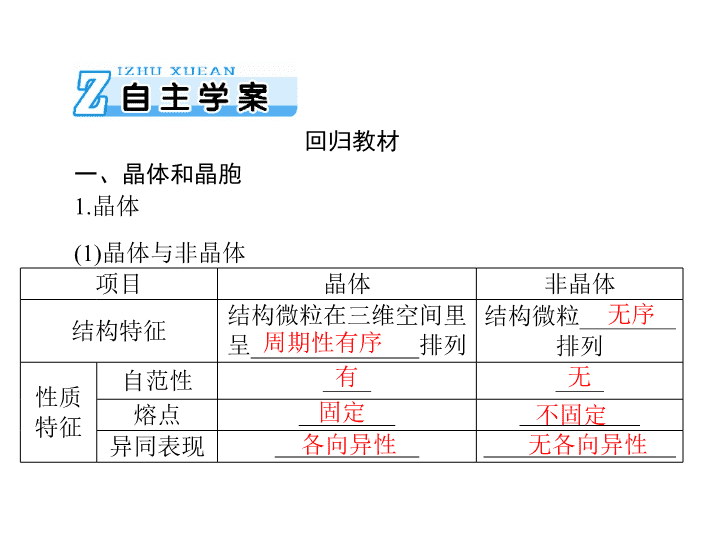
第 3 节 晶体结构与性质 考纲点击: 1. 了解晶体的 类型,了解不同类型晶体中结构 微粒、微粒间作用力的区别。 2. 了解晶格能的概念,了解晶格 能对离子晶体性质的影响。 3. 了解分子晶体结构与性质的关系。 4. 了解原子晶体的特征,能描述金刚石、二 氧化硅等原子晶体 的结构与性质的关系。 5. 理解金属键的含义,能用金属键理论 解释金属的一些物理性质。了解金属晶体常见 的堆积方式。 6. 了解晶胞的概念,能根据晶胞确定晶体的组成并进行相关的 计算。 项目 晶体 非晶体 结构特征 结构微粒在三维空间里 呈 ______________ 排列 结构微粒 ________ 排列 性质 特征 自范性 ____ ____ 熔点 ________ __________ 异同表现 ____________ ________________ 回归教材 一、晶体和晶胞 1. 晶体 无序 有 无 固定 不固定 (1) 晶体与非晶体 各向异性 无各向异性 周期性有序 项目 晶体 非晶体 区别 方法 熔点法 __________ 熔点 __________ 熔点 X- 射线 对固体进行 __________________ 实验 ( 续表 ) 有固定 无固定 X- 射线衍射 (2) 获得晶体的三种途径 ① __________ 物质凝固。 ② ________ 物质冷却不经液态直接凝固 ( 凝华 ) 。 ③溶质从溶液中 ________ 。 熔融态 气态 析出 2. 晶胞 基本单元 任何间隙 平行 取向 (1) 概念:描述晶体结构的 ____________ 。 (2) 晶体中晶胞的 排列 ——“ 无隙并置 ” ① “ 无隙 ” :相邻晶胞之间没有 ____________ 。 ②“并置”:所有晶胞都是 ________ 排列、 ________ 相同。 3. 离子晶体的晶格能 气态离子 kJ·mol - 1 (1) 定义: ____________ 形成 1 mol 离子晶体释放的能量, 通常取正值。单位 : ____________ 。 (2) 影响因素 大 小 ① 离子所带电荷数:离子所带电荷数越多,晶格能越 ______ 。 稳定 高 大 ② 离子的半径:离子的半径越 ______ ,晶格能越大。 (3) 与离子晶体性质的关系 晶格能是最能反映离子晶体稳定性的数据。晶格能越大, 形成的离子晶体越 ________ ,且熔点越 ____ ,硬度越 ____ 。 晶体类型 分子晶体 原子晶体 金属晶体 离子晶体 构成粒子 ________ ________ 金属阳离子、 自由电子 ________ 粒子间的相 互作用力 _______ ________ ________ ________ ________ 硬度 ________ ________ 有的很大, 有的很小 较大 熔、沸点 较低 ________ 有的很高, 有的很低 较高 溶解性 相似相溶 难溶于任 何溶剂 难溶于常 见溶剂 大多易溶于水 等极性溶剂 二、常见晶体类型 分子 原子 阴、阳离子 1. 四种晶体的比较 分子间 作用力 金属键 离子键 较小 很大 共价键 很高 晶体类型 分子晶体 原子晶体 金属晶体 离子晶体 导电、传 热性 一般不导 电,有的溶 于水后导电 一般不具 有导电性 电和热的 良导体 晶体不导电,在 水溶液中或熔 融状态下导电 物质类别及实例 大多数非金 属单质、气态 氢化物、酸、 非金属氧化 物 (SiO 2 除 外 ) 、绝大多 数有机物 ( 有 机盐除外 ) 部分非金属 单质 ( 如金 刚石、硅、 晶体硼 ) ,部 分非金属化 合物 ( 如 SiC 、 SiO 2 ) 金属单质 与合金 ( 如 Na 、 Al 、 Fe 、青铜 ) 金属氧化物 ( 如 K 2 O 、 Na 2 O) 、 强碱 ( 如 KOH 、 NaOH) 、绝 大部 分盐 ( 如 NaCl) (续表) 2. 晶体熔、沸点的比较 > > (1) 不同类型晶体熔、沸点的比较 ①不同类型晶体的熔、沸点高低的一般规律:原子晶体 ________ 离子晶体 ________ 分子晶体。 ②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很 高,汞、铯等熔、沸点很低。 (2) 同种晶体类型晶体熔、沸点的比较 ① 原子晶体 —— 比较共价键 强弱。 > > 原子半径越小→键长越短→键能越大→共价键越强→熔、 沸点越高。如熔点:金刚石 ______ 碳化硅 ______ 晶体硅。 ② 离子晶体 —— 比较离子键强弱或晶格能大小。 a. 一般来说,阴、阳离子所带电荷数越多 ,离子半径越小, 则离子间的作用力就越大,其离子晶体的熔、沸点就越高。如 熔点: MgO________NaCl________CsCl 。 b. 衡量离子晶体稳定性的物理量是晶格能。晶格能越大, 形成的离子晶体越稳定,熔点越高,硬度越大。 ③分子晶体 —— 比较分子间作用力大小。 a. 分子间作用力越大,物质的熔、沸点越高;具有氢键的 分子晶体熔、沸点反常地高。如沸点 H 2 O_____H 2 Te_____H 2 Se ______H 2 S 。 > > > > > b. 组成和结构相似的分子晶体,相对分子质量越大,熔、 沸点越高,如 SnH 4 _____GeH 4 _____SiH 4 _____CH 4 。 c. 组成和结构不相似的物质 ( 相对分子质量接近 ) ,分子的极 性越大,其熔、沸点越高,如 CO______N 2 , CH 3 OH______ CH 3 CH 3 。 > > > > > d. 同分异构体,支链越多,熔、沸点越低。 > > 如熔、沸点: CH 3 —CH 2 —CH 2 —CH 2 —CH 3 ______ CHCH 3 CH 3 CH 2 CH 3 ______CCH 3 CH 3 CH 3 CH 3 。 ④ 金属晶体 —— 比较金属键 的强弱。 < < 金属离子半径越小,离子所带电荷数越多,其金属键越强, 金属熔、沸点就越高。如溶、沸点: Na____Mg____Al 。 晶体 晶体结构 晶体详解 原 子 晶 体 金 刚 石 ① 每个碳与相邻 ________ 个碳以共价键结 合,形成正四面体结构; ②键角均为 ________ ; ③最小碳环由 ____ 个 C 原子组成且 6 个 C 原子不在同一平面内; ④每个 C 参与 4 个 C—C 键的形成, C 原子 数与 C—C 键数之比为 ______ SiO 2 ① 每个 Si 与 ____ 个 O 以共价键结合,形成 正四面体结构; ② 每 个 正 四 面 体 占 有 1 个 Si,4 个 O , n (Si)∶ n (O) = ______ ; ③最小环上有 ____ 个原子,即 6 个 O,6 个 Si 4 109°28′ 6 1∶2 3. 常见典型晶体模型 1∶2 4 12 ( 续表 ) 6 12 8 6 8 晶体 晶体结构 晶体详解 离子晶体 NaCl 型 ① 每个 Na + (Cl - ) 周围等距且紧邻的 Cl - (Na + ) 有 ____ 个,每个 Na + 周围等距且紧邻的 Na + 有 ____ 个; ②每个晶胞中含 4 个 Na + 和 4 个 Cl - CsCl 型 ① 每个 Cs + 周围等距且紧邻的 Cl - 有 ____ 个,每个 Cs + (Cl - ) 周围等距且紧邻的 Cs + (Cl - ) 有 ____ 个; ②如图为 ____ 个晶胞,每个晶胞中含 1 个 Cs + 、 1 个 Cl - ( 续表 ) 12 6 52% 12 74% 晶体 晶体结构 晶体详解 分子晶体 干冰 ①8 个 CO 2 分子构成立方体且在 6 个面心又各占据 1 个 CO 2 分子; ②每个 CO 2 分子周围等距且紧邻的 CO 2 分子有 ____ 个 金属晶体 简单 立方 堆积 典型代表 Po ,配位数为 ____ ,空间利用率 ______ 面心 立方 最密 堆积 又称为 A 1 型或铜型,典型代表 Cu 、 Ag 、 Au ,配位数为 ____ ,空间利用率 ______ ( 续表 ) 8 68% 12 74% 晶体 晶体结构 晶体详解 金属晶体 体心 立方 堆积 又称为 A 2 型或钾型,典型代表 Na 、 K 、 Fe ,配位数为 ____ ,空间利用率 ______ 六方 最密 堆积 又称为 A 3 型或镁型,典型代表 Mg 、 Zn 、 Ti ,配位数为 ____ ,空间利用率 ______ 基础测评 1. 据某科学杂志报道,国外有一研究发现了一种新的球形 分子,它的分子式为 C 60 Si 60 ,其分子结构好似中国传统工艺品 “镂雕”,经测定其中包含 C 60 ,也有 Si 60 结构。下列叙述正确 的是 ( ) 。 A. 该物质有很高的熔点、很大的硬度 B. 该物质形成的晶体属于分子晶体 C. 该物质分子中 Si 60 被包裹在 C 60 里面 D. 该物质的相对分子质量为 1200 解析: 由分子式及信息可知该物质为分子晶体, A 错误, B 正确; Si 的原子半径大于 C ,所以 Si 60 的体积大于 C 60 的体积, C 错误;相对分子质量为 (12 + 28)×60 = 2400 , D 错误。 答案: B ) 。 2. 下列物质的熔、沸点高低顺序正确的是 ( A. 金刚石>晶体硅>二氧化硅>碳化硅 B.CI 4 > CBr 4 > CCl 4 > CH 4 C.MgO > H 2 O > N 2 > O 2 D. 金刚石>生铁>纯铁>钠 解析: 原子晶体中共价键的键长越短,键能越大,熔、沸 点越高,则熔、沸点为金刚石>二氧化硅>碳化硅>晶体硅, A 错误;组成和结构相似的分子晶体,相对分子质量越大,熔、 沸点越高,则熔、沸点为 CI 4 > CBr 4 > CCl 4 > CH 4 , B 正确;离 子晶体的熔、沸点大于分子晶体,水中含有氢键,沸点比氮气、 氧气的高,则熔、沸点为 MgO > H 2 O > O 2 > N 2 , C 错误;熔、 沸点一般为原子晶体>金属晶体,合金的熔点比纯金属的低, 则熔、沸点为金刚石>纯铁>生铁>钠, D 错误。 答案: B 解析: 氯化钠晶体中每个 Na + 周围距离相等且紧邻的 Na + 共有 12 个, B 项错误。 答案: B 4. 钛酸钡的热稳定性好,介电常数高,在小型变压器、话 筒和扩音器中都有应用。钛酸钡晶体的晶胞结构示意图如图所 ) 。 示,它的化学式是 ( A.BaTi 8 O 12 C.BaTi 2 O 4 B.BaTi 4 O 5 D.BaTiO 3 5.(2017 年新课标 Ⅰ 卷节选 ) ① KIO 3 晶体是一种性能良好的 非线性光学材料,具有钙钛矿型的立体结构,边长为 a = 0.446 nm ,晶胞中 K 、 I 、 O 分别处于顶角、体心、面心位置, 如图所 示。 K 与 O 间的最短距离为 ________ nm ,与 K 紧邻的 O 个数为 ________ 。 ② 在 KIO 3 晶胞结构的另一种表示中, I 处于各顶角位置, 则 K 处于 ________ 位置, O 处于 ________ 位置。 答案: (1)0.315 12 (2) 体心 棱心 考点一 考向 1 晶体的组成和性质 晶体类型的判定 [ 典例 1 ](2018 年山东诸城检测 ) 下表给出几种氯化物的熔点 和沸点: 氯化物 NaCl MgCl 2 AlCl 3 SiCl 4 熔点 /℃ 801 714 190 - 70 沸点 /℃ 1413 1412 180 57.57 有关表中所列四种氯化物的性质,有以下叙述:①氯化铝 在加热时能升华;②四氯化硅在晶态时属于分子晶体;③氯化 钠晶体中微粒之间以范德华力结合;④氯化铝晶体是典型的离 子晶体。其中与表中数据一致的是 ( ) 。 A.①② B.②③ C.①②④ D.②④ 解析: 氯化铝的熔、沸点都很低,其晶体是分子晶体,并 且沸点比熔点还低,加热时容易升华,①正确,④错误;四氯 化硅是共价化合物,并且熔、沸点很低,属于分子晶体,②正 确;氯化钠、氯化镁是离子晶体,以离子键结合,③错误。 答案: A [ 方法技巧 ] 晶体类型判断方法 (1) 依据构成晶体的微粒和微粒间的作用判断 ① 离子晶体的构成微粒是阴、阳离子,微粒间的作用是离 子键。 ② 原子晶体的构成微粒是原子,微粒间的作用是共价键。 ③ 分子晶体的构成微粒是分子,微粒间的作用为分子间作 用力。 ④ 金属晶体的构成微粒是金属阳离子和自由电子,微粒间 的作用是金属键 。 (2) 依据物质的分类判断 ① 金属氧化物 ( 如 K 2 O 、 Na 2 O 等 ) 、强碱 (NaOH 、 KOH 等 ) 和绝大多数的盐类是离子晶体。 ② 大多数非金属单质 ( 除金刚石、石墨、晶体硅等 ) 、非金 属氢化物、非金属氧化物 ( 除 SiO 2 外 ) 、几乎所有的酸、绝大多 数有机物 ( 除有机盐外 ) 是分子晶体。 ③ 常见的单质类原子晶体有金刚石、晶体硅、晶体硼等, 常见的化合物类原子晶体有碳化硅、二氧化硅等。 ④ 金属单质、合金是金属晶体。 (3) 根据各类晶体的特征性质判断 一般来说,低熔、沸点的化合物为分子晶体;熔、沸点较 高,且在水溶液中或熔融状态下能导电的化合物为离子晶体; 熔、沸点很高,不导电,不溶于一般溶剂的物质为原子晶体; 能导电、传热、具有延展性的晶体为金属晶体。 考向 2 四种晶体类型的性质比较 解析: A 项,金属离子所带电荷越多、半径越小,其熔点 越高,则熔点由高到低为 Al>Mg>Na ,错误; B 项,键长越短, 共价键越强,硬度越大,键长 C—C查看更多