- 2021-04-12 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
铁、铜的获取及应用复习教学案
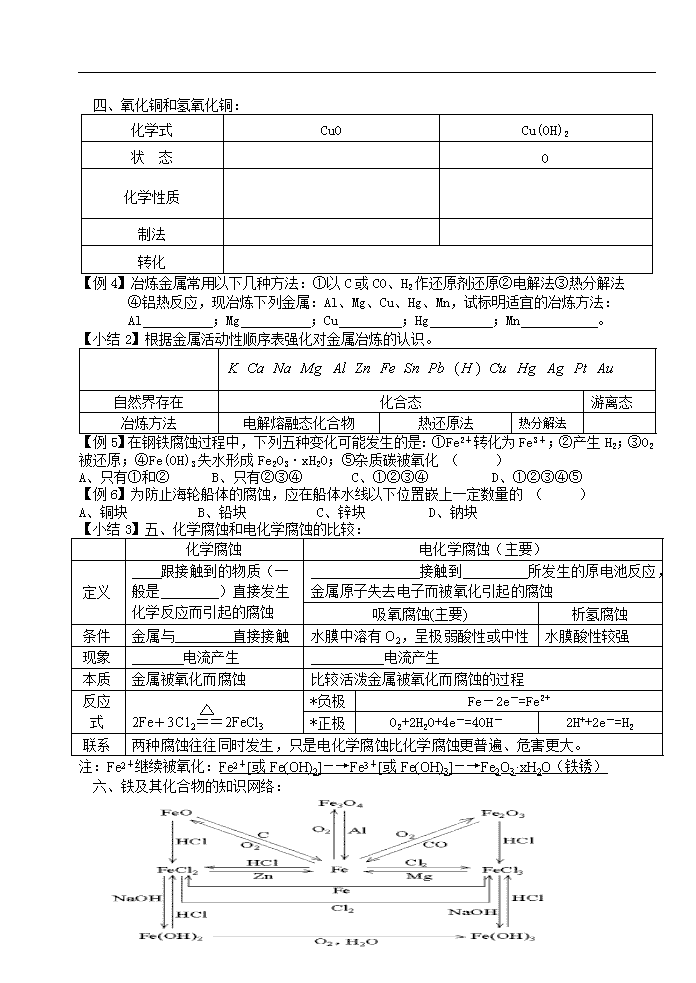
专题三第二单元铁、铜的获取及应用 教学目的 1、掌握铁和铜及其化合物的性质。2、掌握Fe2+与Fe3+的检验。 3、掌握金属冶炼及规律。4、掌握钢铁的腐蚀。 教学过程 【例1】A、B、C、D、E分别是Cu、Ag、Fe、Al、Mg五种金属中的一种,已知:①A、C均能与稀H2SO4反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C与强碱反应放出气体;④C、E在冷浓硝酸中发生钝化.由此可判断A、B、C、D、E依次为 ( ) A、Fe、Cu、Al、Ag、Mg B、Al、Cu、Mg、Ag、Fe C、Mg、Cu、Al、Ag、Fe D、Mg、Ag、Al、Cu、Fe 【例2】下列各组物质充分反应后的产物中,滴入KSCN溶液显红色的是 A、FeO和稀盐酸 B、过量铁粉跟稀硫酸 C、氯水跟FeCl2溶液 D、过量铁粉跟硫酸铁溶液 【例3】把表面有氧化物的相同大小的铜片和铁片一起放入盐酸中充分反应,所得溶液中的金属离子( ) A、是Fe3+和Cu2+ B、是Fe2+和Cu2+ C、是Fe2+和Fe3+ D、只有Fe2+ 【小结1】一、铁和铜的性质比较: Fe Cu 物理性质 化 学 性 质 与O2反应 空气中 燃烧 ------------ 其它非金属 S Cl2 与水反应 ------------ 与酸反应 盐酸 ------------ 浓硝酸 与盐溶液反应 用途 冶炼 三、Fe2+与Fe3+的检验: 物质 Fe2+ Fe3+ 溶液颜色 化学性质 检 验 观察法 碱法 SCN-法 氧化还原法 第4页 共4页 四、氧化铜和氢氧化铜: 化学式 CuO Cu(OH)2 状 态 O 化学性质 制法 转化 【例4】冶炼金属常用以下几种方法:①以C或CO、H2作还原剂还原②电解法③热分解法 ④铝热反应,现冶炼下列金属:Al、Mg、Cu、Hg、Mn,试标明适宜的冶炼方法: Al ;Mg ;Cu ;Hg ;Mn 。 【小结2】根据金属活动性顺序表强化对金属冶炼的认识。 自然界存在 化合态 游离态 冶炼方法 电解熔融态化合物 热还原法 热分解法 【例5】在钢铁腐蚀过程中,下列五种变化可能发生的是:①Fe2+转化为Fe3+;②产生H2;③O2 被还原;④Fe(OH)3失水形成Fe2O3·xH2O;⑤杂质碳被氧化 ( ) A、只有①和② B、只有②③④ C、①②③④ D、①②③④⑤ 【例6】为防止海轮船体的腐蚀,应在船体水线以下位置嵌上一定数量的 ( ) A、铜块 B、铅块 C、锌块 D、钠块 【小结3】五、化学腐蚀和电化学腐蚀的比较: 化学腐蚀 电化学腐蚀(主要) 定义 跟接触到的物质(一般是 )直接发生化学反应而引起的腐蚀 接触到 所发生的原电池反应, 金属原子失去电子而被氧化引起的腐蚀 吸氧腐蚀(主要) 析氢腐蚀 条件 金属与 直接接触 水膜中溶有O2,呈极弱酸性或中性 水膜酸性较强 现象 电流产生 电流产生 本质 金属被氧化而腐蚀 比较活泼金属被氧化而腐蚀的过程 反应式 2Fe+3C12==2FeCl3 *负极 Fe-2e-=Fe2+ *正极 O2+2H2O+4e-=4OH- 2H++2e-=H2 联系 两种腐蚀往往同时发生,只是电化学腐蚀比化学腐蚀更普遍、危害更大。 注:Fe2+继续被氧化:Fe2+[或Fe(OH)2]-→Fe3+[或Fe(OH)3]-→Fe2O3·xH2O(铁锈) 六、铁及其化合物的知识网络: 第4页 共4页 【课外练习】 1、根据Fe+CuCl2=FeCl2+Cu;2FeCl3+Cu=2FeCl2+CuCl2两个反应,判断Fe3+、Fe2+、Cu2+的氧化性强弱顺序为 ( ) A、Cu2+>Fe2+>Fe3+ B、Fe3+>Fe2+>Cu2+ C、Fe3+>Cu2+>Fe2+ D、Fe2+>Fe3+>Cu2+ 2、为除去FeSO4溶液中的Fe2(SO4)3和CuSO4,最好选用 ( ) A.烧碱溶液 B.浓氨水 C.镁粉 D.铁粉 3、电子工业中常用FeCl3溶液腐蚀印刷电路板,欲从腐蚀后的废液中回收Cu及制取纯净的FeCl3溶液,需要下列试剂:①蒸馏水②铁粉③浓H2SO4④浓盐酸⑤烧碱⑥浓氨水⑦Cl2中的 ( ) A、①②④⑦ B、①③④⑥ C、②④⑥⑦ D、①④⑥⑦ 4、将下列四种铁的化合物溶于稀盐酸,滴加KSCN溶液没有颜色变化,再加入氯水即呈红色的是 ( ) A.FeS B.Fe2O3 C.FeCl3 D.Fe2(SO4)3 5、下列金属冶炼的反应原理,错误的是( ) A、2NaCl(熔融) 2Na + Cl2↑ B、MgO + H2 Mg + H2O C、Fe3O4 + 4CO 3Fe + 4CO2 D、2HgO 2Hg + O2↑ 6、下列说法正确的是( ) A.使元素的化合态转化成游离态的过程就是还原的过程 B.高炉炼铁的原料有铁矿石、焦炭和空气。工业上就是用焦炭还原铁矿石,以制得生铁 C.电解熔融氧化铝时,每还原出铝,必有电子转移 D.工业上常用电解水溶液的方法制取金属钠 7、如图,各容器中盛有海水,铁在其中被腐蚀由快到慢的顺序为 ( ) A、④>②>①>③ B、②>①>③>④ C、④>②>③>① D、③>②>④>① 8、下列各组离子在水溶液中能大量共存的是 ( ) A、Fe3+、Fe2+、Cl-、OH- B、Fe2+、H+、Na+、NO3- C、H+、Fe2+、SO42-、Cl- D、Fe3+、NO3-、K+、CSN- 9、某500mL溶液中含0.1 mol Fe2+、0.2 mol Fe3+,加入0.2 mol 铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变) ( ) A.0.4 mol·L-1 B.0.6 mol·L-1 C.0.8 mol·L-1 D.1.0 mol·L-11、 10、某磁铁矿石200 t,经分析其中含有铁元素86.9 t (杂质中不含铁元素),则磁铁矿中Fe3O4的质量分数为 ( ) 第4页 共4页 A. 50% B. 60% C. 65% D. 70% *11、向FeCl3溶液中加入a g铜粉,搅拌全部溶解,然后再向其中加入b g铁粉,经充分反应 后得滤渣c g ,若已知a>b>c,则推断c g滤渣是________,滤液中存在的阳离子是_________. 12、用CO还原赤铁矿可得到一种具有银白色金属光泽的单质A,A在纯氧中燃烧可得到一种黑 色固体B,将A投入到稀盐酸溶液中,可产生一种可燃性气体C,将A投入硫酸铜溶液中,生成 一种红色固体。 (1) 写出A、B、C、D的名称:A ,B ,C ,D ; (2) 写出各步反应的化学方程式: ① ,② , ③ ,④ 。 *13.粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:①取适量A 进行铝热反应,产物中有单质B生成;②另取20 g A全部溶于0.15 L 6.0 mol·盐酸中, 得溶液C;③将①中得到的单质B和溶液C反应,放出 l.12 L(标况)气体,同时生成溶液D, 还残留有固体物质B;④用KSCN溶液检验时,溶液D不变色。请填空: (1)①中引发铝热反应的实验操作________________________,产物中的单质B是________。 (2)②中所发生的各反应的化学方程式是___________________________。 (3)③中所发生的各反应的离子方程式是__________________________________。 (4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为____________, c(Fe2+)为_____________。 14.(14分)实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华。下图是两个学生设计的实验装置、左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答: (1)B中反应的化学方程式为:__________________________________________; (2)D中的反应开始前,需排除装置中的空气,应采取的方法是:__________ _。 (3)D中反应化学方程式为:________________________ ___________________。 (4)装置(Ⅰ)的主要缺点是:___________________________________ ____ _______。 (5)装置(Ⅱ)的主要缺点是:______________________________________ _ _______。 如果选用此装置来完成实验,则必须采取的改进措施是:____________ _________。 15.将55 g铁片放入硫酸铜溶液片刻,取出洗涤干燥后称重,质量为56.6 g,求参加反应的铁和生成的铜的质量。 第4页 共4页查看更多