- 2021-04-12 发布 |
- 37.5 KB |
- 4页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020版高中化学 第3章 自然界中的元素
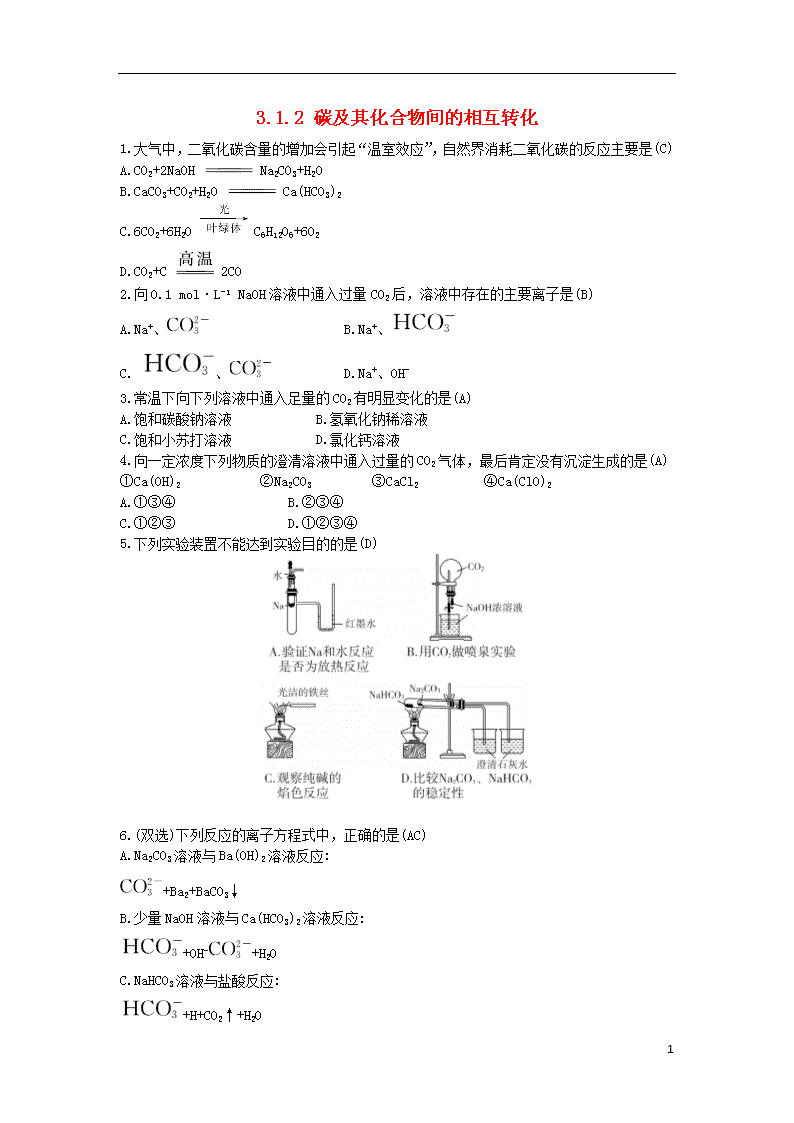
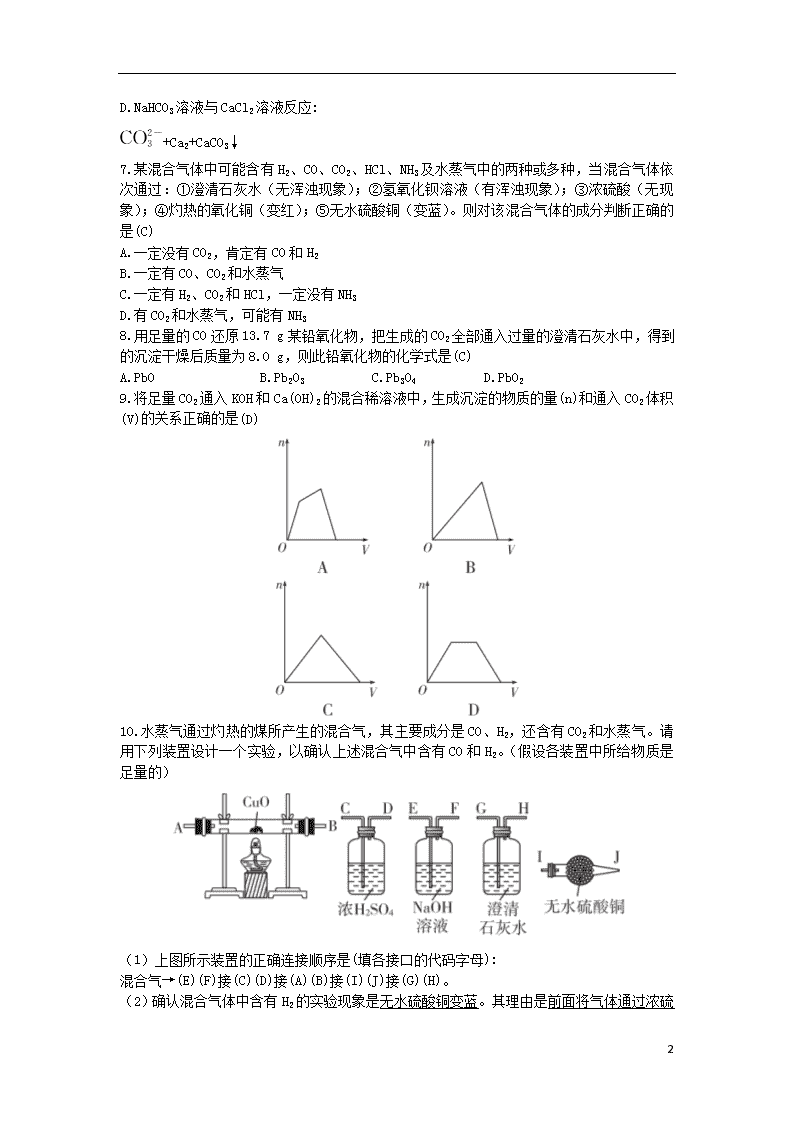
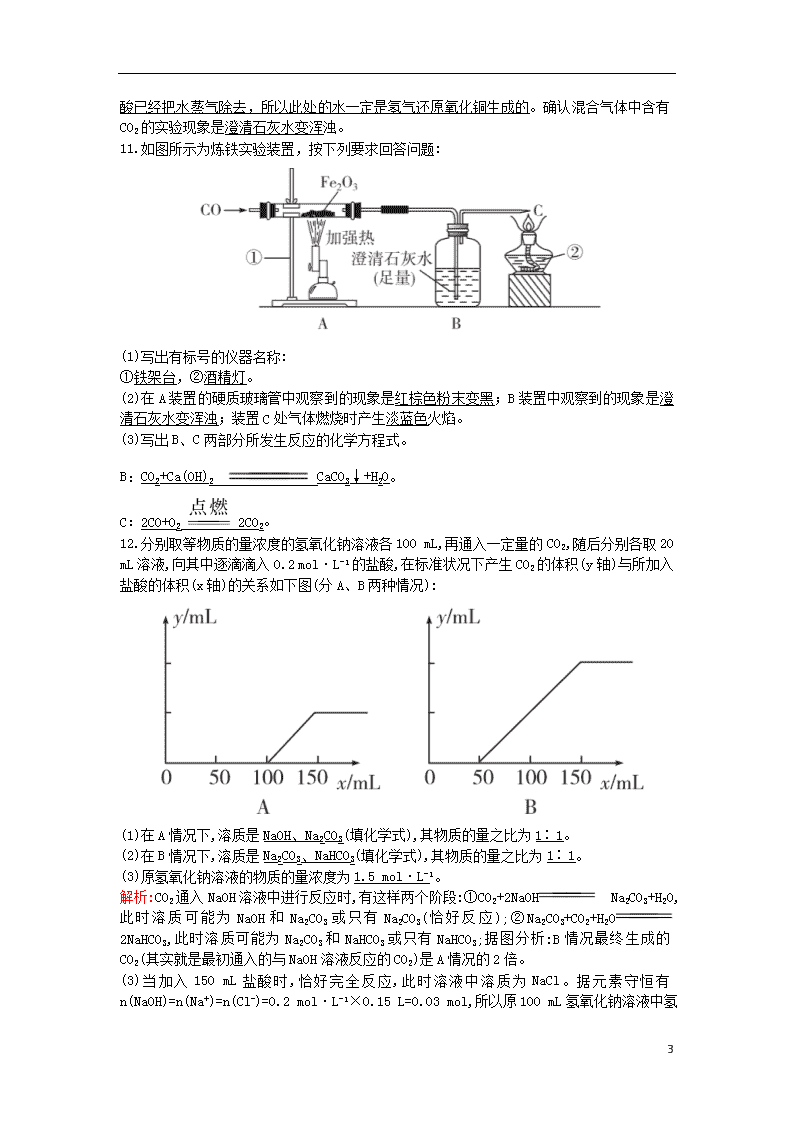
3.1.2 碳及其化合物间的相互转化 1.大气中,二氧化碳含量的增加会引起“温室效应”,自然界消耗二氧化碳的反应主要是(C) A.CO2+2NaOH Na2CO3+H2O B.CaCO3+CO2+H2O Ca(HCO3)2 C.6CO2+6H2O C6H12O6+6O2 D.CO2+C 2CO 2.向0.1 mol·L-1 NaOH溶液中通入过量CO2后,溶液中存在的主要离子是(B) A.Na+、 B.Na+、 C. 、 D.Na+、OH- 3.常温下向下列溶液中通入足量的CO2有明显变化的是(A) A.饱和碳酸钠溶液 B.氢氧化钠稀溶液 C.饱和小苏打溶液 D.氯化钙溶液 4.向一定浓度下列物质的澄清溶液中通入过量的CO2气体,最后肯定没有沉淀生成的是(A) ①Ca(OH)2 ②Na2CO3 ③CaCl2 ④Ca(ClO)2 A.①③④ B.②③④ C.①②③ D.①②③④ 5.下列实验装置不能达到实验目的的是(D) 6.(双选)下列反应的离子方程式中,正确的是(AC) A.Na2CO3溶液与Ba(OH)2溶液反应: +Ba2+BaCO3↓ B.少量NaOH溶液与Ca(HCO3)2溶液反应: +OH-+H2O C.NaHCO3溶液与盐酸反应: +H+CO2↑+H2O 4 D.NaHCO3溶液与CaCl2溶液反应: +Ca2+CaCO3↓ 7.某混合气体中可能含有H2、CO、CO2、HCl、NH3及水蒸气中的两种或多种,当混合气体依次通过:①澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);③浓硫酸(无现象);④灼热的氧化铜(变红);⑤无水硫酸铜(变蓝)。则对该混合气体的成分判断正确的是(C) A.一定没有CO2,肯定有CO和H2 B.一定有CO、CO2和水蒸气 C.一定有H2、CO2和HCl,一定没有NH3 D.有CO2和水蒸气,可能有NH3 8.用足量的CO还原13.7 g某铅氧化物,把生成的CO2全部通入过量的澄清石灰水中,得到的沉淀干燥后质量为8.0 g,则此铅氧化物的化学式是(C) A.PbO B.Pb2O3 C.Pb3O4 D.PbO2 9.将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是(D) 10.水蒸气通过灼热的煤所产生的混合气,其主要成分是CO、H2,还含有CO2和水蒸气。请用下列装置设计一个实验,以确认上述混合气中含有CO和H2。(假设各装置中所给物质是足量的) (1)上图所示装置的正确连接顺序是(填各接口的代码字母): 混合气→(E)(F)接(C)(D)接(A)(B)接(I)(J)接(G)(H)。 (2)确认混合气体中含有H2的实验现象是无水硫酸铜变蓝。其理由是 4 前面将气体通过浓硫酸已经把水蒸气除去,所以此处的水一定是氢气还原氧化铜生成的。确认混合气体中含有CO2的实验现象是澄清石灰水变浑浊。 11.如图所示为炼铁实验装置,按下列要求回答问题: (1)写出有标号的仪器名称: ①铁架台,②酒精灯。 (2)在A装置的硬质玻璃管中观察到的现象是红棕色粉末变黑;B装置中观察到的现象是澄清石灰水变浑浊;装置C处气体燃烧时产生淡蓝色火焰。 (3)写出B、C两部分所发生反应的化学方程式。 B:CO2+Ca(OH)2 CaCO3↓+H2O。 C:2CO+O2 2CO2。 12.分别取等物质的量浓度的氢氧化钠溶液各100 mL,再通入一定量的CO2,随后分别各取20 mL溶液,向其中逐滴滴入0.2 mol·L-1的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如下图(分A、B两种情况): (1)在A情况下,溶质是NaOH、Na2CO3(填化学式),其物质的量之比为1∶1。 (2)在B情况下,溶质是Na2CO3、NaHCO3(填化学式),其物质的量之比为1∶1。 (3)原氢氧化钠溶液的物质的量浓度为1.5 mol·L-1。 解析:CO2通入NaOH溶液中进行反应时,有这样两个阶段:①CO2+2NaOH Na2CO3+H2O,此时溶质可能为NaOH和Na2CO3或只有Na2CO3(恰好反应);②Na2CO3+CO2+H2O 2NaHCO3,此时溶质可能为Na2CO3和NaHCO3或只有NaHCO3;据图分析:B情况最终生成的CO2(其实就是最初通入的与NaOH溶液反应的CO2)是A情况的2倍。 (3)当加入150 mL盐酸时,恰好完全反应,此时溶液中溶质为NaCl。据元素守恒有n(NaOH)=n(Na+)=n(Cl-)=0.2 mol·L-1×0.15 L=0.03 mol,所以原100 4 mL氢氧化钠溶液中氢氧化钠的物质的量为n(NaOH)=0.15 mol,c(NaOH)= =1.5 mol·L-1。 4查看更多