- 2021-02-26 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学高考题型对点练十二化学工艺流程综合含解析
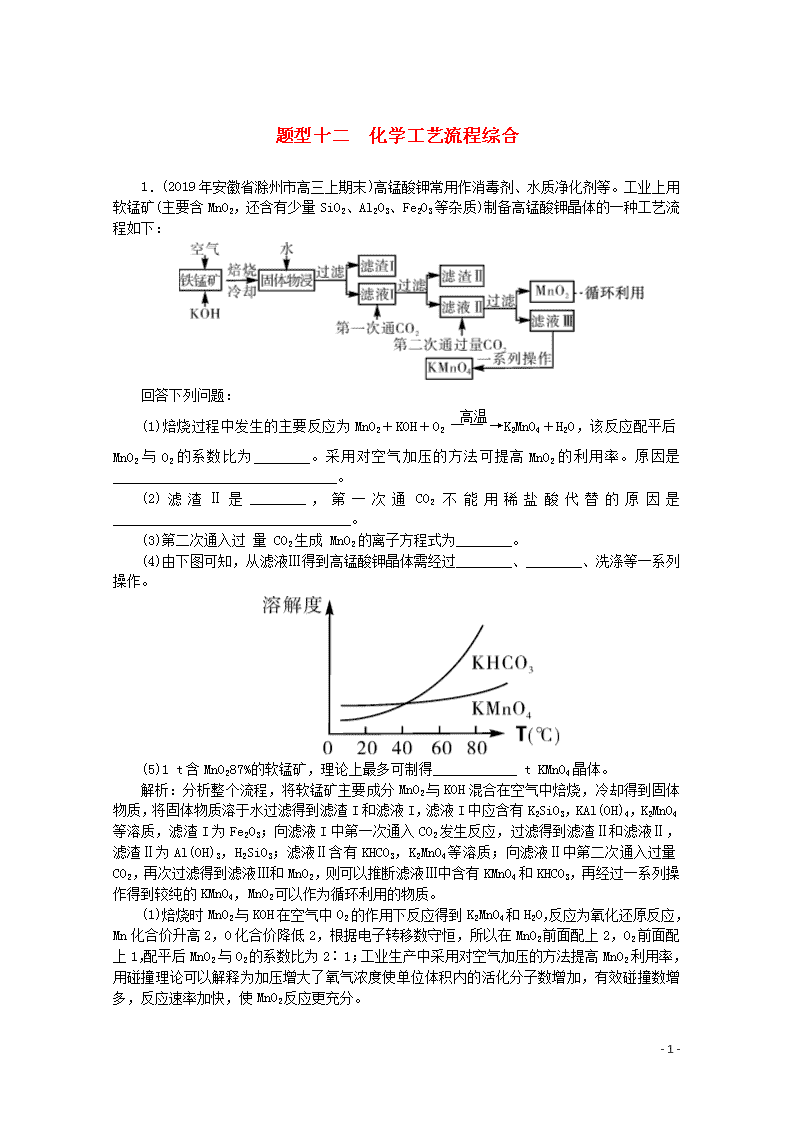
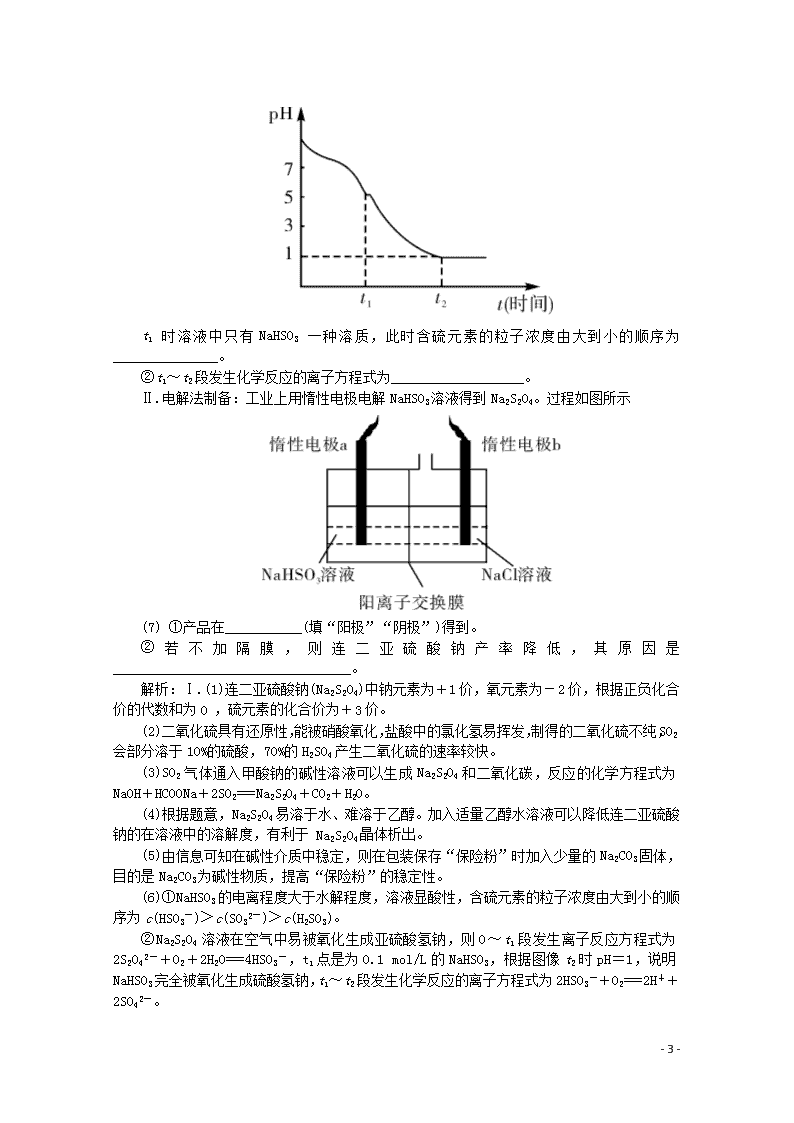
题型十二 化学工艺流程综合 1.(2019年安徽省滁州市高三上期末)高锰酸钾常用作消毒剂、水质净化剂等。工业上用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)制备高锰酸钾晶体的一种工艺流程如下: 回答下列问题: (1)焙烧过程中发生的主要反应为MnO2+KOH+O2K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是________________________________。 (2)滤渣Ⅱ是________,第一次通CO2不能用稀盐酸代替的原因是__________________________________。 (3)第二次通入过 量 CO2生成 MnO2的离子方程式为________。 (4)由下图可知,从滤液Ⅲ得到高锰酸钾晶体需经过________、________、洗涤等一系列操作。 (5)1 t含MnO287%的软锰矿,理论上最多可制得____________ t KMnO4晶体。 解析:分析整个流程,将软锰矿主要成分MnO2与KOH混合在空气中焙烧,冷却得到固体物质,将固体物质溶于水过滤得到滤渣I和滤液I,滤液I中应含有K2SiO3,KAl(OH)4,K2MnO4等溶质,滤渣I为Fe2O3;向滤液I中第一次通入CO2发生反应,过滤得到滤渣Ⅱ和滤液Ⅱ,滤渣Ⅱ为Al(OH)3,H2SiO3;滤液Ⅱ含有KHCO3,K2MnO4等溶质;向滤液Ⅱ中第二次通入过量CO2,再次过滤得到滤液Ⅲ和MnO2,则可以推断滤液Ⅲ中含有KMnO4和KHCO3,再经过一系列操作得到较纯的KMnO4,MnO2可以作为循环利用的物质。 (1)焙烧时MnO2与KOH在空气中O2的作用下反应得到K2MnO4和H2O,反应为氧化还原反应,Mn化合价升高2,O化合价降低2,根据电子转移数守恒,所以在MnO2前面配上2,O2前面配上1,配平后MnO2与O2的系数比为2∶1;工业生产中采用对空气加压的方法提高MnO2利用率,用碰撞理论可以解释为加压增大了氧气浓度使单位体积内的活化分子数增加,有效碰撞数增多,反应速率加快,使MnO2反应更充分。 - 8 - (2)滤渣Ⅱ中含有的物质有Al(OH)3,H2SiO3,第一次通CO2不能用稀盐酸代替,这是由于稀盐酸酸性较强,可溶解Al(OH)3,不易控制稀盐酸的用量,溶液中便会再次混入Al3+。 (3)第二次通入过量CO2生成MnO2,溶液中原先是K2MnO4,再第二次通入过量的CO2时发生歧化反应生成MnO2和KMnO4,此时CO2被转化为HCO3-,反应为氧化还原反应,则反应的离子方程式为:3MnO42-+4CO2+2H2O===MnO2↓+2MnO4-+4HCO3-。 (4)将滤液Ⅲ进行一系列操作得KMnO4,此时溶液中还存在KHCO3,根据溶解度随温度变化的图像分析,随着温度升高,二者溶解度均不断增大,在40℃附近时二者溶解度相等,超过这一温度时,KHCO3溶解度不断增大,KMnO4溶解度则增大较缓慢,所以从溶液中提取较纯的KMnO4,需要蒸发结晶,趁热过滤,洗涤等操作。 (5)工业上按上述流程连续生产,含MnO287%的软锰矿1吨,理论上第一步完全转化为K2MnO4,第二步转化为KMnO4时则是发生歧化反应,由于歧化反应产物得到MnO2可以循环使用,所以理论最多产量则是根据Mn元素守恒完全生成KMnO4的量,为=1.58 t。 答案:(1)2∶1 加压,增大了氧气的浓度,反应速率加快,使MnO2反应更充分 (2)Al(OH)3、H2SiO3 不易控制稀盐酸的用量,过量的稀盐酸会使Al(OH)3溶解(或酸性过强,会使K2MnO4过早发生歧化反应) (3)3MnO42-+4CO2+2H2O===MnO2↓+2MnO4-+4HCO3- (4)蒸发结晶 趁热过滤 (5)1.58 2.(2019年辽宁省沈阳市高三教学质量监测)保险粉又称连二亚硫酸钠(Na2S2O4),可用于纺织工业的漂白剂、脱色剂,脱氯剂。Na2S2O4是白色粉末,无味,易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定。 Ⅰ.甲酸钠( HCOONa) 法制备过程如下: (1)连二亚硫酸钠中硫元素的化合价为__________。 (2)实验室用Na2SO3 固体和某酸反应制备SO2气体,制备SO2时所选用的酸,你认为下列最适宜选用的是______________。 A.浓盐酸 B.浓硝酸 C.质量分数为70%的硫酸 D.质量分数为10%的硫酸 (3)步骤①中制备连二亚硫酸钠的化学方程式可表示为____________________________。 (4)上述步骤②中,加入适量乙醇水溶液的作用是______________。 (5)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是_________________________。 (6)①现将0.05 mol/L Na2S2O4溶液在空气中放置,其溶液的pH 与时间(t)的关系如图所示。 - 8 - t1时溶液中只有NaHSO3一种溶质,此时含硫元素的粒子浓度由大到小的顺序为_______________。 ②t1~t2段发生化学反应的离子方程式为___________________。 Ⅱ.电解法制备:工业上用惰性电极电解NaHSO3溶液得到Na2S2O4。过程如图所示 (7) ①产品在___________(填“阳极”“阴极”)得到。 ②若不加隔膜,则连二亚硫酸钠产率降低,其原因是__________________________________。 解析:Ⅰ.(1)连二亚硫酸钠(Na2S2O4)中钠元素为+1价,氧元素为-2价,根据正负化合价的代数和为0 ,硫元素的化合价为+3价。 (2)二氧化硫具有还原性,能被硝酸氧化,盐酸中的氯化氢易挥发,制得的二氧化硫不纯,SO2会部分溶于10%的硫酸,70%的H2SO4产生二氧化硫的速率较快。 (3)SO2气体通入甲酸钠的碱性溶液可以生成Na2S2O4和二氧化碳,反应的化学方程式为NaOH+HCOONa+2SO2===Na2S2O4+CO2+H2O。 (4)根据题意,Na2S2O4易溶于水、难溶于乙醇。加入适量乙醇水溶液可以降低连二亚硫酸钠的在溶液中的溶解度,有利于 Na2S2O4晶体析出。 (5)由信息可知在碱性介质中稳定,则在包装保存“保险粉”时加入少量的Na2CO3固体,目的是Na2CO3为碱性物质,提高“保险粉”的稳定性。 (6)①NaHSO3的电离程度大于水解程度,溶液显酸性,含硫元素的粒子浓度由大到小的顺序为c(HSO3-)>c(SO32-)>c(H2SO3)。 ②Na2S2O4溶液在空气中易被氧化生成亚硫酸氢钠,则0~t1段发生离子反应方程式为2S2O42-+O2+2H2O===4HSO3-,t1点是为0.1 mol/L的NaHSO3,根据图像t2时pH=1,说明NaHSO3完全被氧化生成硫酸氢钠,t1~t2段发生化学反应的离子方程式为2HSO3-+O2===2H++2SO42-。 - 8 - Ⅱ.(7) ①用惰性电极电解NaHSO3溶液得到Na2S2O4,反应过程中S元素的化合降低,被还原,应该在阴极上反应得到Na2S2O4。 ②若不加隔膜,则部分HSO3-到阳极失电子发生氧化反应,也可能被阳极产生的氯气氧化,结果都会生成硫酸根离子,得不到连二亚硫酸钠,使连二亚硫酸钠产率下降。 答案:(1)+3 (2)C (3)NaOH+HCOONa+2SO2===Na2S2O4+CO2+H2O (4)连二亚硫酸钠难溶于乙醇,用乙醇水溶液可降低连二亚硫酸钠的在溶液中的溶解度,有利于 Na2S2O4晶体析出 (5)Na2CO3为碱性物质, 提高“保险粉”的稳定性 (6)①c(HSO3-)>c(SO32-)>c(H2SO3) ②2HSO3-+O2===2H++2SO42- (7)①阴极 ②若不加隔膜,则部分HSO3-到阳极失电子发生氧化反应生成硫酸根离子, 得不到连二亚硫酸钠,使连二亚硫酸钠产率下降或部分HSO3-被阳极产生的 Cl2氧化生成SO42-,使连二亚硫酸钠产率下降 3.(2019年湖北襄阳高三月考)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下: (1)写出工业上制取Cl2的化学方程式______________________。 (2)在“反应液1”中加入KOH固体的目的是①_____________,②提供碱性环境。 (3)写出Fe(NO3)3溶液与碱性KClO溶液反应的化学方程式:______________________________________。 (4)K2FeO4可作为新型多功能水处理剂的原因是: ①________________________________, ②_________________________________________。 (5)从“反应液Ⅱ”中分离出K2FeO4后,副产品是_____________(写化学式)。 (6)该工艺每得到1.98 kg K2FeO4,理论上消耗Cl2的物质的量为___________ mol. 解析:(1)工业是利用电解饱和食盐水制取氯气.反应方程式为2NaCl+2H2O2NaOH+H2↑+Cl2↑。 (2)由工艺流程可知,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应生成KClO。 (3)根据分析可知,Fe(NO3)3溶液与碱性KClO溶液反应生成高铁酸钾和氯化钾,反应的化学方程式为2Fe(NO3)3+3KClO+10KOH===2K2FeO4+3KCl+6KNO3+5H2O。 (4)K2FeO4具有强氧化性,可杀菌消毒,同时被还原形成Fe(OH)3胶体,可吸附水中悬浮物形成沉淀,所以K2FeO4可作为新型多功能水处理剂的原因是①K2FeO4具有强氧化性,可杀菌消毒;②还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物形成沉淀。 (5)由工艺流程及③可知,从“反应液II”中分离出K2FeO4后,会有副产品KNO3、KCl。 (6)根据反应Cl2+2OH-===Cl-+ClO-+H2O和2Fe3++3ClO-+10OH-===2FeO42-+3Cl-+5H2O,可得关系式2K2FeO4~3Cl2,1.98 kg K2FeO4的物质的量为10 mol,根据关系式可知氯气的物质的量为15 mol。 答案:(1)2NaCl+2H2O2NaOH+H2↑+Cl2↑ (2)与“反应液Ⅰ”中过量的Cl2继续反应生成KClO (3)2Fe(NO3)3+3KClO+10KOH===2K2FeO4+3KCl+6KNO3+5H2O - 8 - (4)K2FeO4具有强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物形成沉淀 (5)KNO3、KCl (6)15 4.(2019年天津六校联考)硼和铝位于同一主族,它们可以形成许多组成和性质类似的化合物。一种用硼镁矿(Mg2B2O5·H2O)制取单质硼的工艺流程图如图1: 结合流程图回答下列问题: (1)溶液a、溶液b中溶质的化学式分别为_____________、_____________________. (2)写出步骤①的化学方程式__________________________. (3)写出步骤②的离子方程式___________________________. (4)步骤③中化学反应可以发生的原因是___________________. (5)过硼酸钠晶体(NaBO3·4H2O)是一种优良的漂白剂,在70℃以上加热会逐步失去结晶水.实验测得过硼酸钠晶体的质量随温度变化的情况如图2所示,则T2℃时所得晶体的化学式为_____________. 图2 解析:硼镁矿与氢氧化钠溶液反应,过滤除去杂质,NaBO2溶液中,通入过量的二氧化碳,得到Na2B4O7·10H2O与NaHCO3,过滤分离,由于硼酸的酸性小于硫酸,符合复分解反应由强酸制弱酸的原理,且硼酸的溶解度较小,故Na2B4O7·10H2O晶体与硫酸反应得到硼酸,溶液b中含有硫酸钠,硼酸晶体加热分解得到B2O3,最后用Mg还原得到粗硼. (1)由上述分析可知,第①步通入过量二氧化碳,则a为NaHCO3,第③步加入硫酸,b为Na2SO4。 (2)第①步为Mg2B2O5·H2O与氢氧化钠溶液反应生成NaBO2与Mg(OH)2,反应方程式为:Mg2B2O5·H2O+2NaOH===2NaBO2+2Mg(OH)2。 - 8 - (3)NaBO2和二氧化碳反应生成Na2B4O7·10H2O和碳酸氢钠,离子方程式为2Na++4BO2-+2CO2+11H2O===Na2B4O7·10H2O↓+2HCO3-。 (4)步骤③中化学反应可以发生的原因是:硼酸的酸性小于硫酸,符合复分解反应由强酸制弱酸的原理,且硼酸的溶解度较小,从溶液中析出有利于该反应的进行。 (5)过硼酸钠晶体(NaBO3·4H2O)的物质的量==0.2 mol,T2 ℃质量变化为27.20 g,质量变化30.8 g-27.20 g=3.6 g,减少水的质量==0.2 mol,则1 mol NaBO3·4H2O失去水1 mol,则T2 ℃时所得晶体的化学式为NaBO3·3H2O。 答案:(1)NaHCO3;Na2SO4 (2)Mg2B2O5·H2O+2NaOH===2NaBO2+2Mg(OH)2 (3)2Na++4BO2-+2CO2+11H2O===Na2B4O7·10H2O↓+2HCO3- (4)硼酸的酸性小于硫酸,符合复分解反应由强酸制弱酸的原理,且硼酸的溶解度较小,从溶液中析出有利于该反应的进行 (5)NaBO3·3H2O 5.(2019年江西省高安市高三模拟考试)氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化变成绿色;见光分解变成褐色。如图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程: 根据以上信息回答下列问题: (1)生产过程中X的化学式为__________。 (2)写出产生CuCl的离子方程式:__________________。 (3)实验探究pH对CuCl产率的影响如下表所示: pH 1 2 3 4 5 6 7 CuCl产率/% 70 90 82 78 75 72 70 析出CuCl晶体最佳pH为________,当pH较大时CuCl产率变低原因是_______________________________________________。调节pH时,_____(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由是__________________。 (4)氯化亚铜的定量分析: ①称取样品0.25 g和过量的FeCl3溶液于锥形瓶中,充分溶解。 ②用0.10 mol·L-1硫酸铈标准溶液滴定。已知:CuCl+FeCl3===CuCl2+FeCl2、Fe2++Ce4+===Fe3++Ce3+。三次平行实验结果如下(平行实验结果相差不能超过1%): - 8 - 平行实验次数 1 2 30 0.25 g样品消耗硫酸铈标准溶液的体积(mL) 24.35 24.05 23.95 则样品中CuCl的纯度为_____________。(结果保留三位有效数字)。 (5)由CuCl水解再热分解可得到纳米Cu2O。第一步CuCl水解的离子方程式为:CuCl(s)+H2O(l) CuOH(s)+Cl-(aq)+H+(aq),第二步CuOH热分解的化学方程式为___________________________。第一步CuCl水解反应的平衡常数K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=______________________。 解析:废液中含有Fe3+、Cu2+、Fe2+、Cl-,从流程图中知滤渣②能与浓硫酸反应得到硫酸铜溶液和二氧化硫气体,确定滤渣②是铜,铜和Z反应得到CuCl2,Z是氯气,废液中还含有Fe3+、Fe2+,滤液①能与Cl2反应得到蚀刻液,所以滤液①为FeCl2,滤液②能与滤液①混合,则滤渣①为铁与铜的混合物,所以过量的Y为盐酸,废液中加入过量的Fe粉将Fe3+还原为Fe2+。据此答题。 (1)根据上述分析可知,生产过程中的X为Fe。 (2)由SO2、CuSO4、CuCl2调节pH反应得到CuCl和H2SO4,生成CuCl的离子反应方程式为2Cu2++2Cl-+SO2+2H2O===2CuCl↓+4H++SO42-。 (3)从pH对CuCl产率影响表中直接能看出当pH=2时,CuCl的产率最大,所以析出CuCl晶体最佳pH为2;溶液中存在Cu2+的水解,Cu2++2H2OCu(OH)2+2H+,当pH增大时,氢离子浓度减小,反应向正方向进行,使得Cu2+总浓度下降,故当pH变大时,CuCl产率变低;硝酸具有强氧化性,能与CuCl反应,不能用硝酸代替硫酸调节pH。 (4)实验通过滴定法测定CuCl的含量,实验平均消耗硫酸铈的体积为(24.05+23.95)/2=24.00 ml,所以消耗的硫酸铈为24×10-3 ml×0.10 mol·L-1=2.4×10-3 mol,根据题意的反应方程式CuCl+FeCl3===CuCl2+FeCl2、Fe2++Ce4+===Fe3++Ce3+, 得到CuCl ~ FeCl2 ~ Ce(SO4)2 1 1 n(CuCl) 2.4×10-3 mol n(CuCl)=2.4×10-3mol,样品中CuCl的纯度为×100%=95.5%。 (5)由CuCl水解再热分解可得到纳米Cu2O。第一步CuCl水解的离子方程式为:CuCl(s)+H2O(l) CuOH(s)+Cl-(aq)+H+(aq),第二步CuOH热分解得到Cu2O,则分解方程式为2CuOHCu2O+H2O,根据第一步水解反应的方程式得K=c(H+)·c(Cl-),将式子进行变形可得K= =。 答案:(1)Fe (2)2Cu2++2Cl-+SO2+2H2O===2CuCl↓+4H++SO42- (3)2 Cu2+水解程度增大,反应生成CuCl减少,产率减小 不能 硝酸会与产品CuCl发生反应 (4)95.5% (5)2CuOHCu2O+H2O Kw×Ksp(CuCl)/Ksp(CuOH) - 8 - - 8 -查看更多