- 2021-06-22 发布 |
- 37.5 KB |
- 38页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广西专用2020版高考化学二轮复习专题1第1讲化学常用计量课件
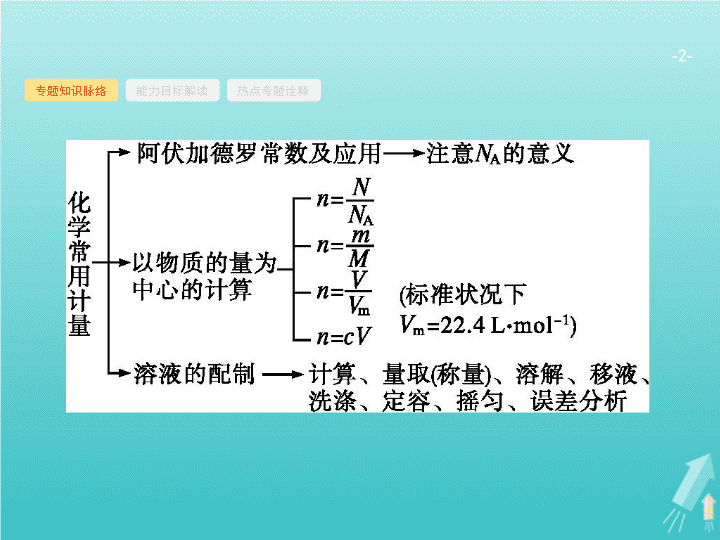
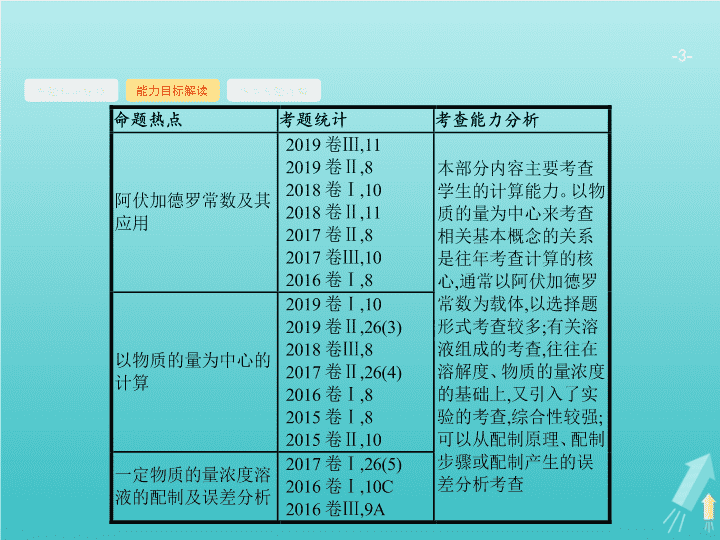
第 1 讲 化学常用计量 - 2 - 专题知识脉络 能力目标解读 热点考题诠释 - 3 - 专题知识脉络 能力目标解读 热点考题诠释 - 4 - 专题知识脉络 能力目标解读 热点考题诠释 1 .(2019 全国 Ⅱ ) 已知 N A 是阿伏加德罗常数的值 , 下列说法错误的是 ( ) A.3 g 3 He 含有的中子数为 N A B.1 L 0.1 mol·L -1 磷酸钠溶液含有 的 数目 为 0.1 N A C.1 mol K 2 Cr 2 O 7 被还原为 Cr 3+ 转移的电子数为 6 N A D.48 g 正丁烷和 10 g 异丁烷的混合物中共价键数目为 13 N A B 解题 要领 3 He 的相对原子质量是 3, 每个 3 He 原子含有 1 个中子 , 所以 3 g 3 He 含有的中子数为 N A ,A 项正确 ; 磷酸钠溶液中磷酸根离子发生水解 , 导致溶液中磷酸根离子数目减小 ,1 L 0.1 mol · L -1 磷酸钠溶液中的磷酸根离子数目小于 0.1 N A ,B 项错误 ;K 2 Cr 2 O 7 中 Cr 的价态为 +6 价 , 变为 +3 价 Cr 3+ , 降了 3 价 , 故 1 mol K 2 Cr 2 O 7 被还原为 Cr 3+ 转移的电子数为 6 N A ,C 项正确 ; 正丁烷和异丁烷互为同分异构体 ,1 个正丁烷分子和 1 个异丁烷分子中所含共价键数相同 , 即 1 个正丁烷分子和 1 个异丁烷分子中均含有 13 个共价键 ,58 g 正丁烷和异丁烷的混合物的总物质的量为 1 mol, 所以含有的共价键数为 13 N A ,D 项正确。 - 5 - 专题知识脉络 能力目标解读 热点考题诠释 2 .(2018 全国 Ⅰ ) N A 是阿伏加德罗常数的值。下列说法正确的是 ( ) A.16.25 g FeCl 3 水解形成的 Fe(OH) 3 胶体粒子数为 0.1 N A B.22.4 L( 标准状况 ) 氩气含有的质子数为 18 N A C.92.0 g 甘油 ( 丙三醇 ) 中含有羟基数为 1.0 N A D.1.0 mol CH 4 与 Cl 2 在光照下反应生成的 CH 3 Cl 分子数为 1.0 N A B 解题要领 FeCl 3 的摩尔质量为 162.5 g · mol -1 ,16.25 g FeCl 3 的物质的量为 0.1 mol,FeCl 3 的水解为可逆反应 , 且 Fe(OH) 3 胶粒是若干个 Fe(OH) 3 “ 分子 ” 的集合体 , 所以形成的 Fe(OH) 3 胶体粒子数远小于 0.1 N A ,A 项错误 ; 氩气为单原子分子 , 标准状况下 ,22.4 L 氩气含有 1 mol 氩原子 , 而 1 个氩原子中含有 18 个质子 ,B 项正确 ;92.0 g 甘油的物质的量为 1 mol, 而 1 个甘油分子中含有 3 个 —OH, 则 92.0 g 甘油中含有羟基数为 3.0 N A ,C 项错误 ; 甲烷与氯气反应时 , 会同时生成 CH 3 Cl 、 CH 2 Cl 2 、 CHCl 3 、 CCl 4 及 HCl, 所以 1 mol 甲烷反应生成的 CH 3 Cl 分子数一定小于 1.0 N A ,D 项错误。 - 6 - 专题知识脉络 能力目标解读 热点考题诠释 3 .(2017 全国 Ⅱ ) 阿伏加德罗常数的值为 N A 。下列说法正确的是 ( ) A.1 L 0.1 mol·L -1 NH 4 Cl 溶液中 , 的数量为 0.1 N A B.2.4 g Mg 与 H 2 SO 4 完全反应 , 转移的电子数为 0.1 N A C. 标准状况下 ,2.24 L N 2 和 O 2 的混合气体中分子数为 0.2 N A D.0.1 mol H 2 和 0.1 mol I 2 于密闭容器中充分反应后 , 其分子总数为 0.2 N A D 解题要领 A 项 , 由于 的 水解 , 故 1 L 0.1 mol · L -1 NH 4 Cl 溶液中的 数 小于 0.1 N A ,A 错误 ;B 项 ,2.4 g Mg 的物质的量是 0.1 mol, 反应中转移的电子数为 0.2 N A ,B 错误 ; 标准状况下 ,2.24 L 混合气体的物质的量是 0.1 mol, 分子数为 0.1 N A ,C 错误 ;H 2 +I 2 2HI 属于反应前后物质的量不变的反应 , 无论反应是否彻底 ,0.1 mol H 2 和 0.1 mol I 2 充分反应后的分子总数为 0.2 N A ,D 正确。 - 7 - 专题知识脉络 能力目标解读 热点考题诠释 4 .(2017 全国 Ⅲ ) N A 为阿伏加德罗常数的值。下列说法正确的是 ( ) A.0.1 mol 的 11 B 中 , 含有 0.6 N A 个中子 B.pH=1 的 H 3 PO 4 溶液中 , 含有 0.1 N A 个 H + C.2.24 L( 标准状况 ) 苯在 O 2 中完全燃烧 , 得到 0.6 N A 个 CO 2 分子 D. 密闭容器中 1 mol PCl 3 与 1 mol Cl 2 反应制备 PCl 5 (g), 增加 2 N A 个 P—Cl 键 A 解题要领 A 项 ,1 个 11 B 中含有 6 个中子 ,0.1 mol 11 B 含有 0.6 N A 个中子 , 正确 ;B 项 , 没有给出溶液的体积 , 不能计算 H + 数目 , 错误 ;C 项 , 标准状况下苯是液体 , 不能用气体摩尔体积计算其物质的量 , 错误 ;D 项 ,PCl 3 与 Cl 2 反应生成 PCl 5 的反应是可逆反应 , 所以 1 mol PCl 3 与 1 mol Cl 2 反应制备 PCl 5 , 增加的 P—Cl 键的数目小于 2 N A , 错误。 - 8 - 专题知识脉络 能力目标解读 热点考题诠释 5 .(2016 全国 Ⅰ ) 设 N A 为阿伏加德罗常数的值。下列有关叙述正确的是 ( ) A.14 g 乙烯和丙烯混合气体中的氢原子数为 2 N A B.1 mol N 2 与 4 mol H 2 反应生成的 NH 3 分子数为 2 N A C.1 mol Fe 溶于过量硝酸 , 电子转移数为 2 N A D. 标准状况下 ,2.24 L CCl 4 含有的共价键数为 0.4 N A A - 9 - 命题热点一 命题热点二 命题热点三 阿伏加德罗常数及其应用 有关阿伏加德罗常数解题的思维路径 - 10 - 命题热点一 命题热点二 命题热点三 问题探究 阿伏加德罗常数计算中常见的陷阱有哪些 ? - 11 - 命题热点一 命题热点二 命题热点三 - 12 - 命题热点一 命题热点二 命题热点三 例 1 (2019 河南普通高中检测 ) 用 N A 表示阿伏加德罗常数的值 , 下列说法正确的是 ( ) A.100 g 质量分数为 46% 的乙醇水溶液中含有的氢原子数为 6 N A B. 标准状况下 ,6 g 乙酸和丙醇的混合物中含有的分子数为 0.1 N A C. 标准状况下 , 铁丝在 22.4 L 氧气中燃烧时转移的电子数为 3 N A D. 将 10 mL 0.1 mol·L -1 FeCl 3 溶液滴入沸水中 , 得到 Fe(OH) 3 胶粒的个数为 0.001 N A - 13 - 命题热点一 命题热点二 命题热点三 分析推理 (1)100 g 质量分数为 46% 的乙醇水溶液中 , 除了乙醇中含有氢原子外 , 还有什么隐含物质中含有氢原子 ? 由于溶剂水分子中还有氢原子 , 故含有的氢原子数大于 6 N A 。 (2) 乙酸和丙醇的摩尔质量是多少 ? 乙酸和丙醇的摩尔质量都是 60 g · mol -1 。 (3) 铁丝在氧气中燃烧的产物是什么 ? 铁丝在氧气中燃烧的产物是 Fe 3 O 4 。 (4)FeCl 3 溶液滴入沸水中得到 Fe(OH) 3 胶粒的存在形式是什么 ? FeCl 3 溶液滴入沸水中得到 Fe(OH) 3 胶粒为 Fe(OH) 3 的聚集体。 - 14 - 命题热点一 命题热点二 命题热点三 综合以上分析 , 可知 :100 g 质量分数为 46% 的乙醇溶液中 , 乙醇的物质的量为 1 mol, 由于溶剂水分子中还含有氢原子 , 故含有的氢原子数大于 6 N A , 故 A 项错误 ; 乙酸的分子式为 C 2 H 4 O 2 , 相对分子质量为 60, 丙醇的分子式为 C 3 H 8 O, 相对分子质量为 60, 故 6 g 乙酸和丙醇混合物的物质的量为 0.1 mol, 含有的分子数为 0.1 N A , 故 B 项正确 ; 标准状况下 ,22.4 L 氧气物质的量为 1 mol, 根据电子守恒可知转移的电子数为 4 N A , 故 C 项错误 ; 由于 Fe(OH) 3 胶粒为 Fe(OH) 3 的聚集体 , 则制得的胶体中含有 Fe(OH) 3 胶粒的数目一定小于 0.001 N A , 故 D 项错误。 答案 B - 15 - 命题热点一 命题热点二 命题热点三 对点训练 1 (2018 全国 Ⅱ ) N A 代表阿伏加德罗常数的值。下列说法正确的是 ( ) A. 常温常压下 ,124 g P 4 中所含 P—P 键数目为 4 N A B.100 mL 1 mol·L -1 FeCl 3 溶液中所含 Fe 3+ 的数目为 0.1 N A C. 标准状况下 ,11.2 L 甲烷和乙烯混合物中含氢原子数目为 2 N A D. 密闭容器中 ,2 mol SO 2 与 1 mol O 2 催化反应后分子总数为 2 N A C 解析 124 g P 4 的物质的量为 1 mol, 根据 P 4 的结构可知 1 个 P 4 分子中含有 6 个 P—P 键 ,1 mol P 4 中含有 6 N A 个 P—P 键 ,A 项错误 ; 因为 Fe 3+ 会发生水解生成 Fe(OH) 3 ,100 mL 1 mol · L -1 FeCl 3 溶液中 N (Fe 3+ ) 小于 0.1 N A ,B 项错误 ; 根据化学式可知 ,1 mol CH 4 和 1 mol CH 2 =CH 2 中均含有 4 mol 氢原子 , 标准状况下 ,11.2 L 混合气体的物质的量为 0.5 mol, 所含 氢原子 的物质的量为 2 mol, 即所含氢原子数目为 2 N A ,C 项正确 ; SO 2 和 O 2 的反应为可逆反应 ,2 mol SO 2 和 1 mol O 2 不能全部转化成 2 mol SO 3 , 故分子总数大于 2 N A ,D 项错误。 - 16 - 命题热点一 命题热点二 命题热点三 以物质的量为中心的计算 以物质的量为中心的计算的解题思维路径 - 17 - 命题热点一 命题热点二 命题热点三 问题探究 1 . 以物质的量为中心的计算中有哪些常用的公式 ? - 18 - 命题热点一 命题热点二 命题热点三 2 . 已知某氯原子的质量是 a g, 用 N A 表示阿伏加德罗常数的值。则该氯原子的摩尔质量是多少 ? m g 该氯原子的物质的量为多少 ? 该氯原子的摩尔质量是 aN A g·mol -1 。 m g 该氯原子的物质的量为 - 19 - 命题热点一 命题热点二 命题热点三 3 . 化学计算中的常用方法有哪些 ? (1) 守恒法。 守恒法是中学化学计算中一种常用方法 , 守恒法中的三把 “ 金钥匙 ”—— 质量守恒、电荷守恒、得失电子守恒 , 都是抓住有关变化的始态和终态 , 淡化中间过程 , 利用某种不变量 ( ① 某原子、离子或原子团不变 , ② 溶液中阴阳离子所带电荷数相等 , ③ 氧化还原反应中得失电子数目相等 ) 建立关系式 , 从而达到简化过程、快速解题的目的。 (2) 极值法。 对混合体系或反应物可能发生几种反应生成多种产物的计算 , 我们可假设混合体系中全部是一种物质 , 或只发生一种反应 , 求出最大值、最小值 , 然后进行解答 , 此类题一般为选择题 。 - 20 - 命题热点一 命题热点二 命题热点三 (3) 设未知数法。 对混合体系的计算 , 我们一般设两个未知数 , 然后依据题意列两个方程 , 进行求解。 - 21 - 命题热点一 命题热点二 命题热点三 例 2 1.52 g 铜镁合金完全溶解于 50 mL 密度为 1.40 g·cm -3 、质量分数为 63% 的浓硝酸中 , 得到 NO 2 和 N 2 O 4 的混合气体 1 120 mL( 标准状况 ), 向反应后的溶液中加入 1.0 mol·L -1 NaOH 溶液 , 当金属离子全部沉淀时 , 得到 2.54 g 沉淀。下列说法不正确的是 ( ) A. 该合金中铜与镁的物质的量之比是 2 ∶ 1 B. 该浓硝酸中 HNO 3 的物质的量浓度是 14.0 mol·L -1 C.NO 2 和 N 2 O 4 的混合气体中 ,NO 2 的体积分数是 80% D. 得到 2.54 g 沉淀时 , 加入 NaOH 溶液的体积是 600 mL - 22 - 命题热点一 命题热点二 命题热点三 分析推理 (1) 本题中应如何求算铜和镁的物质的量 ? 对混合体系的计算 , 我们一般采用设未知数法 , 然后根据题意列方程 , 进行求解。对于本题 , 设铜的物质的量为 x , 镁的物质的量为 y , 有 - 23 - 命题热点一 命题热点二 命题热点三 (3) 如何求算 NO 2 和 N 2 O 4 各自的物质的量 ? 根据混合气体在标准状况下的体积 , n (NO 2 )+ n (N 2 O 4 )=0.05 mol, 根据得失电子守恒 , n (NO 2 )+2 n (N 2 O 4 )=2 n (Cu)+2 n (Mg)=0.06 mol, 得出 n (NO 2 )=0.04 mol, n (N 2 O 4 )=0.01 mol 。 (4) 至少需要氢氧化钠溶液的体积是多少 ? 浓硝酸中 HNO 3 总的物质的量为 14.0 mol · L -1 ×0.05 L=0.70 mol, 生成的混合气体中氮原子的物质的量 0.04 mol+0.01 mol×2=0.06 mol, 生成的 Cu(NO 3 ) 2 、 Mg(NO 3 ) 2 中氮原子的物质的量为 0.02 mol×2 + 0.01 mol×2=0.06 mol, 由氮原子守恒知合金与浓硝酸的反应中 HNO 3 有剩余 , 向反应后的溶液中加入 NaOH 溶液时 ,HNO 3 与 NaOH 反应生成 NaNO 3 和 H 2 O, 生成沉淀后的溶液中溶质为 NaNO 3 , 由 n (Na + )= n ( )= 0.70 mol-0.06 mol=0.64 mol, 所以得到 2.54 g 沉淀时加入 NaOH 溶液的体积应为 640 mL 。 答案 D - 24 - 命题热点一 命题热点二 命题热点三 题后反思 (1) 在有关 HNO 3 的计算题中 , 氮原子守恒法往往可以使解题更便捷。 (2) 在表达氮原子守恒的式子时 , 应注意 1 个 N 2 O 4 分子中有 2 个氮原子。 (3) 在计算 NaOH 溶液的体积时 , 除了根据铜和镁的物质的量来计算 , 还应考虑 HNO 3 可能有剩余。 - 25 - 命题热点一 命题热点二 命题热点三 对点训练 2 (2018 全国 Ⅲ ) 下列叙述正确的是 ( ) A.24 g 镁与 27 g 铝中 , 含有相同的质子数 B. 同等质量的氧气和臭氧中 , 电子数相同 C.1 mol 重水与 1 mol 水中 , 中子数比为 2 ∶ 1 D.1 mol 乙烷和 1 mol 乙烯中 , 化学键数相同 B 解析 24 g 镁和 27 g 铝的物质的量都是 1 mol, 所含质子数不同 ,A 项错误 ; 氧气和臭氧是同素异形体 , 两种分子均由氧原子构成 , 故同等质量氧气和臭氧所含原子数相同 , 则电子数也相同 ,B 项正确 ; 重水和水分子中的中子数分别是 10 、 8, 相同物质的量重水和水所含的中子数之比为 5 ∶ 4,C 项错误 ;1 个乙烷分子中有 7 个化学键 ,1 个乙烯分子中 有 6 个 化学键 ,D 项错误。 - 26 - 命题热点一 命题热点二 命题热点三 一定物质的量浓度溶液的配制及误差分析 有关一定物质的量浓度溶液的配制的解题思维路径 - 27 - 问题探究 1 . 一定物质的量浓度溶液的配制过程中需要哪些仪器 ? 使用的实验仪器 : 托盘天平、量筒、玻璃棒、容量瓶、胶头滴管、烧杯、药匙。 尤其注意容量瓶的使用 : ① 容量瓶使用的第一步操作是检查是否漏水 ( 简称 “ 查漏 ”); ② 要选择规格合适的容量瓶 ; ③ 不能用容量瓶直接溶解固体溶质或稀释浓溶液 , 不能用作反应容器或长期贮存溶液。 2 . 配制溶液的步骤如何 ? 操作步骤 : 计算 → 称量 ( 量取 )→ 溶解 ( 稀释 )→ 转移 → 定容 → 摇匀 → 倒出装瓶。 命题热点一 命题热点二 命题热点三 - 28 - 3 . 如何分析所配溶液的浓度误差 ? 进行误差分析的依据是 , 根据公式 , 分析各个量的变化 , 判断可能产生的误差。 命题热点一 命题热点二 命题热点三 - 29 - 命题热点一 命题热点二 命题热点三 - 30 - 例 3 下列说法中正确的是 ( ) A. 洗净的锥形瓶和容量瓶可以放进烘箱中烘干 B. 用容量瓶配制溶液时 , 若加水超过刻度线 , 立即用滴管吸出多余液体 C. 配制 350 mL 1.0 mol·L -1 NaCl 溶液可以选择一个 100 mL 的容量瓶和一个 250 mL 的容量瓶 D. 用容量瓶配制溶液 , 定容时俯视刻度线 , 所配溶液浓度偏大 命题热点一 命题热点二 命题热点三 - 31 - 分析推理 (1) 实验室中哪些仪器不能放进烘箱中烘干 ? 一些用于精确测量的仪器不能烘干 , 如容量瓶、量筒、滴定管等。下列仪器可以烘干 , 如烧杯、烧瓶、试管、漏斗、广口瓶、锥形瓶等。 (2) 加水超过容量瓶刻度线 , 如何处理 ? 重新配制。 (3) 容量瓶如何选择 ? 所配溶液的体积应等于所选容量瓶的容积 , 当没有与溶液体积匹配的容量瓶时 , 应选择大于并最接近于溶液体积的容量瓶。 答案 D 命题热点一 命题热点二 命题热点三 - 32 - 题后反思 (1) 通常都知道容量瓶中有少量水不会影响到所配溶液的浓度 , 但不知道容量瓶不能烘干。 (2) 加水超过容量瓶刻度线时 , 误以为可以吸出多余的液体而忽略了溶质的损失。 命题热点一 命题热点二 命题热点三 - 33 - 对点训练 3 某同学欲用 NaClO 固体配制 480 mL 含 NaClO 25%, 密度为 1.2 g·cm -3 的消毒液 , 下列说法正确的是 ( ) A. 需要称量 NaClO 固体的质量为 144.0 g B. 上图所示的仪器中 , 有四种是不需要的 , 另外还需一种玻璃仪器 C. 配制的溶液在空气中光照 , 久置后溶液中 NaClO 的物质的量浓度减小 D. 容量瓶用蒸馏水洗净后应烘干才能用于溶液配制 , 否则结果偏低 命题热点一 命题热点二 命题热点三 答案 解析 解析 关闭 应选取 500 mL 的容量瓶进行配制 , 所以需要 NaClO 的质量为 :500 mL×1.2 g · cm -3 ×25%=150.0 g,A 错。需用托盘天平称量 NaClO 固体 , 用烧杯来溶解 NaClO, 用玻璃棒进行搅拌和引流 , 用容量瓶和胶头滴管来定容 , 图示的 A 、 B 、 C 、 D 不需要 , 但还需玻璃棒和胶头滴管 ,B 错。由于 NaClO 易吸收空气中的 CO 2 而变质 , 所以久置后溶液中 NaClO 的浓度减小 ,C 项正确。配制过程中需加水 , 因此容量瓶不必烘干 ,D 错。 答案 解析 关闭 C - 34 - 1 . 用 N A 表示阿伏加德罗常数的值 , 下列说法正确的是 ( ) A.Fe 在少量 Cl 2 中燃烧生成 0.5 mol 产物 , 转移的电子数为 N A B.78 g Na 2 O 2 晶体中含有的阴离子数目为 2 N A C. 在标准状况下 ,2.8 g N 2 和 2.8 g CO 所含电子数均为 1.4 N A D.pH=13 的 NaOH 溶液中含有 OH - 的数目为 0.1 N A C 解析 铁与氯气反应生成 FeCl 3 , 故当有 0.5 mol 氯化铁生成时 , 即有 0.5 mol 铁参与反应 , 则转移 1.5 mol 电子 , 即 1.5 N A 个电子 ,A 项错误 ;Na 2 O 2 中的阴离子为 ,78 g Na 2 O 2 的物质的量为 1 mol, 则含有的阴离子数是 N A ,B 项错误 ;2.8 g N 2 和 2.8 g CO 物质的量均为 0.1 mol, 一个 N 2 分子含有电子数为 14, 一个 CO 分子含有电子数为 14, 所以 0.1 mol 的 N 2 或 CO, 含有电子数均 1.4 N A ,C 项正确 ;D 项 , 溶液体积未知 , 故溶液中 OH - 的个数无法计算 ,D 项错误。 - 35 - 2 .(2019 山东烟台高三一模 ) N A 代表阿伏加德罗常数的值 , 下列说法正确的是 ( ) A.46 g 乙醇中含有的共价键数目为 8 N A B.1 mol D 2 O 中含有的中子数为 8 N A C. 标准状况下 2.24 L Cl 2 溶于水转移的电子数为 0.2 N A D.0.1 L 1 mol·L -1 Na 2 S 溶液中 S 2- 与 HS - 的离子总数为 0.1 N A A - 36 - 3 . 现有 500 mL 某硫酸铁溶液 , 它的密度是 1.5 g·cm -3 , 其中铁元素的质量分数是 11.2%, 则下列有关该溶液的说法中不正确的是 ( ) A. 溶质的质量分数是 40% B. 溶液中溶质的物质的量浓度是 1.5 mol·L -1 C. 若取出 250 mL 该溶液稀释成 1 L, 则硫酸根离子的物质的量浓度变为 0.75 mol·L -1 D. 若加入 3 L 1.5 mol·L -1 NaOH 溶液恰好使铁离子完全沉淀 C - 37 - 4 . 实验室需要 480 mL 1 mol·L -1 NaOH 溶液 , 根据溶液配制情况回答下列问题 : (1) 实验中除了托盘天平 ( 带砝码 ) 、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有 、 。 (2) 下图是某同学在实验室配制该 NaOH 溶液的过程示意图 , 其中有错误的是 ( 填操作序号 ) 。 - 38 - (3) 称取 NaOH 固体时 , 所需砝码的质量为 ( 填写字母 ) 。 A.19.2 g B.20 g C.19.2~20 g D. 大于 20 g (4) 在溶液的配制过程中 , 有以下基本实验步骤 , 其中只需进行一次的操作步骤是 ( 填写操作步骤的代号 ) 。 ① 称量 ② 溶解 ③ 转移 ④ 洗涤 ⑤ 定容 (5) 下列操作一定会导致所配溶液的物质的量浓度偏高的是 。 A.NaOH 固体长期曝露在空气中 B. 用水溶解 NaOH 固体后 , 立即转入容量瓶中定容 C. 称量固体时 , 将物质和砝码放反 D. 定容后发现液面高于刻度线 , 可用胶头滴管将多余的水吸出 E. 定容时俯视刻度线 答案 (1) 胶头滴管 500 mL 容量瓶 (2) ①⑤ (3)D (4) ②⑤ (5)BE查看更多