- 2021-05-25 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学二轮复习攻略专题2化学常用计量测试题
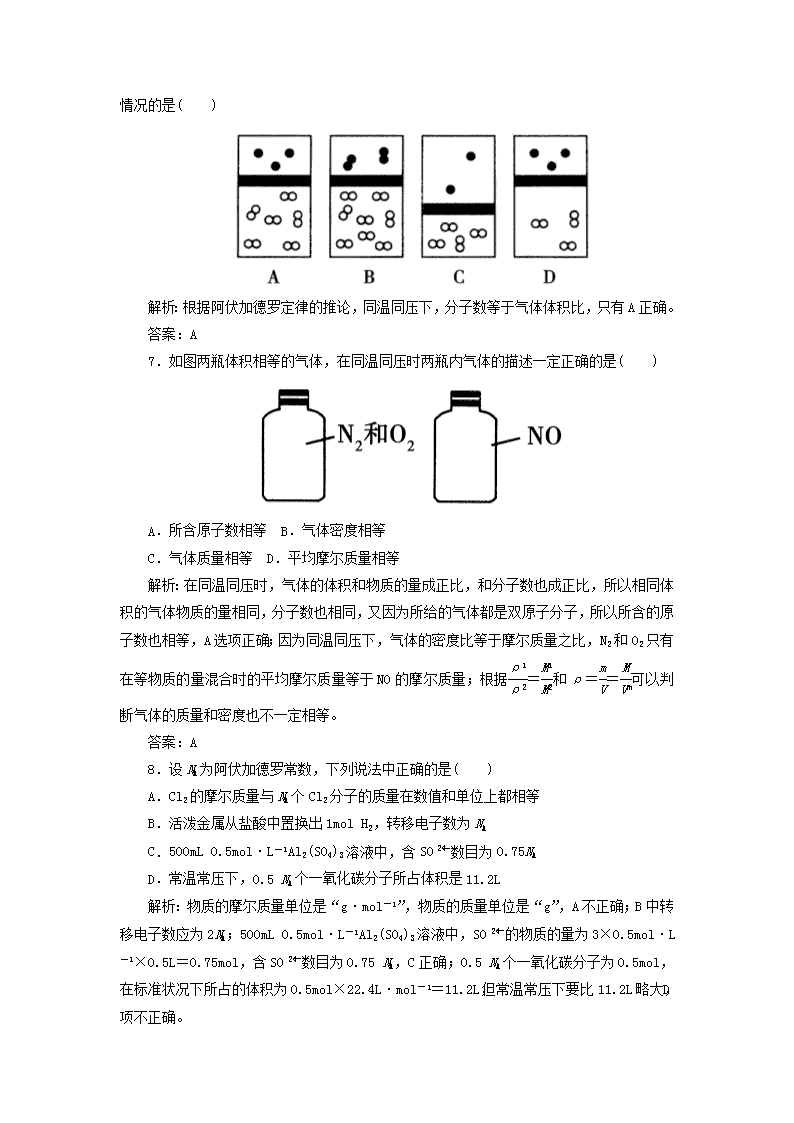
专题2 化学常用计量 一、选择题(每小题5分,共50分) 1.(双选)NA表示阿伏加德罗常数,下列判断正确的是( ) A.在18g18O2中含有NA个氧原子 B.1mol Cl2参加反应转移电子数一定为2NA C.1mol H2与1mol Cl2反应生成NA个HCl分子 D.1mol Ca变成Ca2+时失去的电子数为2NA E.1mol羟基中电子数为10NA F.在反应KIO3+6HI===KI+3I2+3H2O中,每生成3mol I2转移的电子数为6 NA 解析:18g18O2正好是0.5mol,1mol 18O2含有2mol氧原子,所以18g18O2中氧原子的物质的量为1mol 即为1NA,A项正确;1mol Cl2与金属、与氢气反应时,转移电子是2mol,与水、与碱反应时转移电子是1mol ,B项错;1mol H2与1mol Cl2反应生成2mol HCl,故C项错;1mol Ca生成Ca2+时失去2mol电子,即2NA,D项正确;E项,1mol羟基中有9NA个电子;F项,在该反应中,每生成3mol I2,转移5NA个电子;本题选A、D。 答案:AD 2.(2010·上海,7)NA表示阿伏加德罗常数,下列叙述正确的是( ) A.等物质的量的N2和CO所含分子数均为NA B.1.7gH2O2中含有的电子数为0.9NA C.1mol Na2O2固体中含离子总数为4NA D.标准状况下,2.24L戊烷所含分子数为0.1NA 解析:“等物质的量”并不一定是1mol,故A错误;B中所含电子数为×18=0.9mol,故B正确;1mol Na2O2中所含的离子总数为3NA,其中包括2mol Na+和1mol O,故C错误;标准状况下,戊烷是液体,故D错误。 答案:B 3.(2011·泉州模拟)下列叙述中正确的是( ) ①在标准状况下,0.2mol任何物质的体积均为4.48L ②当1mol气体的体积为22.4L时,它一定处于标准状况下 ③标准状况下,1L HCl和1L H2O的物质的量相同 ④标准状况下,1g H2和14g N2的体积相同 ⑤28g CO的体积为22.4L ⑥同温同压下,气体的密度与气体的相对分子质量成正比 A.①②③④ B.②③⑥ C.⑤⑥ D.④⑥ 解析:①错在不是任何物质,只能是气体。②结论太片面,1mol气体在温度和压强符合一定关系时,也能使体积占有22.4L。③错在标准状况下水不是气体。⑤错在没有标明标准状况。 答案:D 4.下列有关实验操作的叙述正确的是( ) A.用量筒取5.00mL 1.00mol/L盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100mol/L盐酸 B.将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 C.用10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% D.质量分数为10%的氨水与质量分数为20%的氨水等体积混合,所得氨水的质量分数小于15% 解析:A项,有两点错误之处,第一步量筒只能精确到小数点后一位,第二点在配制一定物质的量浓度的溶液时,溶解操作应在烧杯内进行,不允许在容量瓶内溶解;B项,容量瓶不能用来直接盛装固体配制溶液,要将固体先在烧杯中溶解,冷却至室温转移到容量瓶中,B项错误;C项,由于硫酸的密度随着浓度的减小而减小,当加水稀释体积变为原来的10倍时,设浓、稀溶液的密度分别为ρ1、ρ2,由浓、稀溶液中溶质守恒得: ×10mL=×100mL 整理得:w%=×9.8%,因ρ1>ρ2,故w%>9.8%,C项错误;D项,由于氨水的密度随着浓度的减小而增大,分析类似C项,故不同浓度的氨水等体积混合时,混合液的质量分数小于15%。 答案:D 5.(2010·江苏卷,5)设NA为阿伏加德罗常数的值,下列叙述正确的是( ) A.常温下,1L 0.1mol·L-1的NH4NO3溶液中氮原子数为0.2 NA B.1mol羟基中电子数为10 NA C.在反应KIO3+6HI===KI+3I2+3H2O中,每生成3mol I2转移的电子数为6 NA D.常温常压下,22.4L乙烯中C—H键数为4 NA 解析:羟基(—OH)为9电子微粒,B错;I2既是氧化产物又是还原产物,每生成3mol I2转移的电子数为5NA,C错;常温常压下,22.4L乙烯不是1mol,C—H键数不是4NA,D错。 答案:A 6.下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。将等质量的氢气与氦气同时充入容器,符合实际情况的是( ) 解析:根据阿伏加德罗定律的推论,同温同压下,分子数等于气体体积比,只有A正确。 答案:A 7.如图两瓶体积相等的气体,在同温同压时两瓶内气体的描述一定正确的是( ) A.所含原子数相等 B.气体密度相等 C.气体质量相等 D.平均摩尔质量相等 解析:在同温同压时,气体的体积和物质的量成正比,和分子数也成正比,所以相同体积的气体物质的量相同,分子数也相同,又因为所给的气体都是双原子分子,所以所含的原子数也相等,A选项正确;因为同温同压下,气体的密度比等于摩尔质量之比,N2和O2只有在等物质的量混合时的平均摩尔质量等于NO的摩尔质量;根据=和ρ==可以判断气体的质量和密度也不一定相等。 答案:A 8.设NA为阿伏加德罗常数,下列说法中正确的是( ) A.Cl2的摩尔质量与NA个Cl2分子的质量在数值和单位上都相等 B.活泼金属从盐酸中置换出1mol H2,转移电子数为NA C.500mL 0.5mol·L-1Al2(SO4)3溶液中,含SO数目为0.75NA D.常温常压下,0.5 NA个一氧化碳分子所占体积是11.2L 解析:物质的摩尔质量单位是“g·mol-1”,物质的质量单位是“g”,A不正确;B中转移电子数应为2NA;500mL 0.5mol·L-1Al2(SO4)3溶液中,SO的物质的量为3×0.5mol·L-1×0.5L=0.75mol,含SO数目为0.75 NA,C正确;0.5 NA个一氧化碳分子为0.5mol,在标准状况下所占的体积为0.5mol×22.4L·mol-1=11.2L,但常温常压下要比11.2L略大,D项不正确。 答案:C 9.下列说法正确的是( ) A.把100mL 3mol·L-1的H2SO4跟100mLH2O混合,硫酸的物质的量浓度变为1.5mol·L-1 B.把100g 20%的NaCl溶液跟100g H2O混合后,NaCl溶液的质量分数是10% C.把200mL 3mol·L-1的BaCl2溶液跟100mL 3mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3mol·L-1 D.把100mL 20%的NaOH溶液跟100mL H2O混合后,NaOH溶液的质量分数是10% 解析:A错,因为100mL 3mol·L-1的H2SO4跟100mL H2O混合后的体积小于200mL;B正确,w=100g×20%/(100g+100g)=10%;C错,因为3mol·L-1的BaCl2溶液中的氯离子浓度为6mol·L-1,混合后溶液中氯离子浓度大于3mol·L-1;D错,因为NaOH溶液的密度大于1g·mL-1,加入水的质量等于100g,所以混合后溶液中溶质的质量分数大于10%。 答案:B 10.有3份等质量的小苏打,第1份直接与过量盐酸反应;第2份先加热,使其部分分解后,再与过量盐酸反应;第3份先加热,使其完全分解后,再与过量盐酸反应。假若盐酸的物质的量浓度相同,实际消耗盐酸的体积分别为V1、V2和V3,则V1、V2和V3的大小关系正确的是( ) A.V1>V2>V3B.V1>V3>V2 C.V2>V3>V1D.V1=V2=V3 解析:3份小苏打质量相等,无论是直接与盐酸反应,还是部分分解或完全分解后与盐酸反应,最终得到的是NaCl溶液,其中Cl-来自于盐酸,Na+来自于NaHCO3,3份小苏打消耗盐酸的体积相同。 答案:D 二、非选择题(共50分) 11.(12分)(2011·龙岩模拟)一定质量的液态化合物XY2,在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为:XY2(l)+3O2(g)===XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g/L,则: (1)反应前O2的体积是________________________________________________________________________。 (2)化合物XY2的摩尔质量是________________________________________________________________________。 (3)若XY2分子中X、Y两元素的质量比是3:16,则X、Y两元素分别为________和________(写元素符号)。 解析:(1)由反应XY2(l)+3O2===XO2(g)+2YO2(g)可知,反应前后气体的体积变化为0,故V(O2)=672mL。 (2)由m=ρV,生成物的质量m=0.672L×2.56g/L=1.72g, XY2 + 3O2===XO2+2YO2, 0.01mol 0.03mol 所以M(XY2)= =76g/mol; (3)由=,Ar(X)+2Ar(Y)=76,得Ar(X)=12,Ar(Y)=32,则X为C,Y为S。 答案:(1)672mL (2)76g/mol (3)C S 12.(12分)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验可将氧气通过高压放电管来制取臭氧: 3O22O3 (1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为________g/mol(保留一位小数)。 (2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为________L。 (3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为________。 解析:(1)设原有氧气的物质的量为xmol,已知有30%的氧气转化为臭氧,由反应3O22O3知,发生反应的O2的物质的量为0.3 xmol,生成O3的物质的量为0.2 xmol,故反应后气体的总物质的量为0.9xmol,则得到混合气体的平均摩尔质量为M===35.6g/mol (2)设反应的O2的体积为aL,则生成O3的体积为aL,由差量法得 3O22O3 ΔV 321 aa1.5L a-a=8L-6.5L a=4.5L,臭氧体积为3L。 (3)本题应分情况讨论: ①假设O2和O3完全反应,则O2和O3的质量即为铜粉增加的质量,m总=1.6g,n总===0.04mol,则混合气体的平均相对分子质量为===40g/mol,=知 40g/mol= 求得= 故臭氧体积分数为50%或0.5; ②假设铜完全反应,O2或O3剩余,设生成CuO bg Cu→CuO 63.5 79.5 20gbg =求得b=25>21.6 故假设错误。 答案:(1)35.6 (2)3 (3)0.5或50% 13.(13分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验按以下步骤进行: ①称取ag样品,置于烧杯中; ②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液; ③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全; ④加入过量氨水,充分搅拌,使沉淀完全; ⑤过滤,洗涤沉淀; ⑥将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,,在干燥器中冷却至室温后,称量; ⑦…… 请根据上面的叙述,回答: (1)如图所示仪器中,本实验步骤①②③中必须用到的仪器是E和________(填字母)。 (2)写出步骤③中发生反应的离子方程式:_______________________________________________________________________________________________________________________________________。 (3)洗涤沉淀的操作是________________________________________________________________________________________________________________________________________________。 (4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应是___________________________________________________________________________________________________________________________________________________________________________________________________________________。 (5)若坩埚质量是W1g,最终坩埚和固体的总质量是W2g,则样品中铁元素的质量分数为________________________________________________________________________。 (列出算式,不需化简) 解析:(1)根据实验步骤可知,需要溶液配制、量取等步骤,所以需要的仪器有滴定管、托盘天平、容量瓶等;(2)此步骤是氯气氧化样品中的Fe2+,反应为2Fe2++Cl2===2Fe3++2Cl-;(3)向普通漏斗里注入蒸馏水,使水面没过滤渣,等水自然流完后,重复操作2~3次;(4)相差较大,说明没有分解完全,需要继续加热;(5)质量差是Fe2O3的质量,则25mL溶液中铁元素的质量是×2×56g/mol,所以样品中铁元素的质量是:×2×56g/mol×, 铁元素的质量分数为×100%。 答案:(1)CFG (2)2Fe2++Cl2===2Fe3++2Cl- (3)向普通漏斗里注入蒸馏水,使水面没过滤渣,等水自然流完后,重复操作2~3次 (4)继续加热,放置干燥器中冷却,称量,至最后两次称得的质量差不超过0.1g (或恒重)为止 (5)×100% 14.(13分)(创新探究)奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是:食品与硫酸和催化剂一同加热,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再用硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。操作步骤: ①样品处理:准确称取一定量的固体样品奶粉,移入干燥的烧杯中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。 ②NH3的蒸馏和吸收:把制得的溶液(取一定量),通过定氮装置,经过一系列的反应,使氨变成硫酸铵,再经过碱化蒸馏后,氨即成为游离态,游离氨经硼酸吸收。 ③氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再折算为粗蛋白质含量。 试回答下列问题: (1)在样品的处理过程中使用到了容量瓶,怎样检查容量瓶是否漏水? _____________________________________________________________________________________________________________________________________________________________________________ (2)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大( ) A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯 B.定容时,俯视刻度线 C.定容时,仰视刻度线 D.移液时,有少量液体溅出 (3)若称取样品的质量为1.5g ,共配制100mL的溶液,取其中的20mL,经过一系列处理后,使N转变为硼酸铵然后用0.1mol/L盐酸滴定,其用去盐酸的体积为23.0mL,则该样品中N的含量为________。 (已知:滴定过程中涉及到的反应方程式:(NH4)2B4O7+2HCl+5H2O===2NH4Cl+4H3BO3) (4)一些不法奶农利用“凯氏定氮法”只检测氮元素的含量而得出蛋白质的含量这个检测法的缺点,以便牛奶检测时蛋白质的含量达标,而往牛奶中添加三聚氰胺(C3N6H6)。则三聚氰胺中氮的含量为________。 解析:(1)容量瓶的检漏方法是:往容量瓶中注入一定量的水,塞紧瓶塞,倒转过来,观察是否漏水,然后再正放,旋转瓶塞180°,再倒转过来,观察是否漏水,若都不漏水,则说明该容量瓶不漏水。 (2)由c=n/V判断:A、D选项中使n偏小,浓度偏小;B选项中俯视刻度线,使V 偏小,浓度偏大;C选项中仰视刻度线,使V偏大,浓度偏小。 (3)n(N)=5 n(HCl)=0.011 5mol,该样品中N的含量 w==10.73%。 (4)三聚氰胺中N的含量:w=×100%=66.7%。 答案:(1)往容量瓶中注入一定量的水,塞紧瓶塞,倒转过来,观察是否漏水,然后再正放,旋转瓶塞180°,再倒转过来,观察是否漏水,若都不漏水,则说明该容量瓶不漏水 (2)B (3)10.73% (4)66.7%查看更多