山东省潍坊市2020-2021学年高二上学期期中考试化学试卷 Word版含解析
- 1 -
高二化学
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Si 28 Cl
35.5
一、选择题:每小题只有一个选项符合题目要求。
1. 工业上制备金属钾的反应为 KCl+Na NaCl+K,该反应为吸热反应,反应温度通常为
850℃。相关数据如下表所示,下列说法错误的是( )
物质 熔点/℃ 沸点/℃
Na 97.8 883
K 63.7 774
NaCl 801.0 1413
KCl 770 1500
A. Na 比 K 活泼 B. 该反应的△H>0
C. 该反应的△S>0 D. 该条件下△H-T△S<0
【答案】A
【解析】
【详解】A.金属性 K>Na,故 K 比 Na 活泼,A 错误;
B.该反应为吸热反应,因此,该反应的△H>0,B 正确;
C.反应温度为 850℃时,根据表格数据,Na、NaCl、KCl 均为液态,而 K 为气态,随着反应
的进行,气体增多,熵增大,因此该反应的△S>0,C 正确;
D.该反应在高温下可以自发进行,因此△H-T△S<0,D 正确;
答案选 A。
2. 下列现象不能用化学平衡原理解释的是( )
A. 打开冰镇啤酒并倒入杯中,杯中立即泛起大量泡沫
B. 在实验室制备氯气时,用饱和食盐水净化氯气
C. 已知 2HI(g) H2(g)+I2(g),为更准确测定 HI 的相对分子质量,选择高压条件下测定
D. 实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出
- 2 -
【答案】C
【解析】
【详解】A.因溶液中存在着二氧化碳的溶解平衡,开启啤酒瓶并倒入杯中后,压强减小,二
氧化碳逸出,能用平衡原理解释,A 不符合题意;
B.氯气溶于水生成 HCl 和 HClO,存在平衡 Cl2+H2O H++Cl-+HClO,饱和的食盐水含
有大量的氯离子,可以使氯气的溶解平衡逆向进行,可减少对氯气的溶解,能用平衡原理解
释,B 不符合题意;
C.反应 2HI(g) H2(g)+I2(g)前后气体分子数不发生改变,压强不影响平衡移动,不能用平
衡原理解释,C 符合题意;
D.实验室制取乙酸乙酯时,发生反应
CH3CH2OH+CH3COOH 2 4浓H SO
Δ CH3COOCH2CH3+H2O,将乙酸乙酯不断蒸出,促进反
应正向进行,可以用平衡原理解释,D 不符合题意;
答案选 C。
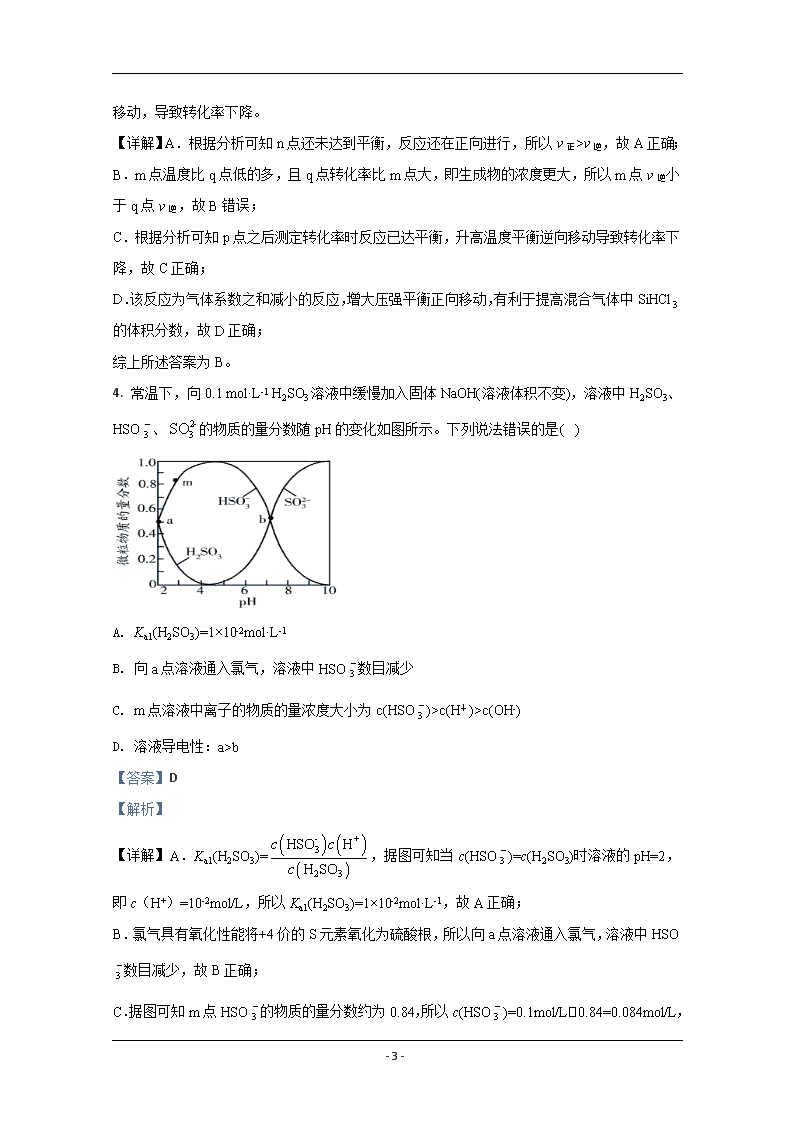
3. SiCl4 是一种重要的化工原料,SiCl4 氢化为 SiHCl3 的反应方程式为:3SiCl4(g)+2H2(g)+
Si(s) 4SiHCl3(g),其转化率随温度变化如图所示。下列说法错误的是( )
A. B. n 点 v 正>v 逆
C. m 点 v 逆大于 q 点 v 逆 D. p 点后,转化率下降可能是平衡左移
E. 加压有利于提高混合气体中 SiHCl3 的体积分数
【答案】B
【解析】
【分析】
随温度升高 SiCl4 的转化率先增大后减小,说明在 o 点之前测定转化率时反应还未达到平衡,
- 3 -
升高温度反应速率加快,测定的转化率增大,在 p 点之后反应达到平衡,升高温度平衡逆向
移动,导致转化率下降。
【详解】A.根据分析可知 n 点还未达到平衡,反应还在正向进行,所以 v 正>v 逆,故 A 正确;
B.m 点温度比 q 点低的多,且 q 点转化率比 m 点大,即生成物的浓度更大,所以 m 点 v 逆小
于 q 点 v 逆,故 B 错误;
C.根据分析可知 p 点之后测定转化率时反应已达平衡,升高温度平衡逆向移动导致转化率下
降,故 C 正确;
D.该反应为气体系数之和减小的反应,增大压强平衡正向移动,有利于提高混合气体中 SiHCl3
的体积分数,故 D 正确;
综上所述答案为 B。
4. 常温下,向 0.1 mol·L-1 H2SO3 溶液中缓慢加入固体 NaOH(溶液体积不变),溶液中 H2SO3、
HSO 3
、 2-
3SO 的物质的量分数随 pH 的变化如图所示。下列说法错误的是( )
A. Ka1(H2SO3)=1×10-2mol·L-1
B. 向 a 点溶液通入氯气,溶液中 HSO 3
数目减少
C. m 点溶液中离子的物质的量浓度大小为 c(HSO 3
)>c(H+)>c(OH-)
D. 溶液导电性:a>b
【答案】D
【解析】
【详解】A.Ka1(H2SO3)=
- +
3
2 3
HSO H
H SO
c c
c
,据图可知当 c(HSO 3
)=c(H2SO3)时溶液的 pH=2,
即 c(H+)=10-2mol/L,所以 Ka1(H2SO3)=1×10-2mol·L-1,故 A 正确;
B.氯气具有氧化性能将+4 价的 S 元素氧化为硫酸根,所以向 a 点溶液通入氯气,溶液中 HSO 3
数目减少,故 B 正确;
- 4 -
C.据图可知 m 点 HSO 3
的物质的量分数约为 0.84,所以 c(HSO 3
)=0.1mol/L 0.84=0.084mol/L,
pH 约为 3,显酸性 c(H+)=10-3mol/L,所以溶液中离子的物质的量浓度大小为 c(HSO 3
)>c(H
+)>c(OH-),故 C 正确;
D.a 点溶液的溶质主要为 H2SO3,而 b 点溶液中的溶质为 NaHSO3 和 Na2SO3,溶液体积不变,
溶液中的离子浓度变大,导电能力变强,故 D 错误;
综上所述答案为 D。
5. 溶液的酸碱性可用酸度(AG)表示,
+
-
(H )AG=lg (OH )
c
c
,常温下,向 0.1 mol·L-1 的 NaClO 溶液
中加入适量水,溶液酸度随加入水的体积变化如图所示。下列说法正确的是( )
A. 测量该溶液 pH 的方法:蘸取待测液滴在 pH 试纸上,与标准比色卡对比
B. m 点,由水产生的 c(H+)=1×10-10 mol·L-1
C. 加入一定量盐酸,AG 有可能大于零
D. 加水过程中,c(OH-)>c(H+)+c(HClO)
【答案】C
【解析】
【详解】A.次氯酸根具有强氧化性,会把 pH 试纸漂白,不能用 pH 试纸测其 pH 值,故 A
错误;
B.m 点 lg
+
-
H
OH
c
c
=-6,常温下 Kw= c(OH-)·c(H+)=1×10-14 ,联立可得 c(OH-)=1×10-4 mol·L-1,
溶液中氢氧根全部由水电离,且水电离出的氢离子浓度和氢氧根相等,所以由水产生的 c(H
+)=1×10-4 mol·L-1,故 B 错误;
C.AG= lg
+
-
H
OH
c
c
>0 时即 c(H+)> c(OH-),溶液显酸性,加入一定量的盐酸可以使溶液显酸
性,故 C 正确;
D.加水过程中,溶液中存在质子守恒 c(OH-)=c(H+)+c(HClO),故 D 错误;
- 5 -
综上所述答案为 C。
6. FeCl3 溶于盐酸中存在下列平衡:Fe3+(aq)+4Cl-(aq) FeCl -
4 (aq)(黄色)。已知平衡时,物质
的量浓度[FeCl -
4 ]与温度 T 的关系如图所示。则下列说法正确的是( )
A. 该反应为吸热反应
B. A 点与 B 点相比,B 点[FeCl -
4 ]浓度更高一些
C. 反应处于 D 点时,有 v 正
v 逆,故 C 错误;
D.C 点溶液中有较多的 FeCl3,加热促进铁离子的水解和 HCl 的挥发,所以蒸干后得到氢氧
化铁,灼烧后得到三氧化二铁,故 D 正确;
综上所述答案为 D。
7. 下列说法错误的是( )
A. 水的离子积常数 KW 不仅适用于纯水,也适用于稀的酸、碱、盐溶液
B. 强酸与强碱形成的盐,其水溶液不一定呈中性
C. 电离常数大的酸溶液中 c(H+)一定比电离常数小的酸溶液中的 c(H+)大
D. 多元弱酸的各级电离常数逐级减小
【答案】C
【解析】
【详解】A.水的离子积常数 KW 不仅适用于纯水,也适用于稀的酸、碱、盐溶液,故 A 正确;
- 6 -
B.强酸与强碱形成的盐,其水溶液不一定呈中性,如等物质的量的氢氧化钠和硫酸反应,生
成硫酸氢钠,溶液显酸性,故 B 正确;
C.酸的浓度没确定,所以电离常数大的酸溶液中 c(H+)与电离常数小的酸溶液中的 c(H+)无法
比较,故 C 错误;
D.多元弱酸是分步电离的,且电离程度依次减小,电离常数逐级减小,故 D 正确;
故答案:C。
8. 一定温度下,反应 I2(g)+H2(g) 2HI(g)在密闭容器中达到平衡时,测得 c(I2)=0.11
mmol·L-1,c(HI)=0.78 mmol·L-1.相同温度下,按下列 4 组初始浓度进行实验,最有可能使反应
逆向进行的是( )
A B C D
c(I2)/mmol/L 0.44 022 2.00 0.11
c(H2)/mmol/L 0.44 0.22 2.00 0.44
c(HI)/mmol/L 4.00 1.56 2.00 1.56
(注:1 mmol·L-1=10-3 mol·L-1)
A. A B. B C. C D. D
【答案】A
【解析】
【分析】
判断反应进行的方向,可以通过比较 Qc 和 K 的相对大小,但本题没有平衡时 c(H2),所以无法
计算出 K,则不能通过 Qc 与 K 的关系判断反应进行的方向,但可以通过比较四个选项中 Qc 的
大小关系, Qc 越大,则向逆向移动的可能性越大。
【详解】A.Qc= 4.00 4.00
0.44 0.44
=82.64;
B.Qc= 1.56 1.56
0.22 0.22
=50.28;
C.Qc= 2.00 2.00
2.00 2.00
=1;
D.Qc= 1.56 1.56
0.44 0.11
=50.28;
综上所述 Qc 最大的是 A,其逆向进行的可能性最大,故选 A。
9. (CH3NH3)(PbI3)是钙钛矿太阳能电池的重要吸光材料,其降解原理如图所示。下列说法错误
- 7 -
的是( )
A. H2O 不是催化剂
B. H2O 与 CH3NH +
3 发生作用,生成 H3O+和 CH3NH2
C. 该反应的化学方程式为(CH3NH3)(PbI3)
催化剂 HI+CH3NH2+PbI2
D. 及时分离出 HI 有利于提高产率
【答案】A
【解析】
【详解】A.据图可知 H2O 虽然参与了降解过程,但整个过程前后 H2O 的质量并没有发生变
化,所以 H2O 为催化剂,故 A 错误;
B.据图可知该降解过程的第一步为
n[(CH3NH3)(PbI3)]+H2O=[(CH3NH3)n-1][( CH3NH2)(PbI3)n][H3O],对比各物质的前后变化可知
H2O 与 CH3NH +
3 发生作用,生成 H3O+和 CH3NH2,故 B 正确;
C.观察整个过程可知 n 个(CH3NH3)(PbI3)在水催化作用下,其中一分子(CH3NH3)(PbI3)分解生
成 HI、CH3NH2 和 PbI2,所以化学方程式为(CH3NH3)(PbI3)
催化剂 HI+CH3NH2+PbI2,
故 C 正确;
D.及时分离出生成物,可使平衡正向移动,提高产率,故 D 正确;
综上所述答案为 A。
10. 合成氨的反应历程有多种,有一种反应历程如图所示,吸附在催化剂表面的物质用*表示。
下列说法错误的是( )
- 8 -
A. 适当提高 N2 分压,可以加快 N2(g)→*N2 反应速率
B. N2 生成 NH3 是通过多步氧化反应生成的
C. 两个氮原子上的加氢过程分步进行
D. 大量氨分子吸附在催化剂表面,将减缓反应速率
【答案】B
【解析】
【详解】A.适当提高 N2 分压,可以加快 N2(g)→*N2 反应速率,进而加快了化学反应速率,
故 A 正确;
B. 由题图可知,N2 反应生成 NH3 的过程为
N2→N=N-H→H-N=N-H→H-N-NH2→H2N-NH2-→NH3,氮元素的化合价逐渐降低,即发生多
步还原反应生成 NH3,故 B 错误;
C. 由题图分析可知,两个氮原子上的加氢过程是分步进行的,故 C 正确;
D. NH3 的及时脱附可留下继续反应的空间而增加催化剂的活性位,如果大量氨分子吸附在
催化剂表面,就会将减缓反应速率,故 D 正确;
故答案:B。
二、选择题:每小题有一个或两个选项符合题目要求.
11. 常温下,浓度均为 0.10 mol·L-1、体积均为 V0 的 HA 和 HB 溶液,分别加水稀释至体积 V,
pH 随
0
Vlg V
的变化如图所示。下列叙述错误的是( )
- 9 -
A. HA 的酸性强于 HB 的酸性 B. HB 溶液中
-c(B )
c(HB)
的值:b 点大于 a
点
C. 此温度下,Ka(HB)=1×10-5 mol·L-1 D. HA 的电离程度:d 点大于 c 点
【答案】D
【解析】
【详解】A.0.1mol/L 的 HA 溶液 pH=1,所以 HA 为一元强酸,0.1mol/L 的 HB 溶液 pH>2,
所以为一元弱酸,故 A 正确;
B.
-
a
+
(HB)(B ) =(HB) (H )
Kc
c c
,温度不变 Ka(HB)不变,b 点 pH 大于 a 点,所以 b 点氢离子浓度更小,
则
-c(B )
c(HB)
的值:b 点大于 a 点,故 B 正确;
C.据图可知稀释 100 倍后 HB 的 pH=4,0.001mol/L 的 HB 溶液 pH=4,即溶液中 c(H+)=10-4mol/L,
所以 Ka(HB)=
-4 -4
-3 -4
10 10
10 -10
10-5 mol·L-1,故 C 正确;
D.HA 为强电解质,不存在电离平衡,所以各浓度的 HA 溶液中其电离程度相等,故 D 错误;
综上所述答案为 D。
12. 某反应加入催化剂后,反应历程变成两个基元反应,相关能量变化如图所示(E 为正值,单
位:kJ·mol-1)。下列有关说法正确的是( )
- 10 -
A.
B. 该总反应的活化能 Ea=E1+E3
C. 该总反应的焓变△H=-(E4+E2-E1-E3)
D. 此条件下,第一个基元反应的反应速率大于第二个
E. 对于 Ea>0 的反应,必须加热才能进行
【答案】BC
【解析】
【详解】A.该反应的活化能应为反应物的能量和过渡态 II 的能量之差,即 Ea=E3-(E2-E1)= E1
+E3- E2,故 A 错误;
B.焓变=反应物键能之和-生成物键能之和,所以△H= E1+E3-(E4+E2)= -(E4+E2-E1-E3),故 B
正确;
C.据图可知第一个基元反应的活化能 E1 小于第二个基元反应的活化能 E3,活化能越小反应
速率越快,所以此条件下,第一个基元反应的反应速率大于第二个,故 C 正确;
D.活化能是指分子从常态转变为容易发生化学反应的活跃状态所需要的能量,根据活化能并
不能判断反应发生的条件,故 D 错误;
综上所述答案为 BC。
13. 已知某温度下 CH3COOH 和 NH3·H2O 的电离常数相等,现向 10 mL 浓度为 0.1 mol·L-1
的 CH3COOH 溶液中滴加相同浓度的氨水,在滴加过程中溶液中 pOH[pOH=-lgc 平衡(OH-)]与 pH
的变化关系如图所示。下列说法正确的是( )
- 11 -
A. Q 点对应 a 值等于 7
B. M 点所示溶液中 c(CH3COO-)>c( +
4NH )
C. 在滴加过程中,水的电离程度始终增大
D. c(CH3COOH)与 c(CH3COO-)之和始终保持不变
【答案】B
【解析】
【详解】A.据图可知 Q 点 pH=pOH=a,说明 c(H+)=c(OH-),溶液呈中性,但温度未知中性溶
液的 pH 不一定为 7,故 A 错误;
B.溶液中存在电荷守恒 c(CH3COO-)+c(OH-)= c( +
4NH )+c(H+),M 点 pHc(OH-),
结合电荷守恒可知 c(CH3COO-)>c( +
4NH ),故 B 正确;
C.当醋酸和一水合氨恰好完全反应时溶液中的溶质只有 CH3COONH4,此时只有水解促进水
的电离,电离程度达到最大,继续滴加氨水,溶液中存在氨水的电离,水的电离程度又开始
减小,故 C 错误;
D.根据物料守恒 n(CH3COOH)与 n(CH3COO-)之和始终不变,但溶液体积在变,所以
c(CH3COOH)与 c(CH3COO-)之和会发生变化,故 D 错误;
综上所述答案为 B。
14. 已知除去 NO 的一种反应如下:
主反应:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) △H
副反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
相同条件下,在甲、乙两种催化剂作用下进行上述反应。下列说法错误的是( )
A. △H<0
B. 乙催化剂的催化效果要强于甲
- 12 -
C. 改变催化剂的选择性,可以减少副反应的发生
D. 相同条件下选择高效催化剂,可以提高 M 点的平衡转化率
【答案】D
【解析】
【详解】A.据图可知温度升高到一定程度后继续升高温度 NO 的转化率下降,说明升高温度
平衡逆向移动,正反应为放热反应,△H<0,故 A 正确;
B.据图可知相同温度条件下使用催化剂乙是 NO的转化率更大,即乙催化剂的催化效果要强
于甲,故 B 正确;
C.改变催化剂的选择性,只降低主反应的活化能,加快主反应的反应速率,可以减少副反应
的发生,故 C 正确;
D.催化剂只改变反应速率,不能改变平衡转化率,故 D 错误;
综上所述答案为 D。
15. SO2(g)、O2(g)和 N2(g)起始的物质的量分数分别为 7.5%、10.5%和 82%时,在 0.5 MPa、2.5
MPa 和 5.0 MPa 不同压强下发生反应:2SO2(g)+O2(g)
催化剂 2SO3(g),SO2 平衡转化
率α随温度的变化如图所示。下列说法正确的是( )
A. 压强大小顺序 p1>p2>p3
B. 该反应在常温常压下进行最有利于提高效益
C. 恒容条件下,增加 N2 初始用量,α增大
D. 其它条件不变,若将 SO2、O2 初始用量调整为 2:1,则α减小
【答案】AD
【解析】
【详解】A.该反应前后气体系数之和减小,相同温度下增大压强平衡正向移动,SO2 的转化
率增大,所以 p1>p2>p3,故 A 正确;
B.虽然升高温度 SO2 的平衡转化率减小,但实际生产当中除了考虑平衡转化率还需要考虑反
- 13 -
应速率,常温下反应速率较慢,不利于提高效益,且该反应为气体系数之和减小的反应,较
高的压强有利于反应正向进行,故 B 错误;
C.恒容条件下氮气的用量增大,则参与反应的气体的分压减小,相当于减小压强,平衡逆向
移动,α减小,故 C 错误;
D.当 SO2 的量一定时,氧气的用量越大,α越大,其它条件不变,若将 SO2、O2 初始用量调
整为 2:1,相当于减少了氧气的用量,α减小,故 D 正确;
综上所述答案为 AD。
三、非选择题
16. 醋酸(CH3COOH)是食醋的主要成分,也是重要的化工原料。常压下,取不同浓度、不同温
度的醋酸溶液测定,得到下表实验数据。
温度/℃ c(CH3COOH)/(mol/L) 电离常数/(mol/L) 电离度/(%)
0 3 1.60 10-5 0.233
25 2 1.80 10-5 0.30
50 1 2.50 10-5 a
已知: 已电离的弱电解质的物质的量电离度= ×100%起始时弱电解质的物质的量 ;50℃时 CH3COO-的水解平衡常
数 Kh=4×10-9;lg5≈0.7。
回答下列问题:
(1)增大醋酸溶液中 CH3COOH 电离程度可采取的措施有___________、___________。
(2)上表中 a=___________。
(3)50℃时,H2O 的离子积常数 K=___________(mol·L-1)2,50℃时 1 mol·L-1CH3COOH 溶液的
pH=___________。
(4)25℃时,浓度均为 0.10 mol·L-1 的 CH3COOOH 和 CH3COONa 的缓冲溶液(化学上把外加少
量酸、碱而 pH 基本不变的溶液,称为缓冲溶液)的 pH=4.76。
①向 1.0 L 上述缓冲溶液中滴加几滴 NaOH 稀溶液(忽略溶液体积的变化),反应后溶液中 c(H
+)=___________mol·L-1。
②该缓冲溶液中离子浓度由大到小的顺序是___________。
- 14 -
【答案】 (1). 升高温度 (2). 将溶液用水稀释 (3). 05 (4). 1×10-13 (5). 2.3
(6). 1 10-4.76 (7). c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
【解析】
【详解】(1)弱电解质的电离为吸热过程,所以升高温度可以增大醋酸的电离程度,同时加水
稀释也可以促进弱电解质的电离;
(2)设 50℃时 1mol/L 的醋酸溶液中 c(CH3COO-)=x mol/L,则 c(H+)= x mol/L,所以电离平衡常
数 Ka= 1-
x x
x
=2.5 10-5,解得 x=5 10-3mol/L,所以电离度为
-3 1
1
5 10 mol L 100%
1mol L
=0.5%,
所以 a=0.5;
(3)醋酸的电离平衡常数为 Ka=
3
3
+HCH COO
CH COOH
c c
c
,醋酸根的水解平衡常数为
Kh=
3
3
-OHCH COOH
CH COO
c c
c ,所以相同温度下的 Ka 与 Kh 的乘积即为该温度下的 Kw,则
Kw=2.5 10-5 4×10-9=1×10-13(mol·L-1)2;根据(2)的计算可知该温度下 1mol/L 的醋酸溶液中
c(H+)=5 10-3mol/L,pH=-lg c(H+)=2.3;
(4)①化学上把外加少量酸、碱而 pH 基本不变的溶液,称为缓冲溶液,所以该溶液中滴入几滴
NaOH 后 pH 基本不变,仍为 4.76,则 c(H+)=1 10-4.76mol/L;
②该缓冲溶液的 pH=4.76、呈酸性,即 c(H+)>c(OH-),电荷关系为
c(H+)+c(Na+)=c(OH-)+c(CH3COO-),所以溶液中离子浓度由大到小的顺序是 c(CH3COO-)>
c(Na+)>c(H+)>c(OH-)。
17. 将 SO2 转化为 SO3 是工业上生产硫酸的关键步骤,发生反应:
2SO2(g)+O2(g) 2SO3(g) △H=-196 kJ·mol-1,某小组计划研究在相同温度下该反应的物质
变化和能量变化,他们分别在恒温下的密闭容器中加入一定量的物质,获得如下数据:
容器
编号
容器
体积/L
起始时各物质的物质的量/mol
达到平衡的时间/min 平衡时反应热量变化/kJ
SO2 O2 SO3
① 1 0.050 0.030 0 t1 放出热量:Q1
- 15 -
② 1 0.100 0.060 0 t2 放出热量:Q2
回答下列问题:
(1)若容器①的容积变为原来的 2 倍,则 SO2 的平衡转化率___________(填“增大”、“减小”
或“不变”)。
(2)容器①、②中均达到平衡时:t1___________t2,放出热量 2Q1___________Q2(填“>”、“<”
或“=”)。
(3)SO2(g)与 O2(g)在 V2O5 作催化剂的条件下的反应历程如下:
①SO2+V2O5=SO3+2VO2;
②___________(写出第 2 步反应的化学方程式);V2O5 能加快反应速率的根本原因是
___________。
(4)在 450℃、100 kPa 的恒温恒压条件下,SO3 的平衡体积分数随起始投料 2
2
n(SO )
n(O ) 的变化如图
所示,用平衡压强(平衡压强=该物质的体积分数×总压强)代替平衡浓度,则 450℃时,该反应
的 Kp=___________。
【答案】 (1). 减小 (2). > (3). < (4). O2+4VO2=2V2O5 (5). 催化剂通过参与反
应改变反应历程,降低反应的活化能来加快化学反应速率 (6). 0.05kPa-1
【解析】
【详解】(1) 若容器①的容积变为原来的 2 倍,相当于减小压强,平衡逆向移动,二氧化硫的
平衡转化率减小;
(2)温度相同,容器体积相同,但容器②中投料更多,浓度更大,反应速率更快,所以达到平
衡时间 t1>t2;若容器②和容器①为等效平衡,则 2Q1=Q2,但实际上要在等效平衡的基础上增
大压强,平衡正向移动,放出的热量更多,所以 2Q1 H2CO3> HSO 3
,所以离子反应方程式为
H2SO3+HCO 3
=CO2+ HSO 3
+H2O;
④酸性越强同浓度的溶液 pH 越小,所以可以测定相同浓度的氢硫酸和亚硫酸的 pH,氢硫酸
的 pH 大于亚硫酸;
酸性越强电离程度越大,同浓度的溶液导电性越强,用相同浓度的氢硫酸和亚硫酸做导电性
实验,氢硫酸的导电能力低于亚硫酸;
强酸可以和弱酸盐反应生成强酸盐和弱酸,所以可以将相同浓度的氢硫酸和亚硫酸分别于能
浓度的碳酸氢钠溶液混合,氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸与碳酸氢钠溶液生成
气体。
20. 乙二酸(H2C2O4)俗称草酸,为无色晶体,是二元弱酸,广泛分布于植物、动物和真菌体中,
在实验研究和化学工业中应用广泛。回答下列问题:
(1)工业上可由以下反应制取草酸:
I.4CO(g)+4C4H9OH(l)+O2(g) 2 2PdCl CuCl
13 15MPa
~ 2(COOC4H9)2(l)+2H2O(l)
II.(COOC4H9)2(l)+2H2O(l) H2C2O4(l)+2C4H9OH(l)
①反应 I 选择 13~15 MPa 的高压条件下进行,最主要的原因是为了___________,若 5min 内
c(O2)减少了 0.15 mol·L-1,则用 CO 表示的反应速率为___________mol·L-1·min-1
②对于反应 II,下列能够说明其已经达到平衡状态的是___________(填序号)。
a.溶液的 pH 保持不变
b.平衡常数 K 保持不变
c.丁醇的浓度保持不变
d.反应液的总质量保持不变
(2)草酸溶液中微粒的物质的量分数随溶液 pH 变化如图所示:
①某温度下,测得 0.1 mol·L-1 H2C2O4 溶液的 pH=1.3,此时草酸的电离方程式为___________。
②向 10 mL 0.1 mol·L-1 H2C2O4 溶液中逐滴加入 0.1 mol·L-1 NaOH 溶液,当溶液中 c(Na
- 21 -
+)=2c( 2-
2 4C O )+c( -
2 4HC O )时,加入 V(NaOH)___________10 mL(填“>”“=”或“<”),若加入
NaOH 溶液体积为 20 mL,此时溶液中阴离子浓度的大小顺序为___________;当 pH=2.7 时,
溶液中
2 -
2 4
2-
2 2 4 2 4
c (HC O )
c(H C O )c(C O ) =___________。
【答案】 (1). 增大气体在丁醇中的溶解度,有利于反应进行(或增大反应速率) (2).
0.12mol·L-1·min-1 (3). ac (4). + -
2 2 4 2 4H C O H +HC O (5). > (6). c(OH-)>
c( 2-
2 4C O )>c( -
2 4HC O ) (7). 103 或 1000
【解析】
【详解】(1)①该反应有气体参与,在高压条件下进行,可增大气体在丁醇中的溶解度,或增
大反应速率,从而有利于反应的进行,若 5min 内氧气的浓度减少了 0.15mol·L-1,则根据方程
式 , CO 的 浓 度 减 少 0.15mol·L-1×4=0.6mol·L-1 , 则 用 CO 表 示 的 反 应 速 率 为
-1
-1 -10.6mol L =0.12mol L min5min
;
②a.反应液中有乙二酸,溶液显酸性,当溶液的 pH 保持不变时,说明溶液中乙二酸的浓度
保持不变,可以说明反应达到平衡,a 符合题意;
b.平衡常数只与温度有关,该反应在一定温度下进行,平衡常数不发生改变,为定量,因此
平衡常数 K 保持不变时,不能说明反应达到平衡状态,b 不符合题意;
c.丁醇的浓度为变量,当其不发生改变时,说明反应达到平衡,c 符合题意;
d.根据质量守恒,该反应的反应物和生成物均为液体,故反应液的总质量始终不变,因此当
其不发生改变时,不能说明反应达到平衡状态,d 不符合题意;
答案选 ac;
(2)①根据图像可知,当 H2C2O4 溶液的 pH=1.3 时,溶液中存在 -
2 4HC O ,不存在 2-
2 4C O ,故草
酸的电离方程式为 + -
2 2 4 2 4H C O H +HC O ;
②根据电荷守恒,c(Na+)+c(H+)=c(OH-)+2c( 2-
2 4C O )+c( -
2 4HC O ),当溶液中 c(Na+)=2c( 2-
2 4C O )
+c( -
2 4HC O ),则 c(H+)=c(OH-),所以溶液呈中性,由于草酸氢钠溶液呈酸性,要使溶液呈中
性,则氢氧化钠需稍微过量,故加入的 V(NaOH)>10mL,若加入 NaOH 的体积为 20mL,则
n(NaOH)=0.02L×0.1mol/L=0.002mol,NaOH 过量,则溶液中阴离子浓度的大小顺序为 c(OH-)
- 22 -
>c( 2-
2 4C O )>c( -
2 4HC O ),当 pH=2.7 时,草酸溶液中存在电离平衡:
+ -
2 2 4 2 4H C O H +HC O 、 - + 2-
2 4 2 4HC O H +C O ,则
- +
2 4
1
2 4
c HC O c H
= c HC OK
,
2- +
2 4
2 -
2 4
c C O c H
=
c HC O
K
,由
- +
2 4
2 -
2 41 2 4
2-2- +
2 2 2 4 2 42 4
-
2 4
c HC O c H
c HC O c (HC O )
c(H C O )c(C O )c C O c H
c HC O
K
K
,又由图像可
知,当 + -
2 2 4 2 4H C O H +HC O 电离平衡时,pH=1.2,则 K1=10-1.2,当
- + 2-
2 4 2 4HC O H +C O 电离平衡时,pH=4.2,则 K1=10-4.2,因此
2 - 1.2
32 4 1
2- 4.2
2 2 4 2 4 2
c (HC O ) 10 10c(H C O )c(C O ) 10
K
K
。