- 2021-05-24 发布 |
- 37.5 KB |
- 30页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习浙江专版专题9专题讲座四基本概念、基本理论综合学案
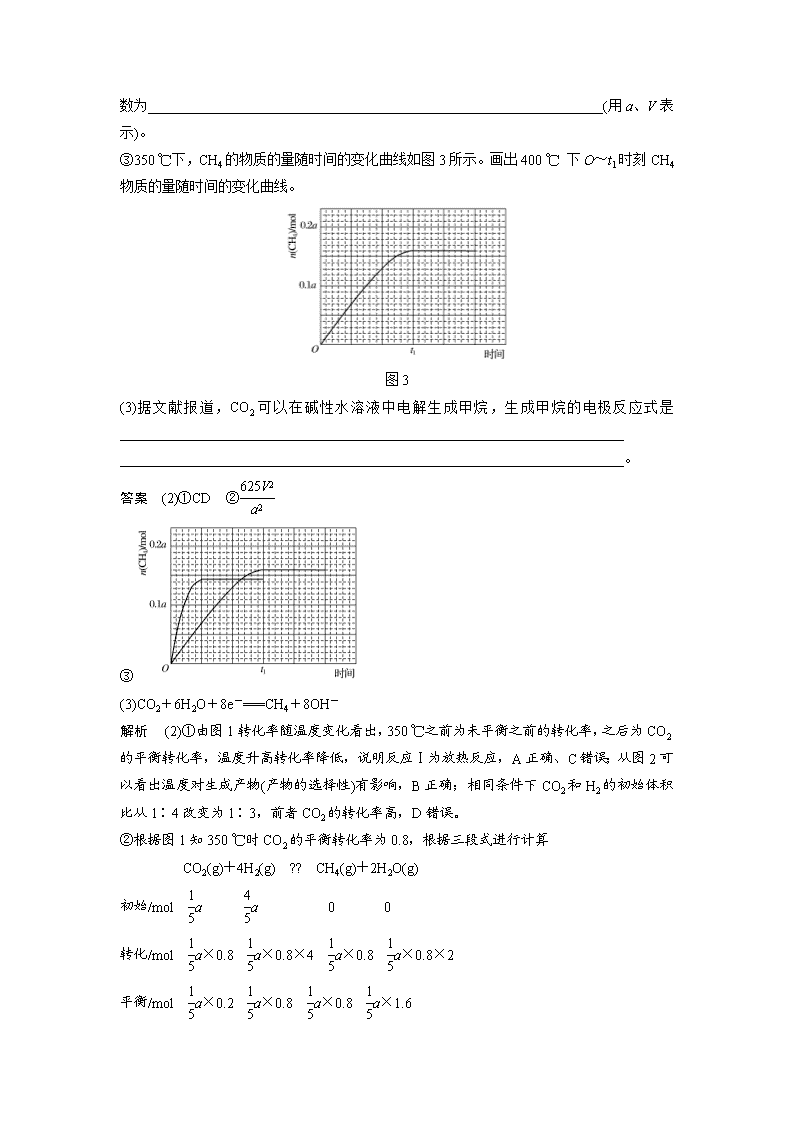
专题讲座四 加试第30题——基本概念、基本理论综合 1.[2017·浙江4月选考,30(2)(3)]以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。 请回答: (2)在常压、Ru/TiO2催化下,CO2和H2混合气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。 反应 Ⅰ CO2(g)+4H2(g)??CH4(g)+2H2O(g) ΔH4 反应Ⅱ CO2(g)+H2(g)??CO(g)+H2O(g) ΔH5 图1 图2 ①下列说法不正确的是________。 A.ΔH4小于零 B.温度可影响产物的选择性 C.CO2平衡转化率随温度升高先增大后减少 D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率 ②350 ℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为V L,该温度下反应Ⅰ 的平衡常数为_________________________________________________________________(用a、V表示)。 ③350 ℃下,CH4的物质的量随时间的变化曲线如图3所示。画出400 ℃ 下O~t1时刻CH4物质的量随时间的变化曲线。 图3 (3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是________________________________________________________________________ ________________________________________________________________________。 答案 (2)①CD ② ③ (3)CO2+6H2O+8e-===CH4+8OH- 解析 (2)①由图1转化率随温度变化看出,350 ℃之前为未平衡之前的转化率,之后为CO2的平衡转化率,温度升高转化率降低,说明反应Ⅰ为放热反应,A正确、C错误;从图2可以看出温度对生成产物(产物的选择性)有影响,B正确;相同条件下CO2和H2的初始体积比从1∶4改变为1∶3,前者CO2的转化率高,D错误。 ②根据图1知350 ℃时CO2的平衡转化率为0.8,根据三段式进行计算 CO2(g)+4H2(g) ?? CH4(g)+2H2O(g) 初始/mol a a 0 0 转化/mol a×0.8 a×0.8×4 a×0.8 a×0.8×2 平衡/mol a×0.2 a×0.8 a×0.8 a×1.6 代入求平衡常数K= =。 ③由图3看出时350 ℃时,反应在t1时达到平衡,又反应为放热反应,400 ℃反应速率加快,平衡逆向移动,生成甲烷的量减少。 2.(2016·浙江10月选考,30)氯及其化合物在生活和生产中应用广泛。 (1)已知:900 K时,4HCl(g)+O2(g)??2Cl2(g)+2H2O(g),反应自发。 ①该反应是放热还是吸热,判断并说明理由:________________________________________ ________________________________________________________________________。 ②900 K时,体积比为4∶1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(p)变化曲线如图。保持其他条件不变,升温到T(假定反应历程不变),请画出压强在1.5×105~4.5×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。 (2)已知:Cl2(g)+2NaOH(aq)===NaCl(aq)+NaClO(aq)+H2O(l) ΔH1=-102 kJ·mol-1 3Cl2(g)+6NaOH(aq)===5NaCl(aq)+NaClO3(aq)+3H2O(l) ΔH2=-422 kJ·mol-1 ①写出在溶液中NaClO分解生成NaClO3的热化学方程式:__________________________。 ②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0 mol·L-1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为ct mol·L-1,写出该时刻溶液中Cl-浓度的表达式:c(Cl-)=________(用c0、ct表示)mol·L-1。 ③有研究表明,生成NaClO3的反应分两步进行: Ⅰ.2ClO-===ClO+ Cl- Ⅱ.ClO+ClO-===ClO+Cl- 常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:______________________________________________________________________ ________________________________________________________________________。 (3)电解NaClO3水溶液可制备NaClO4。在电解过程中由于阴极上吸附氢气,会使电解电压升高,电解效率下降。为抑制氢气的产生,可选择合适的物质(不引入杂质),写出该电解的总化学方程式:____________________________。 答案 (1)①放热反应,ΔS<0且反应自发 ② (2)①3NaClO(aq)===2NaCl(aq)+NaClO3(aq) ΔH=-116 kJ·mol-1 ②c0+或 ③反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO转化 (3)2NaClO3+O22NaClO4(其他合理答案均可) 解析 (1)①该反应自发进行,即ΔG=ΔH-TΔS<0,又因ΔS<0,所以ΔH<0,为放热反应。 (2)①3NaClO(aq)+3NaCl(aq)+3H2O(l)===3Cl2(g)+6NaOH(aq) ΔH=306 kJ·mol-1 3Cl2(g)+6NaOH(aq)===5NaCl(aq)+NaClO3(aq)+3H2O(l) ΔH2=-422 kJ·mol-1 上述两式相加得 3NaClO(aq)===2NaCl(aq)+NaClO3(aq) ΔH=-116 kJ·mol-1。 ②Cl2+2NaOH===NaCl+NaClO+H2O c0 c0 3NaClO===2NaCl+NaClO3 c0-ct 所以c(Cl-)=c0+。 (3)电极反应式为 阳极:ClO-2e-+H2O===ClO+2H+ 阴极:2H++2e-===H2 利用O2把生成的H2除去,2H2+O2===2H2O, 总反应式为2NaClO3+O22NaClO4。 3.(2016·浙江4月选考,30)氨气及其相关产品是基本化工原料,在化工领域中具有重要的作用。 (1)以铁为催化剂,0.6 mol氮气和1.8 mol氢气在恒温、容积恒定为1 L的密闭容器中反应生成氨气,20 min后达到平衡,氮气的物质的量为0.3 mol。 ①在第25 min时,保持温度不变,将容器体积迅速增大至2 L并保持恒容,体系达到平衡时N2的总转化率为38.2%,请画出从第25 min起H2的物质的量浓度随时间变化的曲线。 ②该反应体系未达到平衡时,催化剂对逆反应速率的影响是______(填“增大”“减少”或“不变”)。 (2)①N2H4是一种高能燃料,有强还原性,可通过NH3和NaClO反应制得,写出该制备反应的化学方程式:__________________________________________________________________ ________________________________________________________________________。 ②N2H4的水溶液呈弱碱性,室温下其电离常数K1=1.0×10-6,则0.01 mol·L-1 N2H4水溶液的pH等于________(忽略N2H4的二级电离和H2O的电离)。 ③已知298 K和101 kPa条件下: N2(g)+3H2(g)===2NH3(g) ΔH1 2H2(g)+O2(g)===2H2O(l) ΔH2 2H2(g)+O2(g)===2H2O(g) ΔH3 4NH3(g)+O2(g)===2N2H4(l)+2H2O(l) ΔH4 则N2H4(l)的标准燃烧热ΔH=____________________________________________________。 (3)科学家改进了NO2转化为HNO3的工艺(如虚线框所示),在较高的操作压力下,提高N2O4/H2O的质量比和O2的用量,能制备出高浓度的硝酸。 ―→―→ ―→ 实际操作中,应控制N2O4/H2O质量比高于5.11,对此请给出合理解释:___________________ ________________________________________________________________________。 答案 (1)① ②增大 (2)①2NH3+NaClO===N2H4+NaCl+H2O ②10 ③ΔH2-ΔH1-ΔH4 (3)2N2O4+2H2O+O2===4HNO3,N2O4/H2O质量比等于5.11时恰好反应,高于5.11是为了提高N2O4的浓度,有利于平衡正向移动,得到高浓度的硝酸 4.(2015·浙江10月选考,30)由某精矿石(MCO3·ZCO3)可以制备单质M,制备过程中排放出的二氧化碳可以作为原料制备甲醇,取该矿石样品1.84 g,高温灼烧至恒重,得到0.96 g仅含两种金属氧化物的固体,其中m(M)∶m(Z)=3∶5,请回答: (1)该矿石的化学式为______________。 (2)①以该矿石灼烧后的固体产物为原料,真空高温条件下用单质硅还原,仅得到单质M和一种含氧酸盐(只含Z、Si和O元素,且Z和Si的物质的量之比为2∶1)。写出该反应的化学方程式________________________________________________________________________ ________________________________________________________________________。 ②单质M还可以通过电解熔融MCl2得到,不能用电解MCl2溶液的方法制备M的理由是_______________________________________________________________。 (3)一定条件下,由CO2和H2制备甲醇的过程中含有下列反应: 反应1:CO2(g)+H2(g)??CO(g)+H2O(g) ΔH1 反应2:CO(g)+2H2(g)??CH3OH(g) ΔH2 反应3:CO2(g)+3H2(g)??CH3OH(g)+H2O(g) ΔH3 其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图1所示。 则ΔH2______(填“大于”“小于”或“等于”)ΔH3,理由是___________________________ ________________________________________________________________________。 (4)在温度T1时,使体积比为3∶1的H2和CO2在体积恒定的密闭容器内进行反应。T1温度下甲醇浓度随时间变化曲线如图2所示;不改变其他条件,假定t时刻迅速降温到T2,一段时间后体系重新达到平衡。试在图中画出t时刻后甲醇浓度随时间变化至平衡的示意曲线。 答案 (1)MgCO3·CaCO3 (2)①2MgO+2CaO+Si Ca2SiO4+2Mg ②电解MgCl2溶液时,阴极上H+比Mg2+容易得电子,电极反应式2H2O+2e-=== H2↑+2OH-,所以不能得到Mg单质 (3)小于 由图1可知,随着温度升高,K1增大,则ΔH1>0,根据盖斯定律又得ΔH3=ΔH1+ΔH2,所以ΔH2<ΔH3 (4) 加试题第30题是基本概念、基本理论组合题,主要是结合无机推断、化学工艺,考查了热化学、电化学、化学平衡及电解质溶液的知识,涉及的基本能力有审题能力、计算能力、简答能力及绘图能力等。由于考查知识全面,题目综合性较强,但每空分值较少(最多2分),这就要求学生审题要仔细,计算要准确,绘图要规范,简答要精炼,争取在有限的时间内得高分。 (一)信息型方程式的书写 1.某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是________________________________ ________________________________________________________________________。 答案 6OH-+3Cl2===5Cl-+ClO+3H2O 2.MnO2与KClO3、KOH溶液共热,可得到K2MnO4,此反应的化学方程式是________________________________________________________________________________ ________________________________________________________________________。 答案 3MnO2+6KOH+KClO33K2MnO4+KCl+3H2O 3.向1 L 1 mol·L-1的K2FeO4中加入足量稀H2SO4酸化,可以产生O2和Fe3+,该反应的离子方程式为______________________________________________________________________ ________________________________________________________________________。 答案 4FeO+20H+===4Fe3++3O2↑+10H2O 4.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2(已知HCN、HOCN中N元素的化合价相同)则反应的离子方程式:__________________________________。 答案 2OCN-+3ClO-===CO+CO2↑+3Cl-+N2↑ 5.在催化剂作用下,尿素[CO(NH2)2]也可以将NOx反应生成N2和H2O。写出CO(NH2)2与NO2反应的化学方程式:_________________________________________________________。 答案 4CO(NH2)2+6NO27N2+4CO2+8H2O 6.氨基甲酸铵(NH2COONH4) 极易水解,产物是碳酸氢铵和一种弱碱,请写出其水解反应方程式:________________________________________________________________________ ________________________________________________________________________。 答案 NH2COONH4 +2H2O??NH4HCO3+NH3·H2O 7.煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。写出NaClO2溶液脱硝(使NO转化为NO)过程中主要反应的离子方程式:___________________________________________________________________。 答案 4OH-+3ClO+4NO===4NO+3Cl-+2H2O 8.在碱性条件下,写出O2将Mn2+氧化成MnO(OH)2的离子方程式:_____________________。 答案 O2+2Mn2++4OH-===2MnO(OH)2↓ 9.一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH),其离子方程式为_____________________________ ________________________________________________________________________。 答案 2Fe2++BH+4OH-===2Fe+ B(OH)+2H2↑ 10.+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O还原成Cr3+,该反应的离子方程式为_____________________________________________________________________ ________________________________________________________________________。 答案 Cr2O+3HSO+5H+===2Cr3++3SO+4H2O(或Cr2O+8HSO===2Cr3++3SO+5SO+4H2O) (二)盖斯定律应用强化练 1.目前我国已对许多大型燃煤发电厂进行“脱硝(使NOx转化为N2)”工艺改造,这有利于氮元素在自然界中实现良性循环,“脱硝”涉及到的部分反应如下: ①4NH3(g)+6NO(g)??5N2(g)+6H2O(g) ΔH1=-1 776 kJ·mol-1; ②8NH3(g)+6NO2(g)??7N2(g)+12H2O(g) ΔH2; ③N2(g)+O2(g)??2NO(g) ΔH3=180 kJ·mol-1; ④2NO(g)+O2(g)??2NO2(g) ΔH4=-114 kJ·mol-1 则ΔH2=________kJ·mol-1。 答案 -2 670 解析 根据盖斯定律,将①×2+③×3-④×3得:8NH3(g)+6NO2(g)??7N2(g)+12H2O(g) ΔH2=(-1 776 kJ·mol-1)×2+180 kJ·mol-1×3-(-114 kJ·mol-1)×3=-2 670 kJ·mol-1。 2.已知下列反应的热化学方程式: ①6C(s)+5H2(g)+3N2(g)+9O2(g)===2C3H5(ONO2)3(l) ΔH1 ②2H2(g)+O2(g)===2H2O(g) ΔH2 ③C(s)+O2(g)===CO2(g) ΔH3 则反应4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为_______________。 答案 12ΔH3+5ΔH2-2ΔH1 解析 根据盖斯定律可知③×12+②×5-①×2即得到反应4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH=12ΔH3+5ΔH2-2ΔH1。 3.以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知: ①2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=-159.5 kJ·mol-1 ②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) ΔH=116.5 kJ·mol-1 ③H2O(l)===H2O(g) ΔH=44.0 kJ·mol-1 写出CO2与NH3合成尿素和液态水的热化学方程式: ________________________________________________________________________。 答案 2NH3(g)+CO2(g)===CO(NH2)2(s)+H2O(l) ΔH=-87.0 kJ·mol-1 解析 根据盖斯定律可知①+②-③即得到CO2与NH3合成尿素和液态水的热化学方程式:2NH3(g)+CO2(g)===CO(NH2)2(s)+H2O(l) ΔH=-87.0 kJ·mol-1。 4.已知:①H2O(g)===H2O(l) ΔH1=-Q1 kJ·mol-1 ②C2H5OH(g)===C2H5OH(l) ΔH2=-Q2 kJ·mol-1 ③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH3=-Q3 kJ·mol-1 若使46 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为__________ kJ。 答案 3Q1-Q2+Q3 解析 根据盖斯定律可知①×3-②+③即得到C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH3=-(3Q1-Q2+Q3) kJ·mol-1,46 g液态无水酒精是1 mol,因此完全燃烧,并恢复到室温,整个过程中放出的热量为(3Q1-Q2+Q3)kJ。 5.工业制氢的一个重要反应是利用CO还原H2O(g)。已知:①C(石墨,s)+O2(g)===CO2(g) ΔH=-394 kJ·mol-1 ②2C(石墨,s)+O2(g)===2CO(g) ΔH=-222 kJ·mol-1 ③H2(g)+O2(g)===H2O(g) ΔH=-242 kJ·mol-1 则CO还原H2O(g)的热化学方程式为_______________________________________________ ________________________________________________________________________。 答案 CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1 解析 已知在25 ℃时:①C(石墨,s)+O2(g)===CO2(g) ΔH3=-394 kJ·mol-1,②2C(石墨,s)+O2(g)===2CO(g) ΔH2=-222 kJ·mol-1,③H2(g)+O2(g)===H2O(g) ΔH2=-242 kJ·mol-1,由盖斯定律,①-③-②×得:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=ΔH1-ΔH3-×ΔH2=-394 kJ·mol-1-(-242 kJ·mol-1)-(-111 kJ·mol-1)=-41 kJ·mol-1。 6.瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下: ①2PbS(s)+3O2(g) ===2PbO(s)+2SO2(g) ΔH1=a kJ·mol-1 ②PbS(s)+2PbO(s)===3Pb(s)+SO2(g) ΔH2=b kJ·mol-1 ③PbS(s)+PbSO4(s)===2Pb(s)+2SO2(g) ΔH3=c kJ·mol-1 反应 3PbS(s)+6O2(g)===3PbSO4(s) ΔH=________kJ·mol-1 (用含 a、b、c的代数式表示)。 答案 2a+2b-3c 解析 根据盖斯定律①×2+②×2-③×3得到3PbS(s)+6O2(g)===3PbSO4(s) ΔH=2ΔH1+2ΔH2-3ΔH3=(2a+2b-3c) kJ·mol-1。 7.FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时: ①2SO2(g)+O2(g)??2SO3(g) ΔH1=-197 kJ·mol-1 ②H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1 ③2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1 则SO3(g)与H2O(l)反应的热化学方程式是____________________________________________ ________________________________________________________________________。 答案 SO3(g)+H2O(l)===H2SO4(l) ΔH=-130 kJ·mol-1 解析 根据盖斯定律可知(③-①-②×2)/2即得到SO3(g)与H2O(l)反应的热化学方程式:SO3(g)+H2O(l)===H2SO4(l) ΔH=-130 kJ·mol-1。 8.甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下: ①CO(g)+2H2(g)??CH3OH(g) ΔH1 ②CO2(g)+3H2(g)??CH3OH(g)+H2O(g) ΔH2 ③CO2(g)+H2(g)??CO(g)+H2O(g) ΔH3 回答下列问题: 已知反应①中相关的化学键键能数据如下: 化学键 H—H C—O C≡O H—O C—H E/kJ·mol-1 436 343 1 076 465 413 由此计算ΔH1=________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=________kJ·mol-1。 答案 -99 41 解析 反应热=反应物总键能-生成物总键能,故ΔH1=1 076 kJ·mol-1+2×436 kJ·mol-1-(3×413+343+465) kJ·mol-1=-99 kJ·mol-1;根据盖斯定律:反应②-反应①=反应③,故ΔH3=ΔH2-ΔH1=-58 kJ·mol-1-(-99 kJ·mol-1)=41 kJ·mol-1。 (三)电化学知识应用集训 1.消除SO2污染的方法之一是利用电化学法可直接将其转化为硫酸,转化原理如图所示,则负极上的电极反应式为__________________________________,质子的移动方向为________________________(填“自左向右”或“自右向左”)。 答案 SO2+2H2O-2e-===SO+4H+ 自左向右 解析 负极上二氧化硫失电子和水反应生成硫酸根离子和氢离子,电极反应式为SO2+ 2H2O-2e-===SO+4H+,质子带正电荷,移动方向与电子相反,移动方向为自左向右。 2.(1)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如下图,写出该电池充电时的阳极电极反应式: ________________________________________________________________________。 (2)As2S3和HNO3反应如下:As2S3+10H++10NO===2H3AsO4+3S+10NO2↑+2H2O,将该反应设计成原电池,则NO2应该在________(填“正极”或“负极”)附近逸出,该极的电极反应式为___________________________________________________________________。 (3)LiOH是制备锂离子电池正极材料的重要原料,其电解法制备装置如下图。气体a通入KI淀粉溶液中,发现溶液变蓝,持续一段时间后,蓝色逐渐褪去。则M极为电源的________(填“正”或“负”)极,B极区电解液为________(填化学式)溶液,该离子交换膜是________(填“阳”或“阴”)离子交换膜,解释蓝色褪去的原因:__________________________________ ________________________________________________________________________。 答案 (1)LiFePO4-xe-===Li(1-x)FePO4+xLi+ (2)正极 NO+e-+2H+===NO2↑+H2O (3)负 LiCl 阳 氯气将生成的I2继续氧化为更高价态的碘的化合物 解析 (1)充电时发生氧化反应的为阳极,电极反应式为LiFePO4-xe-===Li(1-x)FePO4+xLi+。(2)原电池中正极发生还原反应,则某元素的化合价降低,由反应可知N元素的化合价由+5降低到+4,则NO2属于还原产物,在正极生成,即NO+e-+2H+===NO2↑+H2O。(3)电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,左侧生成氢气,则A极区中氢离子放电,可知A为阴极,M是负极,在A极区制备LiOH,Li+由B极区经过阳离子交换膜向A极区移动,离子交换膜是阳离子交换膜;B中为LiCl溶液,氯离子放电生成氯气,Cl2将I2氧化成更高价态的碘的化合物,导致蓝色褪去。 3.氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理: (1)氨气燃料电池的电解质溶液最好选择________(填“酸性”“碱性”或“中性”)溶液。 (2)空气在进入电池装置前需要通过过滤器除去的气体是______________________。 (3)氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的电极总反应是______________,正极的电极反应式是__________________________。 答案 (1)碱性 (2)CO2 (3)4NH3 + 3O2===2N2 + 6H2O 3O2+12e-+6H2O===12OH-(或O2 +4e-+2H2O===4OH-) 解析 (1)氨气是碱性气体,所以电解液最好选择碱性的。(2)空气中的CO2能和氨水反应,所以滤去的气体是CO2。(3)正极发生还原反应,氧气在正极反应,注意是碱性环境,所以,正极的电极反应式为O2+4e-+2H2O===4OH-。 4.SO2在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图: 该电池的负极反应:_____________________________________________________________; 当甲中消耗2.24 L O2(标准状况)时,乙中a极增重________g。 答案 SO2-2e-+2H2O===4H++SO 12.8 解析 甲池为燃料电池,SO2作为负极材料,失去电子,电极反应式为SO2-2e-+2H2O===4H++SO,正极为O2,燃料电池中正极反应为O2+4H++4e-===2H2O;乙池是电解池,a极接燃料电池的负极,故a极为电解池阴极,Cu2+放电,电极反应式:Cu2+ +2e- ===Cu,根据O2+4H++4e-===2H2O,Cu2+ +2e- ===Cu,可得O2~4e-~2Cu,得甲中消耗2.24 L O2(标准状况),即0.1 mol时,转移电子数为0.4 mol,乙中a极析出Cu,增重12.8 g。 5.在强酸性的电解质水溶液中,惰性材料作电极,电解CO2可得到多种燃料,其原理如图所示。 该工艺中能量转化方式主要有______________________________;电解时,生成乙烯的电极反应式是______________________。 答案 太阳能转化为电能,电能转化为化学能 2CO2+12H++12e-===C2H4+4H2O 解析 太阳能电池为电源,电解强酸性的二氧化碳水溶液得到乙烯,可知能量转化形式有太阳能转化为电能,电能转化为化学能,部分电能转化为热能;电解时,生成乙烯的电极反应式为2CO2+12H++12e-===C2H4+4H2O。 6.过二硫酸的结构为,其中氧元素的化合价为_____________。电解法是制备过二硫酸钾的方法之一, 其装置示意图如下: 则:b 为电源的________极; 阳极反应式为__________________; 导线中流过 1 mol 电子时, 理论上通过阳离子交换膜的K+的数目为__________________________。 答案 -2价和-1价 负 2SO-2e-===S2O NA或 6.02×1023 解析 过二硫酸的结构为,其中过氧键中氧元素的化合价为-1价,其余氧元素的化合价是-2价。硫酸根在阳极失去电子转化为过二硫酸根,阴极是溶液中的氢离子得到电子转化为氢气,即A是氢气,所以b 为电源的负极,阳极反应式为2SO-2e-===S2O;导线中流过1 mol电子时,根据电荷守恒可知理论上通过阳离子交换膜的K+的数目为NA或 6.02×1023。 7.利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O===2HCOOH+O2,装置如图所示: 电极2的电极反应式是___________________________________________________________; 在标准状况下,当电极2室有11.2 L CO2反应。理论上电极1室液体质量______ (填“增加”或“减少”)______g。 答案 CO2+2H++2e-===HCOOH 减少 9 解析 离子交换膜为质子膜,则电解质溶液呈酸性,根据总的电池反应为2H2O + 2CO2 ===2HCOOH + O2可知,该反应中C元素化合价由+4价变为+2价,O元素化合价由-2价变为0价,所以1是负极、2是正极(也可根据装置图中电子的流向判断),负极上水失电子生成氢离子和氧气,电极1电极反应:2H2O-4e-===O2+4H+,酸性增强,H+通过质子膜进入到电极2区域;电极2通入二氧化碳,酸性条件下生成HCOOH,电极反应:CO2+2H++2e-===HCOOH,酸性减弱, 从总反应看,每消耗1 mol CO2,就会消耗1 mol H2O,现有标准状况下11.2 L即0.5 mol CO2反应,则消耗0.5 mol H2O,即9 g。 (四)电解质溶液 1.将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为________,经测定溶液中CH3COO-的浓度为1.4×10-3 mol·L-1,此温度下醋酸的电离常数:Ka=________,温度升高Ka将________(填“变大”“不变”或“变小”)。 答案 0.1 mol·L-1 1.99×10-5 变大 解析 将6 g CH3COOH溶于水制成1 L溶液,醋酸的物质的量是6 g÷60 g·mol-1=0.1 mol,此溶液的物质的量浓度为0.1 mol÷1 L=0.1 mol·L-1,经测定溶液中CH3COO-的浓度为1.4×10-3 mol·L-1,此温度下醋酸的电离常数:Ka=≈1.99×10-5,温度升高促进电离,因此Ka将变大。 2.次磷酸(H3PO2)是一种一元弱酸,具有较强的还原性。试回答下列问题: NaH2PO2为________(填“正盐”或“酸式盐”),溶液中有关离子浓度从大到小的顺序为________________________________________________________________________。 答案 正盐 c(Na+)>c(H2PO)>c(OH-)>c(H+) 3.已知25 ℃时,HCN的电离常数Ka=4.9×10-10,则25 ℃时0.1 mol·L-1的HCN溶液中c(H+)=________mol·L-1。NaCN溶液中加入盐酸至怡好完全反应,溶液中所有离子浓度的关系为________________________________________________________________________ ________________________________________________________________________。 答案 7×10-6 c(Na+)=c(Cl-)>c(H+)>c(CN-)>c(OH-) 解析 根据HCN??H++CN-可知,Ka====4.9×10-10,c(H+)= 7×10-6;NaCN溶液中加入盐酸至恰好完全反应时生成等物质的量的氯化钠和HCN,溶液显酸性,溶液中所有离子浓度的关系为c(Na+)=c(Cl-)>c(H+)>c(CN-)>c(OH-)。 4.已知室温下,碳酸的电离常数K1=4.4×10-7,K2=4.7×10-11。NaHCO3水溶液显碱性,原因:________________________________________________________________________ _________________________________________________________________(用K 定量解释)。 答案 碳酸氢钠溶液中的水解平衡常数Kh===2.5×10-8,大于碳酸的电离常数K2=4.7×10-11 5.已知:HSO??H++SO K=1.02×10-7 NH+H2O??NH3·H2O+H+ K=5.65×10-10 往亚硫酸氢铵中加入一定量的氢氧化钡溶液,可能发生反应的离子方程式是______(填编号)。 a.HSO+Ba2++OH-===BaSO3↓+H2O b.NH+2HSO+2Ba2++3OH-===2BaSO3↓+2H2O+NH3·H2O c.NH+HSO+Ba2++2OH-===BaSO3↓+H2O+NH3·H2O d.2NH+4HSO+3Ba2++6OH-===3BaSO3↓+4H2O+2NH3·H2O+SO 答案 cd 解析 已知:HSO??H++SO K=1.02×10-7,NH+H2O??NH3·H2O+H+ K=5.65×10-10,亚硫酸氢根离子的电离程度大于氨根离子的水解程度,所以亚硫酸氢铵溶液中滴入氢氧化钡溶液,氢氧根离子先和亚硫酸氢根离子反应,后与铵根离子结合生成一水合氨,反应中氢氧化钡的量不同产物不同,不足量的氢氧化钡反应时需要满足化学式的组成比。 a项,HSO+Ba2++OH-===BaSO3↓+H2O是氢氧化钡不足量时的反应,只和亚硫酸氢根离子反应,则氢氧化钡电离出的钡离子和氢氧根离子全部反应,需要符合化学式的组成比,正确的离子方程式应为2HSO+Ba2++2OH-===BaSO3↓+2H2O+SO; b项,NH+2HSO+2Ba2++3OH-===2BaSO3↓+2H2O+NH3·H2O,电离出2 mol Ba2+,电离出的氢氧根离子为4 mol,其中2 mol OH-和2 mol亚硫酸氢根离子反应,2 mol OH-和2 mol NH反应,正确的反应离子方程式为NH+HSO+Ba2++2OH-===BaSO3↓+H2O+NH3·H2O; c项,选项中离子方程式为氢氧化钡和亚硫酸氢铵1∶1反应的离子方程式,NH+HSO+Ba2++2OH-===BaSO3↓+H2O+NH3·H2O; d项,2NH+4HSO+3Ba2++6OH-===3BaSO3↓+4H2O+2NH3·H2O+SO,分析离子方程式,反应是4 mol NH4HSO3和3 mol Ba(OH)2的反应,6 mol OH-先和4 mol HSO反应,剩余 2 mol OH-再和2 mol NH反应,剩余2 mol NH生成亚硫酸铵,反应的离子方程式正确。 6.工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离平衡常数K =1.8×10-5,H2SO3的电离平衡常数K1=1.2×10-2,K2=1.3×10-8。在通入废气的过程中,当恰好形成正盐时,溶液中离子浓度的大小关系为____________________。 答案 c(NH)>c(SO)>c(OH-)>c(HSO)>c(H+)。 解析 NH3·H2O的电离平衡常数K=1.8×10-5,H2SO3的电离平衡常数K2=1.3×10-8,则SO的水解程度大于NH的水解程度,溶液呈碱性,溶液中氢氧根离子源于水的电离、SO的水解,溶液中c(OH-)>c(HSO),故溶液中离子浓度的大小关系为c(NH)>c(SO)>c(OH-)>c(HSO)>c(H+)。 7.捕捉CO2可以利用Na2CO3溶液。用100 mL 0.1 mol·L-1Na2CO3溶液完全捕捉224 mL(已换算为标准状况,溶液体积变化忽略不计)CO2气体,所得溶液中: (1)c(HCO)+c(CO)+c(H2CO3)=______mol·L-1。 (2)c(HCO)+2c(CO)=_____________________________________(用相关离子浓度表示)。 答案 (1)0.2 (2)c( Na+)+c(H+)-c(OH-) 解析 (1)CO2的物质的量是0.01 mol,二者恰好反应生成碳酸氢钠,浓度是0.2 mol·L-1,则根据物料守恒可知溶液中c(HCO)+c(CO)+c(H2CO3)=0.2 mol·L-1。(2)根据电荷守恒可知溶液中c(HCO)+2c(CO)=c( Na+)+c(H+)-c(OH-)。 8.用Na2SO3溶液作为吸收液来吸收SO2,尾气通入1 mol·L-1的Na2SO3溶液中,当溶液的pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,此时溶液中c(SO)的浓度是0.2 mol·L-1,则此时溶液中离子浓度由大到小的顺序为____________________。 答案 c(Na+)>c(HSO)>c(SO)>c(H+)>c(OH-) 解析 当溶液的pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,说明大部分转化为亚硫酸氢钠,此时溶液中c(SO)的浓度是0.2 mol·L-1,则此时溶液中离子浓度由大到小的顺序为c(Na+)>c(HSO)>c(SO)>c(H+)>c(OH-)。 9.已知碳酸H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11;草酸H2C2O4:Ka1=5.9×10-2,Ka2=6.4×10-5,0.1 mol·L-1 Na2CO3溶液的pH________(填“大于”“小于”或“等于”)0.1 mol·L-1 Na2C2O4溶液的pH;等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是________;若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种粒子浓度大小的顺序正确的是________(填字母)。 A.c(H+)>c(HC2O)>c(HCO)>c(CO) B.c(HCO)>c(HC2O)>c(C2O)>c(CO) C.c(H+)>c(HC2O)>c(C2O)>c(CO) D.c(H2CO3)>c(HCO)>c(HC2O)>c(CO) 答案 大于 草酸溶液 AC 解析 草酸的第二步电离平衡常数大于碳酸的第二步电离平衡常数,电离平衡常数越小,其酸根离子的水解程度越大,所以碳酸根离子的水解程度大于草酸根离子,0.1 mol·L-1 Na2CO3溶液的pH大于0.1 mol·L-1 Na2C2O4溶液的pH;草酸的酸性强于碳酸,则等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是草酸溶液;草酸的二级电离常数均大于碳酸的,所以草酸的电离程度大于碳酸,且碳酸以第一步电离为主,因此溶液中c(H+)>c(HC2O)>c(C2O) >c(HCO)>c(CO),则A、C正确。 10.与化学平衡类似,电离平衡的平衡常数叫做电离常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数: 酸 电离方程式 电离平衡常数K CH3COOH CH3COOH??CH3COO-+H+ 1.96×10-5 HClO HClO??ClO-+H+ 3.0×10-8 H2CO3 H2CO3??H++HCO HCO??H++CO K1=4.3×10-7 K2=5.6×10-11 H3PO4 H3PO4??H++H2PO H2PO??H++HPO HPO??H++PO K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 回答下列问题: (1)若把CH3COOH、HClO、H2CO3、HCO、H3PO4、H2PO、HPO都看作是酸,则它们酸性最强的是________(填化学式,下同),最弱的是________。 (2)室温下向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为___________________,1.2 mol·L-1的NaClO溶液pH=________(已知:lg 2=0.3)。 (3)求该温度下,0.10 mol·L-1的CH3COOH溶液中的c(H+)=________mol·L-1。 答案 (1)H3PO4 HPO (2)CO2+ClO-+H2O ===HClO+HCO 10.8 (3)1.4×10-3 解析 (1)同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数知酸性最强的是 H3PO4,最弱的是HPO。(2)因为酸性:H2CO3>HClO>HCO,所以向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为CO2+ClO-+H2O===HClO+HCO;1.2 mol·L-1的NaClO溶液中水解离子方程式为ClO-+H2O??HClO+OH-,Kh= =×==,c2(OH-)=×c(ClO-)=×1.2 mol·L-1,c(OH-)= 2×10-3.5 mol·L-1,c(H+)= =5×10-11.5,pH=-lg (5×10-11.5)=10.8。(3)该温度下,0.10 mol·L-1的CH3COOH溶液中存在电离平衡,CH3COOH??CH3COO-+H+,平衡常数K= =1.96×10-5,c2(H+)=0.10×1.96×10-5 ,c(H+)=1.4×10-3 mol·L-1。 (五)有关化学反应速率、化学平衡的简答与绘图 1.2NO(g) + O2(g)??2NO2(g) 是制造硝酸的重要反应之一。在800 ℃时,向容积为1 L的密闭容器中充入0.010 mol NO和0.005 mol O2,反应过程中NO的浓度随时间变化如下图所示。 (1)2 min内,v(O2) =________mol·L-1·min-1。 (2)800 ℃时,该反应的化学平衡常数数值为________。 (3)已知: ①2NO(g),②N2(g) + 2O2(g)===2NO2(g) ΔH=68 kJ·mol-1。结合热化学方程式,说明温度对于NO生成NO2平衡转化率的影响:__________________________。 答案 (1)1.25×10-3 (2)400 (3)2NO(g)+O2(g)??2NO2(g) ΔH=-115 kJ·mol-1,温度升高,平衡向逆反应方向移动,NO转化为NO2的平衡转化率降低 解析 (1)v(NO)=(0.010 mol·L-1 - 0.005 mol·L-1)/2 min=2.5×10-3 mol·L-1·min-1,根据物质的速率之比等于化学计量数之比可得到v(O2) =1.25×10-3mol·L-1·min-1。(2)该反应2 min时已达平衡,平衡时NO的浓度为0.005 mol·L-1,其浓度减小0.005 mol·L-1,根据化学计量数之比可知平衡时NO2的浓度为 0.005 mol·L-1 ,O2的平衡浓度为0.005 mol·L-1-0.005/2 mol·L-1=0.002 5 mol·L-1,所以800 ℃下该反应平衡常数K===400。 (3)根据①可写出N2与O2生成NO的热化学方程式:N2(g)+O2(g)===2NO(g) ΔH=945 kJ·mol-1+498 kJ·mol-1-2×630 kJ·mol-1=183 kJ·mol-1,又根据②N2(g) + 2O2(g)===2NO2(g) ΔH=68 kJ·mol-1,后一个方程式减去前一个方程式得:2NO(g)+O2(g)??2NO2(g) ΔH=-115 kJ·mol-1,正反应为放热反应,升高温度,平衡逆向移动,NO生成NO2 的平衡转化率降低。 2.(1)以CO2为原料可制备甲醇:CO2(g)+3H2(g)===CH3OH(g) + H2O(g) ΔH =-49.0 kJ·mol-1,向1 L的恒容密闭容器中充入1 mol CO2 (g)和3 mol H2(g),测得CO2 (g)和CH3OH(g)浓度随时间的变化如图1所示。 ①0~8 min内,以氢气表示的平均反应速率v(H2)=________________mol·L-1·min-1。 ②在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如图2所示,L和X分别表示温度或压强。X表示的物理量是________(填“温度”或“压强”),L1________(填“>”或“ <”)L2。 (2)向一体积为20 L的恒容密闭容器中通入1 mol CO2发生反应:2CO2(g)??2CO(g)+ O2 (g),在不同温度下各物质的体积分数变化如图3所示。 图3 1 600 ℃时反应达到平衡,则此时反应的平衡常数K=________。 答案 (1)①0.28 (或 0.281 25) ②压强 < (2)0.012 5 解析 (1)①结合化学平衡三段式计算, CO2(g)+3H2(g)??CH3OH(g)+H2O(g) 起始量(mol) 1 3 0 0 变化量(mol) 0.75 2.25 0.75 0.75 平衡量(mol) 0.25 0.75 0.75 0.75 反应速率v(H2)==≈0.28 mol·L-1·min-1。 ②该反应为气体体积减小的放热反应,利用平衡影响原理分析,升温平衡向吸热反应方向移动,增大压强平衡向气体体积减小的方向移动,由图像可知,X增大CO2的平衡转化率(α)增大,说明平衡正向移动,则X为压强,L为温度变化,温度升高平衡逆向移动,二氧化碳转化率越大,温度越低,则L1<L2。 (2)图像中减少的为二氧化碳,平衡体积分数为40%,1 600 ℃时反应达到平衡,设二氧化碳消耗浓度为x, 2CO2(g)===2CO(g)+O2(g) 起始量( mol·L-1) 0.05 0 0 变化量( mol·L-1) x x 0.5x 平衡量( mol·L-1) 0.05-x x 0.5x =40%,x=0.025 mol·L-1,平衡常数K==0.012 5。 3.下图表示起始投料量H2/CO2=4时, 反应①CO2(g)+H2(g)??CO(g)+H2O(l) ΔH1 反应②2CO2(g)+6H2(g)??CH3OCH3(g)+3H2O(l) ΔH2=-122.54 kJ·mol-1中CO2的平衡转化率随反应温度的变化关系如图1所示,根据图示回答下列问题: 图1 图2 (1)ΔH1________(填“>””<”或“=”)0。 (2)________(填“高温”或“低温”)有利于提高反应②中二甲醚的产率,请简述理由: ________________________________________________________________________。 (3)若起始投料量H2/CO2=4,起始温度为298 K,反应②在503 K时达到平衡,请在图2中画出CO2转化率随温度升高的变化曲线。 答案 (1)> (2)低温 较低温度下,反应①的平衡转化率较小而反应②的较大,所以低温对反应②有利,二甲醚的产率较高 (3) 解析 (1)根据图像可知,升高温度后,反应①中二氧化碳的转化率增大,说明升高温度平衡正向移动,则正反应为吸热反应,所以ΔH1>0。(2)由于反应①为吸热反应,反应②为放热反应,所以在较低温度下,反应①的平衡转化率较小而反应②较大,故低温对反应②有利,二甲醚的产率较高。(3)反应②在503 K时达到平衡,则从298 K 开始,二氧化碳的转化率逐渐增大,当温度达到503 K时,二氧化碳的转化率达到最大,当温度大于503 K后,二氧化碳的转化率会减小,则CO2转化率随温度升高的变化曲线为 。 4.利用反应4NH3(g)+6NO(g)===5N2(g)+6H2O(g)ΔH=-1 811.63 kJ·mol-1消除氮氧化物的污染。 相同条件下,在2 L恒容密闭容器中,选用不同的催化剂,反应产生N2的物质的量随时间变化如图1所示。 (1)在催化剂A作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图2所示,据图可知,在相同的时间内,温度对脱氮率的影响:_______________________________________ _______________________________________________________________________________, 其可能的原因是__________________________________________________________________ ________________________________________________________________________。 (已知A、B催化剂在此温度范围内不失效) 图2 (2)其他条件相同时,请在图2中补充在催化剂B作用下脱氮率随温度变化的曲线。 答案 (1)300 ℃之前,温度升高,脱氮率逐渐增大,300 ℃之后温度升高,脱氮率逐渐减小 300 ℃前反应未平衡,脱氮率决定于反应速率,温度越高反应速率越快,所以脱氮率增大,300 ℃之后反应达平衡,脱氮率决定于化学平衡的移动,该反应正反应是放热反应,升高温度平衡逆向移动,脱氮率减小 (2) 解析 (1)由图可知300 ℃以前温度越高脱氮率越高,300 ℃后温度越高脱氮率越低,原因可能是300 ℃前是平衡建立的过程,而300 ℃后是平衡移动的过程。(2)B催化剂的效率低,所以达平衡的时间长,但最终的脱氮率不变,所以图像为 。 5.已知CO2催化加氢合成乙醇的反应原理: 2CO2(g)+6H2(g)??C2H5OH(g)+3H2O(g) ΔH =-173.6 kJ·mol-1 图1 图2 图3 (1)图1、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m 为起始时的投料比,即m=。 ①图1中投料比相同,温度从高到低的顺序为______________________________。 ②图2中m1、m2、m3投料比从大到小的顺序为____________________,理由是 ________________________________________________________________________。 (2)图3表示在总压为5 MPa的恒压条件下,且m=3时,不同温度下各物质的物质的量分数与温度的关系。 ①曲线b代表的物质为________(填化学式)。 ②图3中P点时CO2的转化率为________。 ③T4温度时,该反应的平衡常数Kp=_____________________________________________。 (提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位) 答案 (1)①T3>T2>T1 ②m1>m2>m3 相同温度下,增大氢气的量,平衡正向移动,二氧化碳的转化率增大 (2)①CO2 ②66.7% ③0.250 解析 (1)①升温,平衡左移,CO2转化率降低,图1中投料比相同,温度从高到低的顺序为T3>T2>T1。②图2中m1、m2、m3投料比从大到小的顺序为m1>m2>m3,理由是相同温度下,增大氢气的量,平衡正向移动,二氧化碳的转化率增大。 (2)①升温,平衡左移,CO2、H2增多,CO2增多的程度较小,所以曲线b代表的物质为CO2;②图3中P点时,H2与H2O的物质的量分数相等,CO2的转化率等于H2的为×100%=66.7%。 ③T4温度时,CO2、H2、C2H5OH、H2O的分压p分别是10%×5 MPa、40%×5 MPa、10%×5 MPa、40%×5 MPa,该反应的平衡常数Kp==0.250。 6.在常温、常压、光照条件下,N2在催化剂TiO2表面与H2O发生反应:2N2(g)+6H2O(l)===4NH3(g)+3O2(g) ΔH=1 530.4 kJ·mol-1 进一步研究相同条件下NH3生成量与温度的关系,部分实验数据见下表: 实验组别 1 2 3 4 T/K 303 313 323 353 NH3生成量/(10-6 mol) 4.8 5.9 6.0 2.0 O2生成量/(10-6 mol) 3.6 4.4 4.5 1.5 反应时间/h 3 3 3 3 容器体积/L 2 2 2 2 (1)请在图中画出上述反应在“有催化剂”与“无催化剂” 两种情况下反应过程中体系能量随反应过程的变化趋势示意图(图中标明必要的文字说明)。 (2)根据表中数据,在303 K时,在3 h内用氮气表示其平均反应速率为________mol·L-1·h-1。判断组别4中反应是否达到平衡状态________(填“是”或“否”),并说明理由___________ ________________________________________________________________________。 答案 (1) (2)4×10-7 否 该反应正反应为吸热反应,升高温度平衡正向移动,则n(NH3)应大于6.0×10-6 mol 解析 (1)催化剂是通过降低反应的活化能来加快化学反应速率的,使用催化剂后,活化能降低,图像需要符合:①两条线的起点、终点分别相同;②有催化剂曲线最高处能量要低于无催化剂的最高处能量;③反应物的总能量要低于生成物的总能量。图像为 。 (2)在303 K时,在3 h内氧气的反应速率v(O2)==6×10-7 mol·L-1·h-1,用氮气表示其平均反应速率v(N2)=v(O2)=×6×10-7 mol·L-1·h-1=4×10-7 mol·L-1·h-1,组别4中正反应为吸热反应,升高温度平衡正向移动,则n(NH3)应大于6.0×10-6 mol,则组别4中反应未达到平衡状态。 (六)模拟综合训练 1.(2017·温州9月高三选考适应性考试)CO2回收资源化利用是环保领域研究的热点课题。 (1)在FeO催化下,以CO2为原料制取炭黑(C)的太阳能工艺如图1所示。 图1 己知:①过程1生成1 mol C(s)的反应热为ΔH1。 ②过程2反应:Fe3O4(s)??3FeO(s)+O2(g) ΔH2。 上述以CO2为原料制取炭黑总反应的热化学方程式为________________________________, 若该反应的ΔS<0,请判断该反应是否为自发反应并说明理由:________________________。 (2)以CO2为原料可以催化加氢合成低碳烯烃,利用CO2合成乙烯的反应方程式为2CO2(g)+6H2(g)??C2H4(g)+4H2O(g) ΔH3。在常压下,以 FeCoMnK/BeO 作催化剂,按n(CO2)∶n(H2)=1∶3(总物质的量为4a mol)的投料比充入密闭容器中发生反应。测得温度对CO2的平衡转化率和催化剂催化效率影响情况如图2所示。 图2 ①下列说法不正确的是______________。 A.ΔH3<0;平衡常数:KM >KN B.增加原催化剂的表面积,对平衡转化率无影响 C.生成乙烯的速率:v(M)有可能小于v(N) D.若投料比改为n(CO2)∶n(H2)=1∶2,可以提高CO2的平衡转化率 E.若投料比不变,温度越低,反应一定时间后CO2的转化率越高 ②250 ℃下,上述反应达平衡时容器体积为V L,则此温度下该反应的平衡常数为___________(用含a、V的代数式表示)。 ③某温度下,n(C2H4)随时间(t)的变化趋势曲线如图3所示。其他条件相同时,若容器的体积为其一半,画出0~t1时刻n(C2H4)随时间(t)的变化趋势曲线。 图3 (3)以稀硫酸为电解质溶液,利用太阳能可将CO2电解转化为低碳烯烃,则电解生成丙烯时,阴极的电极反应式为______________。 答案 (1)CO2(g)===C(s)+O2(g) ΔH=ΔH1+2ΔH2 该反应为非自发反应,因为该反应的ΔH>0,ΔS<0,则ΔG>0 (2)①DE ②K= ③ (3)3CO2+18e-+18H+===CH2==CH—CH3+6H2O 解析 (1)过程①CO2(g) +6FeO(s)===C(s)+ 2Fe3O4(s) ΔH1,过程②Fe3O4(s)??3FeO(s)+O2(g) ΔH2,根据盖斯定律,①+②×2得:CO2(g)===C(s)+O2(g) ΔH=ΔH1+2ΔH2;因为反应ΔH>0、ΔS<0,则ΔG>0,故反应为非自发反应。 (2)①温度升高,CO2的平衡转化率降低,则ΔH3<0,平衡常数:KM >KN,A正确;催化剂不改变平衡转化率,B正确;N点对应的温度高于M点,生成乙烯的速率:v(M)有可能小于v(N),C正确;若投料比改为n(CO2)∶n(H2)=1∶2,降低了H2在混合气体中的含量,会降低CO2的平衡转化率,D错误;温度低,催化剂的催化效果降低,反应一定时间后CO2的转化率越低,E错误。 ② 2CO2(g)+6H2(g)??C2H4(g)+4H2O(g) 起始(mol) a 3a 0 0 转化(mol) 0.5a 1.5a 0.25a a 平衡(mol) 0.5a 1.5a 0.25a a 平衡常数K==。 ③若容器的体积为其一半,压强增大,到达平衡的时间缩短,且平衡正向移动,生成更多的C2H4,n(C2H4)比原平衡大,即可得到图像。 (3)阴极应是CO2得电子,在酸性条件下,阴极的电极反应式为3CO2+18e-+18H+===CH2==CH—CH3+6H2O 2.(2017·台州9月选考科目教学质量评估)乙二醇(沸点:197.3 ℃)是一种重要的基础化工原料。由煤基合成气(主要成分CO、H2)与氧气先制得草酸二甲酯(沸点:164.5 ℃),再加氢间接合成乙二醇,该方法具有反应条件温和、环境污染小等优点。反应过程如下: 反应Ⅰ 4NO(g)+4CH3OH(g)+O2(g)??4CH3ONO(g)+2H2O(g) ΔH1=a kJ·mol-1 反应Ⅱ 2CO(g)+2CH3ONO(g)CH3OOCCOOCH3(l)+2NO(g) ΔH2=b kJ·mol-1 反应Ⅲ CH3OOCCOOCH3(l)+4H2(g)??HOCH2CH2OH(l)+2CH3OH(g) ΔH3=c kJ·mol-1 (1)煤基合成气间接合成乙二醇的总热化学方程式是__________________________________ ________________________________________________________________________, 在较低温条件下,该反应能自发进行的可能原因是___________________________________ ________________________________________________________________________。 (2)CO、CH3ONO各0.4 mol在恒温、容积恒定为2 L的密闭容器中发生反应Ⅱ,达到平衡时NO的体积分数33.3%,若此时向容器中通入0.4 mol NO,一段时间后,重新达到平衡时NO体积分数________(填“>”“=”“<”)33.3%。 (3)温度改变对反应Ⅱ的催化剂活性有影响,评价催化剂活性参数:空时收率和CO选择性,表示式如下: 空时收率= CO的选择性= ×100% 在不同温度下,某兴趣小组对四组其他条件都相同的反应物进行研究,经过相同时间t小时,测得空时收率、CO选择性数据如下表所示。 反应温度(℃) 空时收率(g· mL-1· h-1) CO的选择性(% ) 130 0.70 ①72.5 140 0.75 ② 71.0 150 0.71 ③55.6 160 0.66 ④63.3 下列说法正确的是________。 A.温度升高,空时收率先增大后减少,说明ΔH2>0 B.温度升高,催化剂活性逐渐减弱,对CO的选择性逐渐降低,所以数据④肯定错误 C.130 ℃时,CO的选择性最高,说明CO生成CH3OOCCOOCH3的转化率最高 D.综合考虑空时收率和CO的选择性,工业生成CH3OOCCOOCH3时,选择140 ℃效果最好 (4)120 ℃、常压时,CH3OOCCOOCH3+4H2??HOCH2CH2OH +2CH3OH 反应过程中能量变化如下图所示。画出180 ℃、常压时,加入催化剂,该反应过程中能量变化图。 (5)研究证实,乙二醇、氧气可以在碱性溶液中形成燃料电池,负极的电极反应式是________________________________________________________________________。 答案 (1)4CO (g)+ 8H2(g) +O2 (g)??2HOCH2CH2OH(l) + 2H2O(g) ΔH=(a+2b+2c) kJ·mol-1 该反应的ΔS<0 ,自发进行的可能原因就是ΔH<0 (2)> (3)D (4) (5)HOCH2CH2OH-10e-+14OH-===2CO+10H2O 解析 根据盖斯定律,Ⅰ+Ⅱ×2+Ⅲ×2得:4CO (g)+ 8H2(g) +O2 (g)??2HOCH2CH2OH(l) + 2H2O(g) ΔH=(a+2b+2c)kJ·mol-1;因为该反应的ΔS<0,在较低温条件下,该反应能自发进行的可能原因就是ΔH<0。 (2)达到平衡后,再向容器中通入0.4 mol NO,等同于起始时在2 L的密闭容器中加入CO、CH3ONO各0.8 mol,相对于第一次,相当于给原平衡加压,平衡正向移动,NO体积分数增大,即大于33.3%。 (3)温度升高,空时收率先增大后减少,说明ΔH2<0,A 错误;温度升高,催化剂活性先增大后逐渐减弱,B错误;130 ℃时,虽然CO的选择性最高,但空时收率低,CO生成CH3OOCCOOCH3的转化率不一定最高,C错误;综合考虑空时收率和CO的选择性,工业生成CH3OOCCOOCH3时,选择140 ℃效果最好,D正确。 (4)180 ℃、常压时,草酸二甲酯(沸点:164.5 ℃)是气态,起始能量高于120 ℃、常压时的,加入催化剂,降低反应的活化能,催化剂参与反应会生成中间产物,故该反应过程中能量变化图如下: 。 (5)燃料电池均是可燃物作负极、失电子,发生氧化反应,故乙二醇、氧气在碱性溶液中形成燃料电池时负极电极反应式是HOCH2CH2OH-10e-+14OH-===2CO+10H2O。查看更多