2021届高考化学一轮复习化学反应速率和化学平衡图象作业
化学反应速率和化学平衡图象
一、选择题(本题包括6小题,每小题8分,共48分)
1.(2019·北京东城区模拟)有可逆反应:A(g)+2B(g)nC(g)(正反应放热),A的转化率(A%)与压强p的关系如图所示,下列结论中正确的是 ( )
A.p1>p2,n>3
B.p1>p2,n<3
C.p1
3
【解析】选D。根据“先拐先平”可知,p2>p1,A、B项错误;增大压强,反应物A的转化率减小,反应逆向进行,故该反应是一个气体物质的量增大的反应,n>3,故C项错误,D项正确。
2.(2019·温州模拟)已知某可逆反应aA(g)+bB(g)cC(g)+dD(g)。反应过程中,当其他条件不变时,C的体积分数与温度(T)和压强(p)的关系如图。下列有关叙述正确的 ( )
A.正反应为吸热反应
B.降低温度,正反应速率增大
C.a+b>c+d
D.增大压强,B转化率减小
【解析】选C。由图可知,压强一定时,升高温度,C的体积分数减小,平衡逆向移动,故正反应是放热反应,A项错误;降低温度,正、逆反应速率均减小,B项错误;在温度一定时,加压后C的体积分数变大,则平衡正向移动,故a+b>c+d,C项正确;加压后平衡正向移动,故B的转化率增大,D项错误。
3.(2019·南充模拟)某温度下,对于反应N2(g)+3H2(g)2NH3(g) ΔH=
-92.4 kJ·mol-1。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是 ( )
A.将1.0 mol氮气、3.0 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
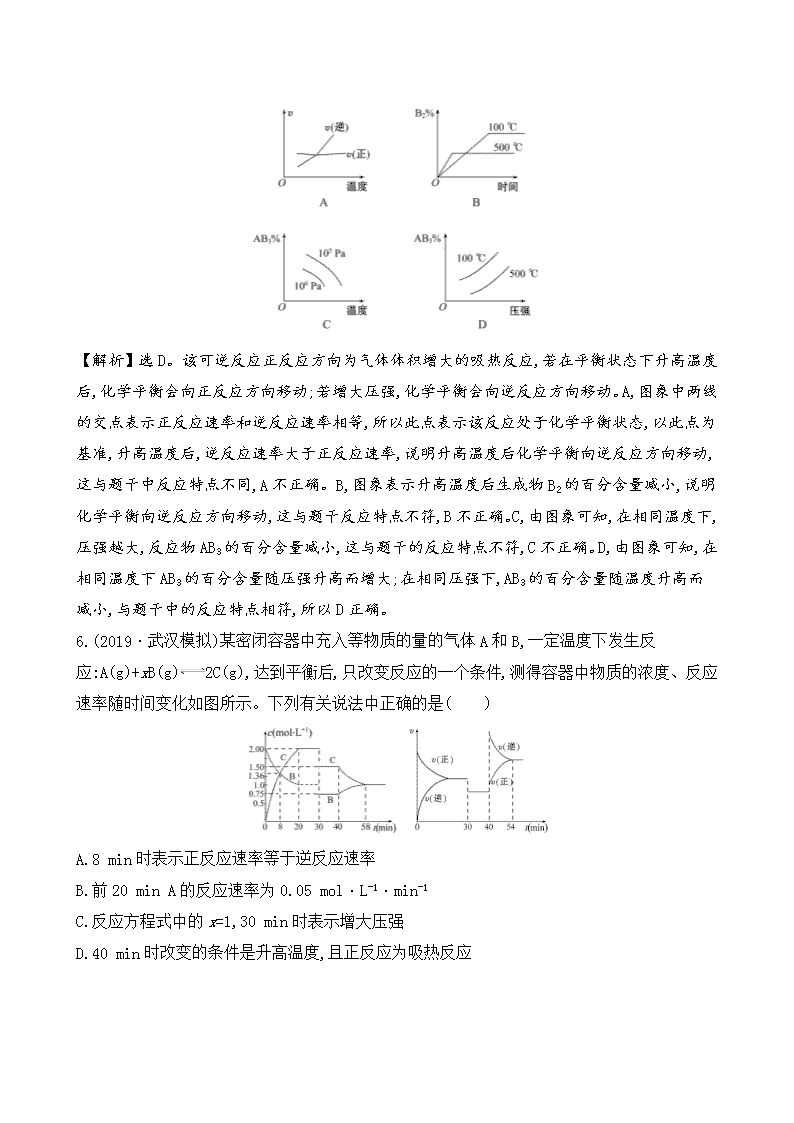
B.平衡状态由A变到B时,平衡常数K(A)0,下列图象正确的是 ( )
【解析】选D。该可逆反应正反应方向为气体体积增大的吸热反应,若在平衡状态下升高温度后,化学平衡会向正反应方向移动;若增大压强,化学平衡会向逆反应方向移动。A,图象中两线的交点表示正反应速率和逆反应速率相等,所以此点表示该反应处于化学平衡状态,以此点为基准,升高温度后,逆反应速率大于正反应速率,说明升高温度后化学平衡向逆反应方向移动,这与题干中反应特点不同,A不正确。B,图象表示升高温度后生成物B2的百分含量减小,说明化学平衡向逆反应方向移动,这与题干反应特点不符,B不正确。C,由图象可知,在相同温度下,压强越大,反应物AB3的百分含量减小,这与题干的反应特点不符,C不正确。D,由图象可知,在相同温度下AB3的百分含量随压强升高而增大;在相同压强下,AB3的百分含量随温度升高而减小,与题干中的反应特点相符,所以D正确。
6.(2019·武汉模拟)某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示。下列有关说法中正确的是( )
A.8 min时表示正反应速率等于逆反应速率
B.前20 min A的反应速率为0.05 mol·L-1·min-1
C.反应方程式中的x=1,30 min时表示增大压强
D.40 min时改变的条件是升高温度,且正反应为吸热反应
【解析】选B。8 min时B、C的物质的量浓度相等,并未达到平衡,A项错误;v(A)= v(C)=×=0.05 mol·L-1·min-1,B项正确;根据图象中的数据可知B、C的浓度变化量之比为1∶2,故x=1,30 min时B、C浓度瞬时同等程度下降,故改变的条件是降低压强,C项错误;40 min时升高温度,平衡逆向移动,则正反应为放热反应,D项错误。
二、非选择题(本题包括3小题,共52分)
7.(16分)在容积为2 L的恒容密闭容器中,存在反应:
CO2(g)+H2(g)CO(g)+H2O(g) ΔH=a kJ·mol-1。
(1)若开始时向容器加入2 mol氢气与4 mol二氧化碳气体,平衡时H2的转化率和温度t的关系如下表:
t(℃)
750
850
1 000
H2的转化率
0.5
0.7
上述反应中的a______0(填“>”“<”或“=”)。1 000 ℃时该反应的平衡常数为________。850 ℃时,若开始向该容器中通入的各气体的物质的量分别为1 mol CO、1.5 mol H2O、0.5 mol CO2和2 mol H2,则开始通入气体时,v(正)________ v(逆)(填“>”“<”或“=”)。
(2)下列图象正确,且能表明可逆反应:
CO2(g)+H2(g)CO(g)+H2O(g) ΔH=a kJ·mol-1达到平衡状态的是________(填序号)。
【解析】(1)由于H2的转化率随温度升高而增大,故CO2(g)+H2(g)CO(g)+H2O(g)为吸热反应,则ΔH>0,即a>0。运用“三段式”求1 000 ℃时的K值。
CO2(g)+H2(g)CO(g)+H2O(g)
起始物质的量(mol) 4 2 0 0
转化物质的量(mol) 1.4 1.4 1.4 1.4
平衡物质的量(mol) 2.6 0.6 1.4 1.4
则K1 000 ℃==,同理,可求得K850 ℃=1,由于开始加入各种气体时Qc=1.5>1,故反应正在逆向进行,即v(逆)>v(正)。(2)作为化学平衡状态的标志,须由原来的“变量”变到“不变量”,方可说明。在恒容条件下,由于各物质都为气态,则ρ为恒量,故密度不变不能说明化学反应达到平衡状态,a错误;b图,作为反应热,ΔH只与这个化学方程式有关,是一个不变量,它不会随着反应的进行而变化,b错误;c图,用化学反应速率判断可逆反应是否达到平衡状态时,一定是“异向”,且它们的反应速率之比等于化学计量数之比,c错误;d图,CO2的百分含量不变时,说明v(正)=v(逆),反应达到了平衡状态,d正确。
答案:(1)> < (2)d
8.(18分)(2019·大连模拟)十九大报告指出:坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
Ⅰ.汽车尾气中的NO(g)和CO(g)在一定条件下可发生如下反应:
反应①2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH1
(1)已知:反应②N2(g)+O2(g)2NO(g)
ΔH2=180.5 kJ·mol-1
CO的燃烧热为283.0 kJ·mol-1,则ΔH1=________。
(2)在密闭容器中充入5 mol CO和4 mol NO,发生上述反应①,图1为平衡时NO的体积分数与温度、压强的关系。
①温度:T1________T2(填“<”或“>”)。
②若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的______________点。
(3)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO
的转化率),结果如图2所示。若低于200 ℃,图2曲线中脱氮率随温度升高而变化不大的主要原因为 ___________________________;
a点________(填“是”或“不是”)对应温度下的平衡脱氮率,说明理由__
______________________________________________________________。
Ⅱ.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)2I(g)(快反应)
第二步I(g)+N2O(g)N2(g)+IO(g)(慢反应)
第三步2IO(g)+2N2O(g)2N2(g)+2O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。
下列表述正确的是________。
A.N2O分解反应中:k值与是否含碘蒸气无关
B.第二步对总反应速率起决定作用
C.第二步活化能比第三步小
D.IO为反应的中间产物
【解析】(1)已知②N2(g)+O2(g)2NO(g) ΔH2=180.5 kJ·mol-1,CO的燃烧热为283.0 kJ·mol-1,热化学反应方程式为③2CO(g)+O2(g)2CO2(g) ΔH=
-566.0 kJ·mol-1,③-②得①:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH1=-746.5 kJ·mol-1。
(2)由①2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=-746.5 kJ·mol-1,升高温度,平衡逆向移动,所以NO的体积分数会增大,即T1>T2;
②若在D点对反应容器升温的同时扩大体积使体系压强减小,则平衡会逆向移动,NO的体积分数增加,重新达到的平衡状态可能是图中A点。
(3)低于200 ℃,曲线Ⅰ脱氮率随温度升高而变化不大的主要原因为温度较低时(低于200 ℃),催化剂的活性偏低,对化学反应速率的影响小。a点不是对应温度下的平衡脱氮率,理由是该反应的正反应为放热反应,降低温度平衡向正反应方向移动,根据曲线Ⅱ可知,a点对应温度下的平衡转化率应高于450 ℃时,a点对应温度的平衡脱氮率应该更高。
(4)A.碘蒸气存在能大幅度提高N2O的分解速率,根据题中信息k为有碘蒸气存在时的N2O分解速率的速率常数,若没有碘存在,k就没有意义了,因此k
的取值与碘蒸气有关,故A错误;B.第二步反应慢,所以对总反应速率起决定作用,故B正确;C.第二步反应比第三步反应慢,说明第二步活化能大,故C错误;D.从总反应2N2O(g)2N2(g)+O2(g)来看IO在反应前没有、反应后也没有,故其为反应的中间产物,故D正确。
答案:(1)-746.5 kJ·mol-1 (2)①> ②A (3)温度较低时,催化剂的活性偏低 不是 该反应为放热反应,根据曲线Ⅱ可知,a点对应温度的平衡脱氮率应该更高 (4)BD
9.(18分)(2019·贵州模拟)“绿水青山就是金山银山”。目前人们对环境保护、新能源开发很重视,研究NO2、NO、CO、SO2等大气污染物转化为能参与大气循环的物质,对建设美丽中国具有重要意义。
(1)有人设计通过硫循环完成CO的综合处理,原理为
a.2CO(g)+SO2(g)S(l)+2CO2(g)
ΔH1=-37.4 kJ·mol-1
b.S(l)+2H2O(g)2H2(g)+SO2(g)
ΔH2=-45.4 kJ·mol-1
则CO和水蒸气完全反应生成H2和CO2的热化学方程式为________________。
(2)CO可在一定条件下转化为CH3OH。已知:向2 L密闭容器中通入2 mol CO和4 mol H2,在合适的催化剂和T1温度下,发生反应CO(g)+2H2(g)CH3OH(g) ΔH<0,10 min时达到平衡状态,10 min后改变温度为T2,20 min时达到平衡状态,反应过程中部分数据见表:
反应时间
CO(mol)
H2(mol)
CH3OH(mol)
0 min
2
4
0
10 min
2
20 min
0.2
①前10 min内的平均反应速率v(CO)=________;在20 min时,温度T2下,该反应的化学平衡常数为____________。
②若30 min时升高温度,化学平衡常数值________(填“增大”“减小”或“不变”)。
③在T1温度下,能增大反应速率和提高CO平衡转化率的措施有__(填两种措施即可)。
④在恒温恒容下,下列可以判断CO(g)+2H2(g)CH3OH(g)反应达到平衡状态的是________(填字母)。
a.2v正(H2)=v逆(CH3OH)
b.混合气体的物质的量不再变化
c.单位时间内有1 mol CO消耗同时消耗2 mol H2
d.混合气体的平均相对分子质量不变
(3)已知反应2NO(g)+O2(g)2NO2的正反应速率v正=k1cm(NO)cn(O2),其中k1为速率常数,可通过下表实验数据计算k1、m、n。
组别
起始浓度/mol·L-1
初始速率/mol·L-1·s-1
NO
O2
1
0.02
0.012 5
7.98×10-3
2
0.02
0.025 0
15.96×10-3
3
0.04
0.012 5
31.92×10-3
则k1=________,m=________,n=________。
【解析】(1)将(a+b)/2得:CO(g)+H2O(g)H2(g)+CO2(g) ΔH=-41.4 kJ·mol-1。
(2)①容器体积为2 L,根据表格数据列出三段式:
CO(g)+ 2H2(g)CH3OH(g)
c始(mol·L-1): 1 2 0
Δc(mol·L-1): 0.5 1 0.5
c10 min(mol·L-1): 0.5 1 0.5
则:v===0.05 mol·L-1·min-1;
CO(g)+2H2(g) CH3OH(g)
c10 min(mol·L-1): 0.5 1 0.5
Δc(mol·L-1): 0.4 0.8 0.4
c20 min(mol·L-1): 0.1 0.2 0.9
K==225。
②对于CO(g)+2H2(g)CH3OH(g),ΔH<0是放热反应,温度升高,平衡逆向移动,平衡常数减小。③增大压强,反应速率增大,平衡正向移动,CO平衡转化率提高;增大氢气的浓度,反应速率增大,平衡正向移动,CO平衡转化率提高。④a.2v正(H2)=v逆(CH3OH),v正(H2)∶v逆(CH3OH)=1∶2,不等于化学计量数之比,不能作为判断平衡的标志;b.CO(g)+2H2(g)CH3OH(g),左右气体化学计量数不等,混合气体的物质的量不再变化可判断平衡;c.单位时间内有1 mol CO消耗同时消耗2 mol H2都是正反应,不可以判断平衡;d.CO(g)+2H2(g)CH3OH(g),左右气体化学计量数不等,平均相对分子质量保持不变可判断平衡。
(3)将三组数据分别代入v正=k1cm(NO)cn(O2)得:
k1×0.02m×0.012 5n=7.98×10-3
k1×0.02m×0.025n=15.96×10-3
k1×0.04m×0.012 5n=31.92×10-3
解得:k1=1 596,m=2,n=1。
答案:(1)CO(g)+H2O(g)H2(g)+CO2(g) ΔH=-41.4 kJ·mol-1 (2)①
0.05 mol·L-1·min-1 225 ②减小 ③增大压强或增大氢气浓度或按原比例等倍加入反应物 ④bd (3)1 596 2 1
【加固训练】
(2019·沈阳模拟)为了解决温室效应和资源短缺目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+3H2(g)CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为
kJ·mol-1)的变化。
(1)在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中能使c(CH3OH)增大的是_______________________。
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2
(2)根据图象可知,在反应过程中H2O的物质的量分数随温度变化如图所示:
①T0对应的反应速率v正和v逆的关系是________(用含“>”“<”“=”表示,下同);T0之后,H2O的物质的量分数减小的原因是__ ____________________。
②X、Y两点A物质正反应速率的大小关系是____________________。
(3)某同学结合影响反应速率和化学平衡的因素,绘制出下面的图象,其中正确的是________。
【解析】(1)根据图象可知,反应物的能量大于生成物的能量,推知该反应是放热反应。升高温度,平衡逆向移动,c(CH3OH)减小,a项错误;恒容时充入He(g),对平衡无影响,b项错误;将H2O(g)从体系中分离出来,平衡正向移动,c(CH3OH)增大,c项正确;再充入1 mol CO2,平衡正向移动,使c(CH3OH)增大,d项正确。
(2)T0时反应达到平衡,故v正=v逆;T0之后,升高温度,平衡逆向移动,H2O的物质的量分数减小;升高温度,反应速率增大,故X点的反应速率小于Y点的反应速率。
(3)根据甲图可知,加压后,正、逆反应速率都增大,平衡后加压,v正>v逆,即平衡正向移动与反应特点一致,甲图正确;升高温度时,正、逆反应速率都应该增大,乙图错误。
答案:(1)cd
(2)①v正=v逆 T0之后,升高温度,平衡逆向移动,H2O的物质的量分数减小 ②X
查看更多