- 2021-05-23 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习化学工艺流程作业
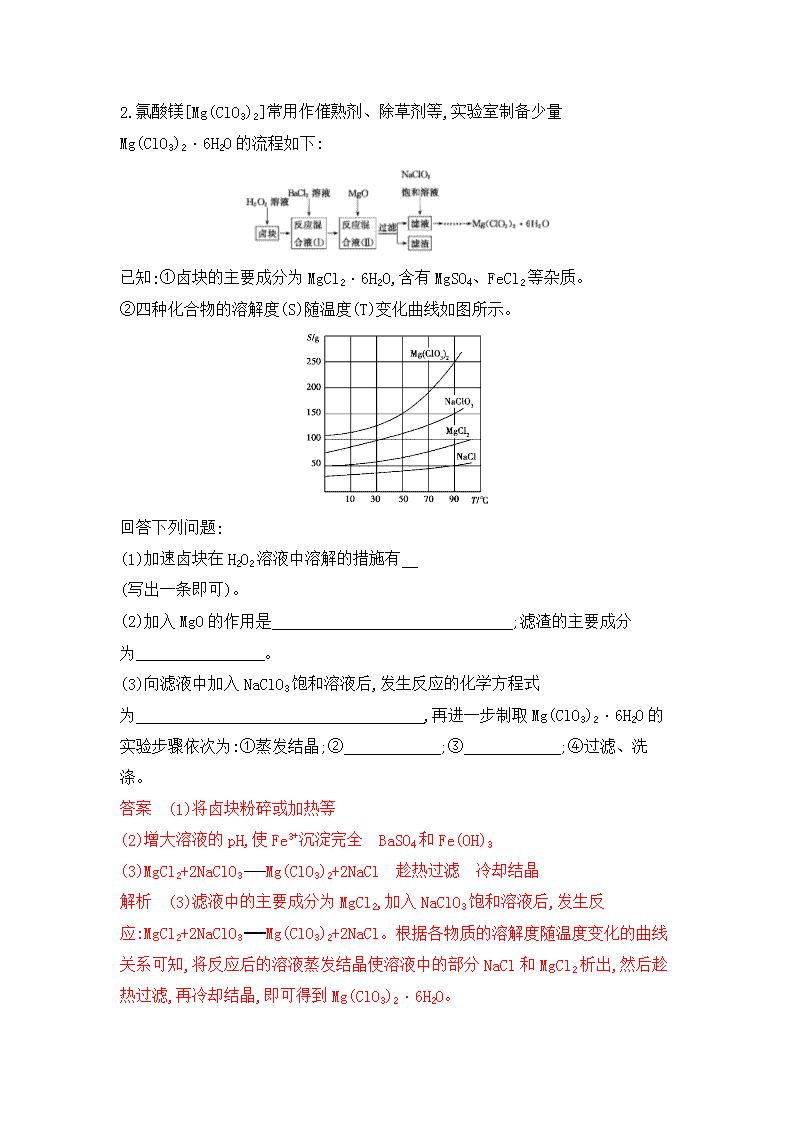
化学工艺流程 1.工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的简要工艺流程如图: 已知:碳酸钠的饱和溶液在不同温度下析出的溶质如图所示: (1)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释) 。 (2)“趁热过滤”时的温度应控制在 。 (3)已知:Na2CO3·10H2O(s)Na2CO3(s)+10H2O(g) ΔH=+532.36 kJ· mol-1 Na2CO3·10H2O(s)Na2CO3·H2O(s)+9H2O(g) ΔH=+473.63kJ· mol-1 写出Na2CO3·H2O脱水反应的热化学方程式: 。 (4)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用,请你分析实际生产中是否可行: ,其理由是 。 答案 (1)Na2CO3在溶液中存在水解平衡CO32-+H2OHCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强 (2)36 ℃以上 (3)Na2CO3·H2O(s)Na2CO3(s)+H2O(g) ΔH= +58.73 kJ·mol-1 (4)不可行 若“母液”循环使用,则溶液中c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质 2.氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下: 已知:①卤块的主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。 ②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。 回答下列问题: (1)加速卤块在H2O2溶液中溶解的措施有 (写出一条即可)。 (2)加入MgO的作用是 ;滤渣的主要成分为 。 (3)向滤液中加入NaClO3饱和溶液后,发生反应的化学方程式为 ,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①蒸发结晶;② ;③ ;④过滤、洗涤。 答案 (1)将卤块粉碎或加热等 (2)增大溶液的pH,使Fe3+沉淀完全 BaSO4和Fe(OH)3 (3)MgCl2+2NaClO3Mg(ClO3)2+2NaCl 趁热过滤 冷却结晶 解析 (3)滤液中的主要成分为MgCl2,加入NaClO3饱和溶液后,发生反应:MgCl2+2NaClO3Mg(ClO3)2+2NaCl。根据各物质的溶解度随温度变化的曲线关系可知,将反应后的溶液蒸发结晶使溶液中的部分NaCl和MgCl2析出,然后趁热过滤,再冷却结晶,即可得到Mg(ClO3)2·6H2O。 3.钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。一种制备草酸钴晶体(CoC2O4·2H2O)的工艺流程如下: 已知:①水钴矿主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等杂质。 ②浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等。 ③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表: 沉淀物 Fe(OH)3 Fe(OH)2 Co(OH)2 Al(OH)3 Mn(OH)2 开始沉淀pH 2.7 7.6 7.6 4.0 7.7 完全沉淀pH 3.7 9.6 9.2 5.2 9.8 (1)写出浸出过程中Co(OH)3发生反应的离子方程式: 。 (2)NaClO3的作用是 。 (3)加Na2CO3调pH的范围应该在 之间。加入萃取剂的目的是 。 (4)在空气中加热5.49 g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表: 温度范围/℃ 固体质量/g 150~210 4.41 290~320 2.41 890~920 2.25 经测定,210~290 ℃过程中产生的气体只有CO2,此过程中发生反应的化学方程式是 。[M(CoC2O4·2H2O)=183 g/mol] 答案 (1)2Co(OH)3+SO32-+4H+2Co2++SO42-+5H2O (2)将Fe2+氧化成Fe3+ (3)5.2~7.6 除去Mn2+ (4)3CoC2O4+2O2Co3O4 +6CO2 4.工业上利用氧化铝基废催化剂(主要成分为Al2O3,含少量Pd)回收Al2(SO4)3及Pd的流程如下: (1)焙烧时产生的气体X为 (填化学式)。 (2)浸液Y中的主要成分为 (填化学式)。 (3)“热还原”过程中发生反应的化学方程式为 。 (4)题给流程中焙烧温度不宜过高,否则会导致硫酸铵固体分解。某兴趣小组为探究高温下硫酸铵的分解产物,通过下列装置进行实验,观察到B中溶液颜色变浅,C中无明显现象。 ①装置B中的现象说明硫酸铵的分解产物中有 。 ②进一步测定可知,D中收集到的气体相对分子质量为28。写出(NH4)2SO4固体高温分解的化学方程式: 。 (5)Pd是优良的储氢金属,其储氢原理为2Pd(s)+xH2(g)2PdHx(s),其中x的最大值为0.8。已知:Pd的密度为12 g·cm-3,则1 cm3 Pd能够储存标准状况下H2的最大体积为 L(计算结果保留整数)。 答案 (1)NH3 (2)H2PdCl6 (3)(NH4)2PdCl6+2H2Pd+2NH3+6HCl (4)①SO2 ②3(NH4)2SO4 4NH3↑+N2↑+3SO2↑+6H2O↑ (5)1 解析 (1)硫酸铵焙烧时生成氨气、水蒸气和三氧化硫,三氧化硫与废催化剂中的氧化铝反应生成硫酸铝,故气体X为NH3。 (2)根据流程图,滤渣中的Pd与浓硝酸和浓盐酸的混合液反应的生成物与氨气反应生成(NH4)2PdCl6,可知浸液Y中的主要成分为H2PdCl4。 (3)根据流程图,“热还原”过程中(NH4)2PdCl6发生反应后生成Pd,反应的化学方程式为(NH4)2PdCl4+2H2Pd+2NH3+6HCl。 (4)①根据题意,B中品红溶液颜色变浅,说明生成了二氧化硫。 ②D中收集到的气体相对分子质量为28,为N2。C中无明显现象,说明没有氧气等氧化性物质生成,则(NH4)2SO4固体高温分解的产物主要有氮气、二氧化硫、氨气和水蒸气,反应的化学方程式为3(NH4)2SO44NH3↑+N2↑+3SO2↑+6H2O↑。(5)1 cm3 Pd的质量为12 g,物质的量为12 g106 g/mol=12106 mol,最多可储存H2的物质的量为0.8×12×12106 mol,标准状况下的体积为0.8×12×12106 mol×22.4 L/mol≈1 L。 5.ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取。 已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。 ②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。 金属离子 Fe3+ Al3+ ZrO2+ 开始沉淀时pH 1.9 3.3 6.2 沉淀完全时pH 3.2 5.2 8.0 (1)熔融时ZrSiO4发生反应的化学方程式为 ,滤渣Ⅰ的化学式为 。 (2)为使过滤Ⅰ所得滤液中的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是 ;继续加氨水至pH=b时,所发生反应的离子方程式为 。 (3)向过滤Ⅲ所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为 。 (4)为得到纯净的ZrO2,需要洗涤Zr(OH)4,检验Zr(OH)4是否洗涤干净的方法是 。 答案 (1)ZrSiO4+4NaOHNa2SiO3+Na2ZrO3+2H2O H2SiO3 (2)5.2查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档